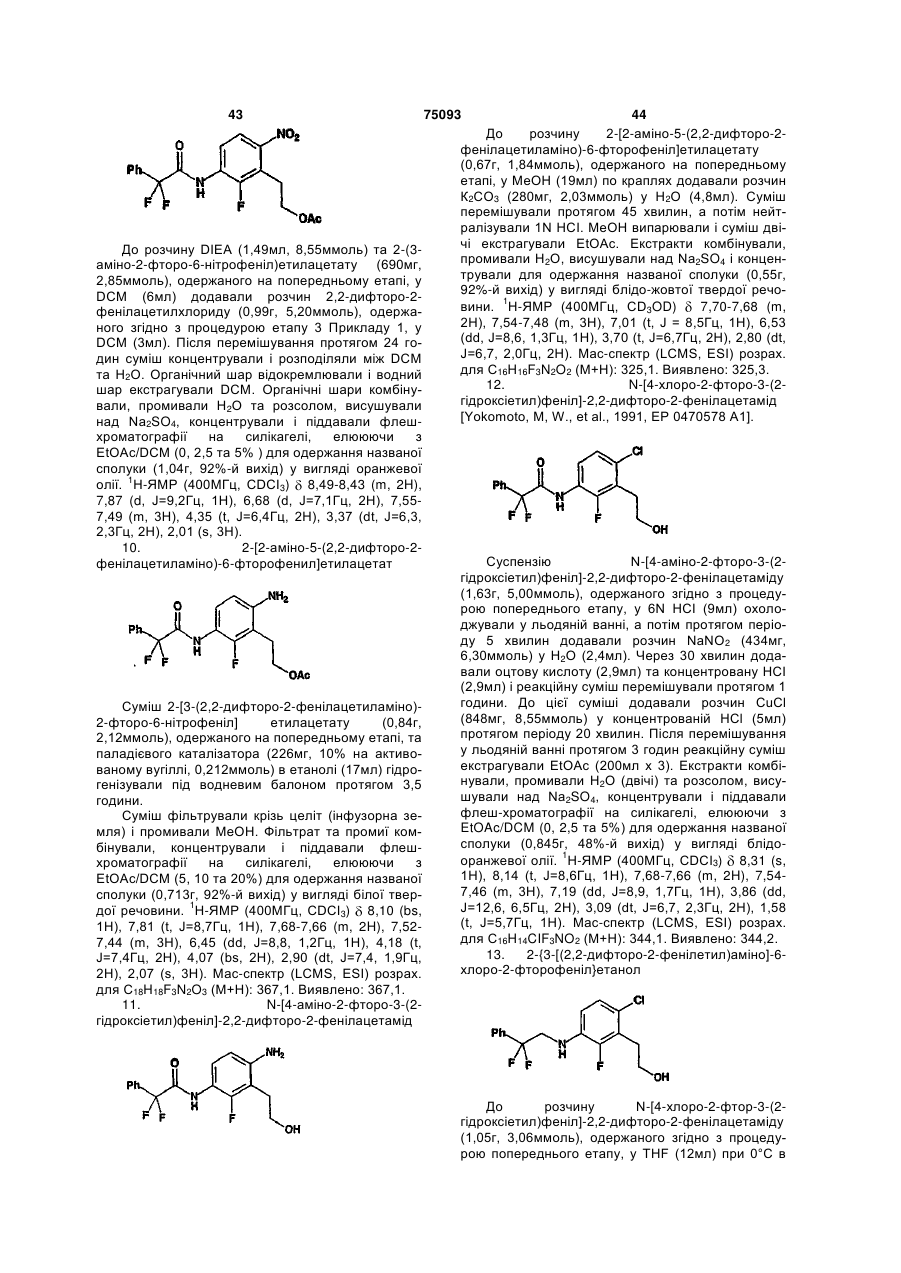
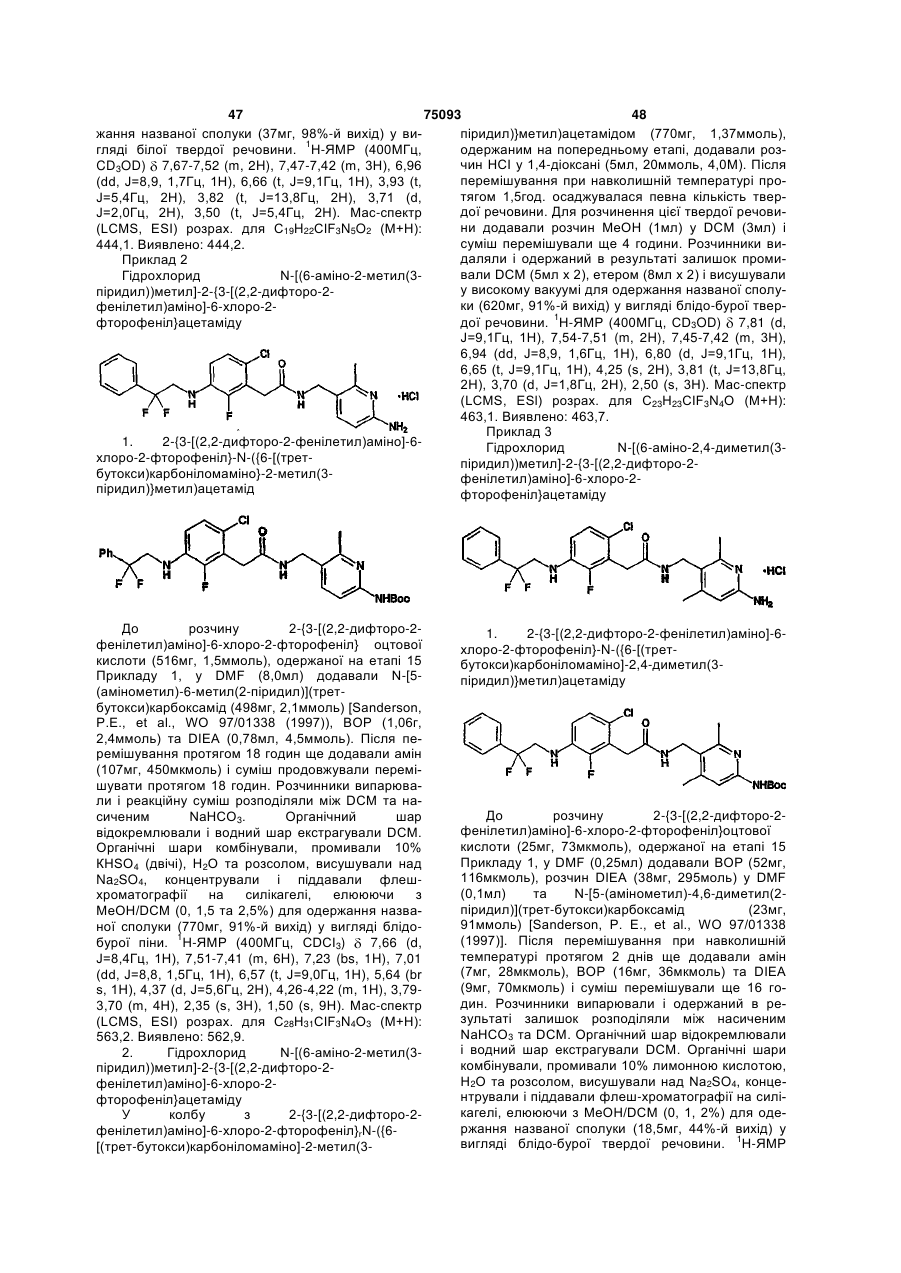
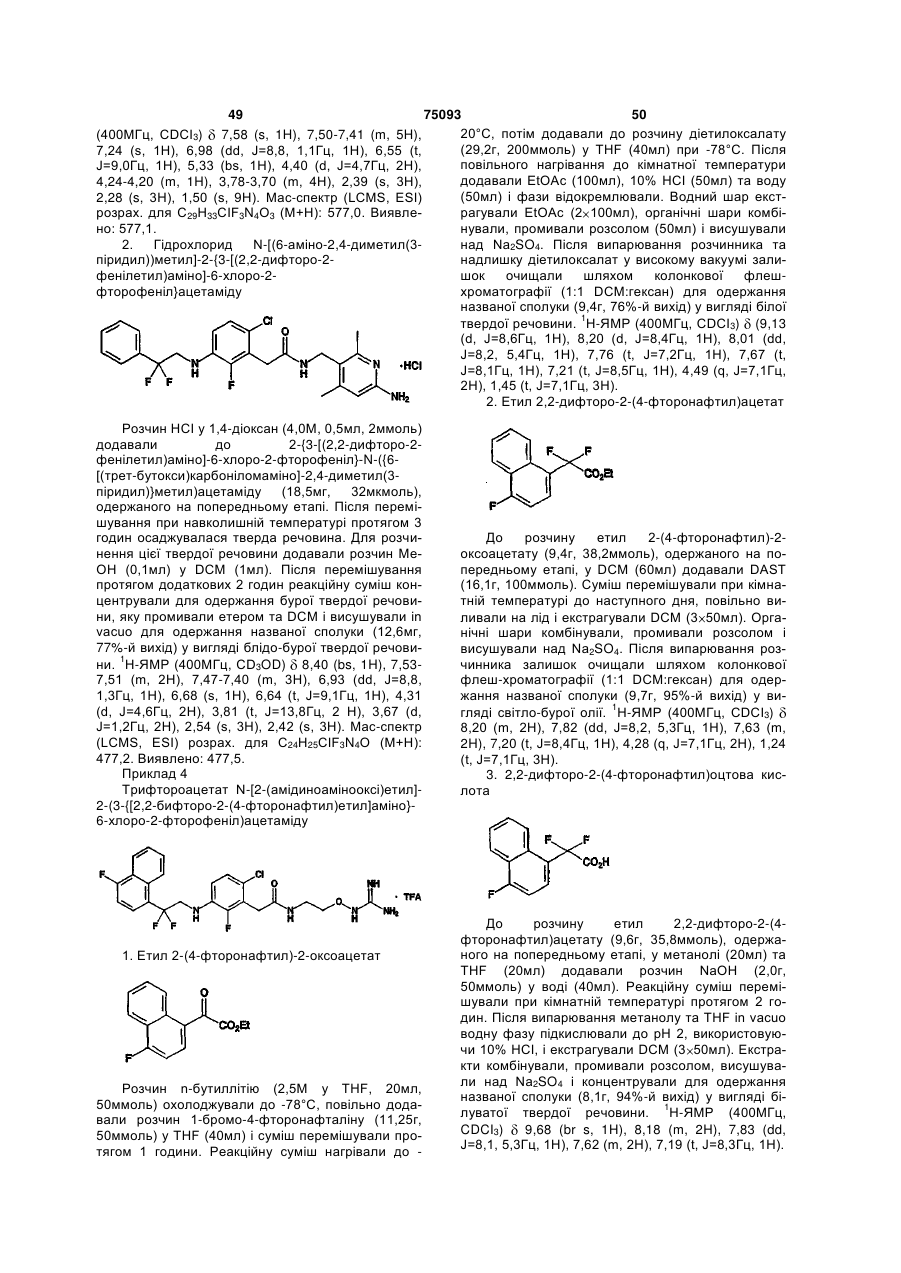
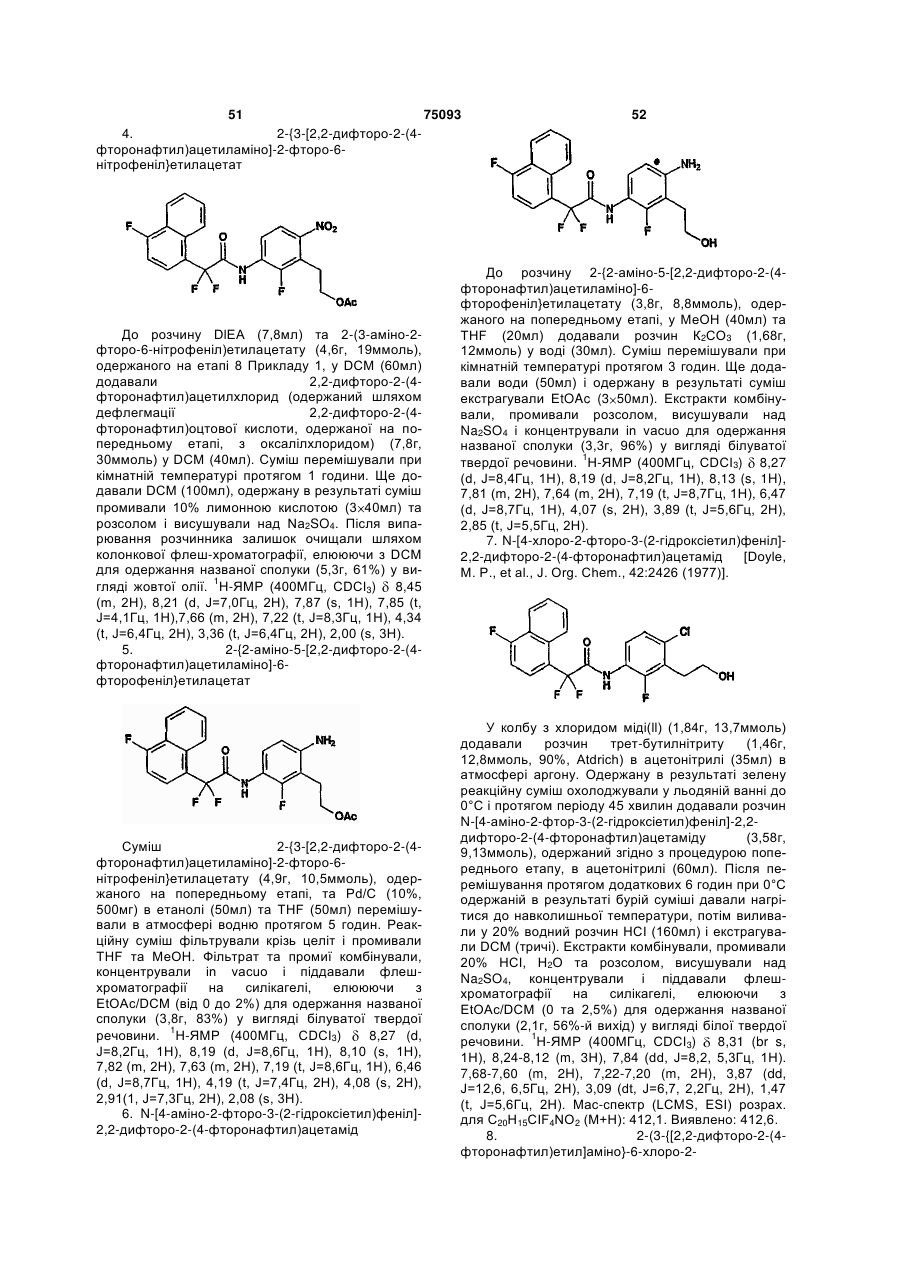
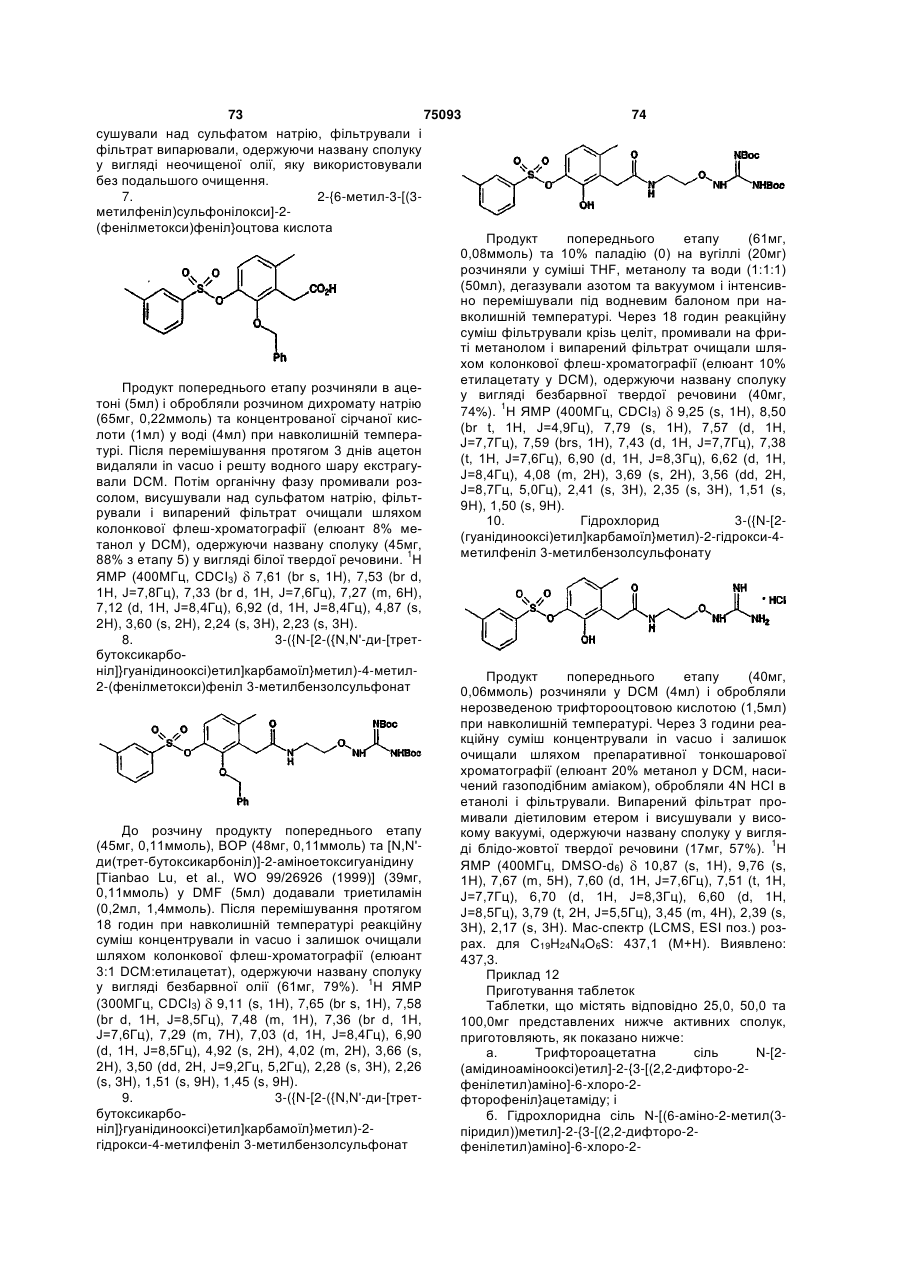
Амінопіридиніл-, аміногуанідиніл-, та алкоксигуанідинілзаміщені фенілацетаміди як інгібітори протеази
Номер патенту: 75093
Опубліковано: 15.03.2006
Автори: Маркотен Томас П., Томчук Брюс Е., Пен Уенксі, Лу Тьянбао
Формула / Реферат
1. Сполука формули І:
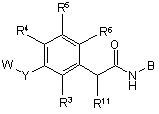 , I
, I
у якій
W є воднем, R1, R1OC(O), R1C(O), R1(CH2)sNHC(O), R1S(O)2 або (R1)2CH(CH2)sNHC(O), де s приймає значення 0-4;
R1 є,
R2,
R2(CH2)tC(R12)2, де t є 0-3, і кожен з R12 може бути таким самим або іншим,
(R2)(OR12)CH(CH2)p, де р приймає значення 1-4,
(R2)2(OR12)C(CH2)p, де р приймає значення 1-4,
R2C(R12)2(CH2)t, де t приймає значення 0-3, і кожен з R12 може бути таким самим або іншим, де (R12)2 також може утворювати кільце з С, представленим С3-9 циклоалкілом,
R2СF2С(R12)2(CH2)q, де q є 0-2, і кожен з R12 може бути таким самим або іншим, де (R12)2 також може утворювати кільце з С, представленим С3-9 циклоалкілом,
R2CH2C(R12)2(CH2)q, де q є 0-2, і кожен з R12 може бути таким самим або іншим, де (R12)2 також може утворювати кільце з С, представленим С3-9 циклоалкілом,
(R2)2CH(CH2)r, де r приймає значення 0-4, і кожен з R2 може бути таким самим або іншим, і де (R2)2 також може утворювати кільце з СН, представлене С3-9 циклоалкілом, C7-12 біциклічним алкілом, С10-16 трициклічним алкілом або 5-7-членним моно- або біциклічним гетероциклічним кільцем, яке може бути насиченим або ненасиченим і яке містить від одного до трьох гетероатомів, вибраних із групи, яка складається з N, О та S,
R2O(CH2)p, де р є 2-4,
(R2)2CF(CH2)r, де r є 0-4, і кожен з R2 може бути таким самим або іншим, де (R2)2 також може утворювати кільце з С, представленим С3-9 циклоалкілом, C7-12 біциклічним алкілом, С10-16 трициклічним алкілом або 5-7-членним моно- або біциклічним гетероциклічним кільцем, яке може бути насиченим або ненасиченим і яке містить від одного до трьох гетероатомів, вибраних із групи, яка складається з N, О та S,
 ,
,
 ,
,
де s приймає значення 0 або 1, або
R2CF2C(R12)2;
R2 є
фенілом, нафтилом або біфенілом, кожен з яких є незаміщеним або заміщеним одним або кількома С1-4 алкілами, С1-4 алкокси, галогенами, гідрокси, СF3, ОСF3, СООН, CONH2 або SO2NH2,
5-7-членним моно- або 9-10-членним біциклічним гетероциклічним кільцем або негетероциклічним кільцем, яке може бути насиченим або ненасиченим, причому гетероциклічне кільце містить від одного до чотирьох гетероатомів, вибраних із групи, яка складається з N, О та S, і гетероциклічне або негетероциклічне кільце є незаміщеним або заміщеним галогеном або гідрокси,
С1-12 алкілом, незаміщеним або заміщеним одним або кількома гідрокси, СООН, аміно, необов'язково С1-3 алкілзаміщеним арилом, С3-9 циклоалкілом, СF3, N(CH3)2, гетероарилом або гетероциклоалкілом,
СF3,
С3-9 циклоалкілом, який незаміщений або заміщений арилом,
С7-12 біциклічним алкілом або
С10-16 трициклічним алкілом;
Y є -NH- або -О-;
R3, R4, R5 та R6 незалежно є воднем, алкілом, циклоалкілом, алкенілом, алкінілом, необов'язково заміщеним арилом, необов'язково заміщеним аралкілом, необов'язково заміщеним гетероарилом, галоалкілом, гідрокси, алкокси, арилокси, гетероарилокси, галогеном, галоалкокси, гідроксіалкілом, ціано, нітро, -CO2Rх, -CH2ORх або -ORх,
де Rх у кожному випадку незалежно є воднем, С1-12 алкілом або С3-9 циклоалкілом, причому вищезгадана С1-12 алкільна або С3-9 циклоалкільна групи необов'язково можуть мати одну або кілька ненасиченостей;
R11 є воднем, алкілом або алкенілом;
R12 є
воднем або галогеном,
фенілом, нафтилом або біфенілом, кожен з яких є незаміщеним або заміщеним одним або кількома С1-4 алкілами, С1-4 алкокси, галогенами, гідрокси, СF3, ОСF3, СООН або CONH2,
5-7-членним моно- або 9-10-членним біциклічним гетероциклічним кільцем, яке може бути насиченим або ненасиченим і яке містить від одного до чотирьох гетероатомів, вибраних із групи, яка складається з N, О та S,
С1-12 алкілом, незаміщеним або заміщеним одним або кількома гідрокси, СООН, аміно, С6-14 арилом, гетероарилом або гетероциклоалкілом,
СF3,
С3-9 циклоалкілом,
С7-12 біциклічним алкілом або
С10-16 трициклічним алкілом;
В є вибраним з групи, яка складається з:
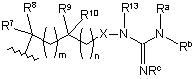 або
або
 ,
,
де
R7, R8, R9 та R10 незалежно є воднем, алкілом, аралкілом, арилом, гідроксіалкілом, аміноалкілом, моноалкіламіноалкілом, діалкіламіноалкілом або карбоксіалкілом;
або R7 та R8 разом утворюють -(СH2)u-, де
u приймає значення від 2 до 7, в оптимальному варіанті - від 2 до 5, а R9 та R10 є такими, як визначено вище;
або R9 та R10 разом утворюють -(СН2)v-, де
v приймає значення від 2 до 7, в оптимальному варіанті - від 2 до 5, а R7 та R8 є такими, як визначено вище;
або R7 та R9 разом утворюють -(СН2)у-, де
у є 0 (зв'язок) або від 1 до 7, в оптимальному варіанті - 0-4, а R8 та R10 є такими, як визначено вище;
Х є -О-, -NR18- або -CH=N- (де N є зв'язаним з NR13), де R18 є воднем, алкілом, циклоалкілом або арилом, причому вищезгаданий алкіл, циклоалкіл або арил є необов'язково заміщеним аміно, моноалкіламіно, діалкіламіно, алкокси, гідрокси, карбокси, алкоксикарбонілом, арилоксикарбонілом, аралкоксикарбонілом, арилом, гетероарилом, ациламіно, ціано або трифторметилом;
Ra, Rb та Rc незалежно є воднем, алкілом, гідрокси, алкокси, арилокси, аралкокси, алкоксикарбонілокси, ціано або -CO2Rw, де Rw є С1-12 алкілом, С3-9 циклоалкілом, С6-14 арилом, С6-14ар(С1-12) алкілом,
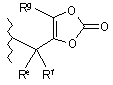 або
або 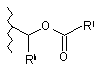 ,
,
де Re та Rf незалежно є воднем, С1-6 алкілом, С2-6 алкенілом або С6-14 арилом, Rg є воднем, С1-6 алкілом, С2-6 алкенілом або С6-14 арилом, Rh є воднем, С1-6 алкілом, С2-6 алкенілом або С6-14 арилом, і Ri є С6-14ар(С1-12) алкілом або С1-12 алкілом;
n приймає значення від нуля до 8; і
m приймає значення від нуля до 6;
R13 є воднем, алкілом, алкенілом, аралкілом, арилом, гідроксіалкілом, аміноалкілом, моноалкіламіноалкілом, діалкіламіноалкілом або карбоксіалкілом;
R14 та R15 незалежно є воднем, алкілом, циклоалкілом, галогеном або алкокси; і
R16 та R17 незалежно є воднем, алкілом, гідрокси, алкокси, арилокси, алкоксикарбонілом, ціано або -CO2Rj, де Rj є С1-12 алкілом, С3-9 циклоалкілом, С6-14 арилом, С6-14ар(С1-12) алкілом, гало(С1-12) алкілом або
 ,
,
де Re, Rf тa Rg незалежно є воднем або С1-12 алкілом,
або її сольват, гідрат або фармацевтичнo прийнятна сіль.
2. Сполука формули (І):
 , (І)
, (І)
у якій
W є воднем, R1, R1OC(O), R1C(O), R1(CH2)sNHC(O), R1S(O)2 або (R1)2CH(CH2)sNHC(O), де s приймає значення 0-4;
R1 є
R2,
R2(CH2)tC(R12)2, де t приймає значення 0-3, і кожен з R12 може бути таким самим або іншим,
(R2)(OR12)CH(CH2)p, де р приймає значення 1-4,
(R2)2(OR12)C(CH2)p, де р приймає значення 1-4,
R2C(R12)2(CH2)t, де t приймає значення 0-3, і кожен з R12 може бути таким самим або іншим, де (R12)2 також може утворювати кільце з С, представленим С3-9 циклоалкілом,
R2СF2С(R12)2(CH2)q, де q є 0-2, і кожен з R12 може бути таким самим або іншим, де (R12)2 також може утворювати кільце з С, представленим С3-9 циклоалкілом,
R2CH2C(R12)2(CH2)q, де q є 0-2, і кожен з R12 може бути таким самим або іншим, де (R12)2 також може утворювати кільце з С, представленим С3-9 циклоалкілом,
(R2)2CH(CH2)r, де r приймає значення 0-4, і кожен з R2 може бути таким самим або іншим, і де (R2)2 також може утворювати кільце з СН, представленим С3-9 циклоалкілом, C7-12 біциклічним алкілом, С10-16 трициклічним алкілом або 5-7-членним моно- або біциклічним гетероциклічним кільцем, яке може бути насиченим або ненасиченим і яке містить від одного до трьох гетероатомів, вибраних із групи, яка складається з N, О та S,
R2O(CH2)p, де р є 2-4,
(R2)2CF(CH2)r, де r є 0-4, і кожен з R2 може бути таким самим або іншим, де (R2)2 також може утворювати кільце з С, представленим С3-9 циклоалкілом, C7-12 біциклічним алкілом, С10-16 трициклічним алкілом або 5-7-членним моно- або біциклічним гетероциклічним кільцем, яке може бути насиченим або ненасиченим і яке містить від одного до трьох гетероатомів, вибраних із групи, яка складається з N, О та S,
 ,
,
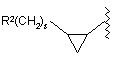 ,
,
де s приймає значення 0 або 1, або
R2CF2C(R12)2;
R2 є
фенілом, нафтилом або біфенілом, кожен з яких є незаміщеним або заміщеним одним або кількома С1-4 алкілами, С1-4 алкокси, галогенами, гідрокси, СF3, ОСF3, СООН, CONH2 або SO2NH2,
5-7-членним моно- або 9-10-членним біциклічним гетероциклічним кільцем або негетероциклічним кільцем, яке може бути насиченим або ненасиченим, причому гетероциклічне кільце містить від одного до чотирьох гетероатомів, вибраних із групи, яка складається з N, О та S, і гетероциклічне або негетероциклічне кільце є незаміщеним або заміщеним галогеном або гідрокси,
С1-12 алкілом, незаміщеним або заміщеним одним або кількома гідрокси, СООН, аміно, необов'язково С1-3 алкілзаміщеним арилом, С3-9 циклоалкілом, СF3, N(CH3)2, гетероарилом або гетероциклоалкілом,
СF3,
С3-9 циклоалкілом, який незаміщений або заміщений арилом,
С7-12 біциклічним алкілом або
С10-16 трициклічним алкілом;
Y є -NH- або -О-;
R3, R4, R5 та R6 незалежно є воднем, С1-12 алкілом, С3-9 циклоалкілом, галогеном, С2-20 алкенілом, C2-20 алкінілом, необов'язково заміщеним С6-14 арилом, необов'язково заміщеним С6-14ар(С1-12) алкілом, необов'язково заміщеним гетероарилом, гало(С1-12) алкілом, С1-12 алкокси, С6-14 арилокси, гетероарилокси, гало(С1-20)алкокси або гідроксі(С1-12) алкілом;
R11 є воднем, С1-12 алкілом або С2-20 алкенілом,
R12 є
воднем або галогеном, фенілом,
нафтилом або біфенілом, кожен з яких є незаміщеним або заміщеним одним або кількома С1-4 алкілами, С1-4 алкокси, галогенами, гідрокси, CF3, OCF3, COOH або CONH2,
5-7-членним моно- або 9-10-членним біциклічним гетероциклічним кільцем, яке може бути насиченим або ненасиченим і яке містить від одного до чотирьох гетероатомів, вибраних із групи, яка складається з N, О та S,
С1-12 алкілом, незаміщеним або заміщеним одним або кількома гідрокси, СООН, аміно, С6-14 арилом, гетероарилом або гетероциклоалкілом,
СF3,
С3-9 циклоалкілом,
С7-12 біциклічним алкілом або
С10-16 трициклічним алкілом;
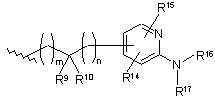
В є вибраним з групи, яка складається з:
 або
або
 ,
,
де
R7, R8, R9 та R10 незалежно є воднем, С1-12 алкілом, С6-14ар(С1-12)алкілом, С6-14 арилом, гідроксі(С1-12) алкілом, аміно(С1-12) алкілом, моно(С1-12)алкіламіно(С1-12) алкілом, ді(С1-12)алкіламіно(С1-12) алкілом або карбоксі(С1-12) алкілом;
X є –O-, –NR18- або –CH=N- (де N є зв’язаним з NR13), де
R18 є С1-12 алкілом, С3-9 циклоалкілом або С6-14 арилом, кожен з яких є необов'язково заміщеним аміно, моно(С1-12) алкіламіно, ді(С1-12) алкіламіно, С1-20 алкокси, гідрокси, карбокси, С1-20 алкоксикарбонілом, С6-14 арилоксикарбонілом, С6-14ар(С1-20) алкоксикарбонілом, С6-14 арилом, С5-10 гетероарилом, ациламіно, ціано або трифторметилом;
Ra, Rb та Rc незалежно є С1-12 алкілом, С1-20 алкокси, С6-14 арилокси, С6-14ар(С1-20) алкокси або С1-20 алкоксикарбонілокси;
n приймає значення від нуля до 8; і
m приймає значення від нуля до 6;
R13 є С1-12 алкілом, С1-20 алкокси, С6-14 арилокси або С1-20 алкоксикарбонілом;
R14 та R15 незалежно є С1-12 алкілом, С3-9 циклоалкілом або С1-20 алкокси; і
R16 та R17 незалежно є С1-12 алкілом, С1-20 алкокси, С6-14 арилокси або С1-20 алкоксикарбонілом,
або її сольват, гідрат або фармацевтичнo прийнятна сіль.
3. Сполука за п. 1, яка відрізняється тим, що В являє собою
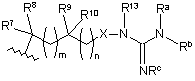 .
.
4. Сполука за п. 1, яка відрізняється тим, що В являє собою
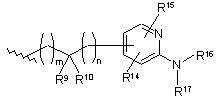 .
.
5. Сполука за будь-яким з пп. 1-4, яка відрізняється тим, що Y являє собою -NH-.
6. Сполука за будь-яким з пп. 1-5, яка відрізняється тим, що W являє собою R1 або R1S(O)2, де R1 є R2, і R2 необов'язково є заміщеним арилом або С1-7 алкілом, заміщеним арилом.
7. Сполука за будь-яким з пп. 1-5, яка відрізняється тим, що W є R1, де R1 є R2 або R2CF2C(R12)2(CH2)q, і R2 є необов'язково заміщеним арилом або С1-7 алкілом, заміщеним арилом, R12 є воднем, і q приймає значення нуль.
8. Сполука за будь-яким з пп. 1 та 3-7, яка відрізняється тим, що R6 являє собою С1-6 алкіл або галоген.
9. Сполука за п. 8, яка відрізняється тим, що R6 являє собою метил, хлор або фтор.
10. Сполука за п. 9, яка відрізняється тим, що R6 являє собою хлор, а R3 являє собою фтор або гідроксигрупу.
11. Сполука за будь-яким з пп. 1, 3-10, яка відрізняється тим, що R11 являє собою водень.
12. Сполука за будь-яким з пп. 1, 3 та 5-11, яка відрізняється тим, що кожен з Ra, Rb, Rc та R13 являють собою водень.
13. Сполука за будь-яким з пп. 1 та 3-12, яка відрізняється тим, що кожен з R7, R8, R9 та R10 являють собою водень.
14. Сполука за п. 1, яка відрізняється тим, що є
N-[2-амідиноамінооксі)етил]-2-{3-[(2,2-дифтор-2-фенілетил)аміно]-6-хлор-2-фторфеніл}ацетамідом,
N-[(6-аміно-2-метил(3-піридил))метил]-2-{3-[(2,2-дифтор-2-фенілетил)-аміно]-6-хлор-2-фторфеніл}ацетамідом,
N-[(6-аміно-2,4-диметил(3-піридил))метил]-2-{3-[(2,2-дифтор-2-фенілетил)-аміно]-6-хлор-2-фторфеніл}ацетамідом,
N-[2-(амідиноамінооксі)етил]-2-(3-{[2,2-дифтор-2-(4-фторнафтил)етил]-аміно}-6-хлор-2-фторфеніл)ацетамідом,
N-[(6-аміно-2-метил(3-піридил))метил]-2-(3-{[2,2-дифтор-2-(4-фторнафтил)-етил]аміно}-6-хлор-2-фторфеніл)ацетамідом,
N-[2-(гуанідинооксі)етил]-2-(3-{[бензилсульфоніл]аміно}феніл)ацетамідом,
N-[2-(гуанідинооксі)етил]-2-(2-хлор-5-{[бензилсульфоніл]аміно}-феніл)ацетамідом,
N-[2-(гуанідинооксі)етил]-2-(2-метил-5-{[бензилсульфоніл]аміно}-феніл)ацетамідом,
N-[2-(гуанідинооксі)етил]-2-(2-гідрокси-6-метил-3-{[(3-метилфеніл)-сульфоніл]аміно}феніл)ацетамідом,
N-[(6-аміно-2-метил(3-піридил))метил]-2-(2-гідрокси-6-метил-3-{[(3-метилфеніл)сульфоніл]аміно}феніл)ацетамідом або
толуол-3-сульфонової кислоти 2-гідрокси-3-[(2-гуанідинооксіетилкарбамоїл)-метил]-4-метилфеніловим естером,
або їх сольватом, гідратом або фармацевтичнo прийнятною сіллю.
15. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-14 та фармацевтичнo прийнятний носій.
16. Фармацевтична композиція за п. 15, яка відрізняється тим, що додатково містить принаймні один компонент з-поміж антикоагулянтів, антитромбоцитарних агентів або тромболітичних агентів.
17. Фармацевтична композиція за п. 15, яка відрізняється тим, що вищезгадана сполука є присутньою у кількості від приблизно 0,1 до приблизно 500 мг.
18. Фармацевтична композиція за будь-яким з пп. 15-17, яка відрізняється тим, що вона пристосована для перорального застосування.
19. Спосіб інгібування або лікування аберантного протеолізу, тромбозу, ішемії, інсульту, рестенозу або запалення у ссавців, які цього потребують, який відрізняється тим, що вищезгаданому ссавцеві вводять ефективну кількість сполуки за будь-яким з пп. 1-14.
20. Спосіб лікування або профілактики станів, які характеризуються анормальним венозним або артеріальним тромбозом при виробленні або дії тромбіну у ссавців, які цього потребують, який відрізняється тим, що вищезгаданому ссавцеві вводять ефективну кількість композиції за п. 15.
21. Застосування сполуки за будь-яким з пп. 1-14 для введення або фізичного зв’язування з медичним засобом, призначеним для застосування при заборі крові, зберіганні крові або кровообігу, вибраним з групи, що включає катетер, стент, пристрій для діалізу крові, шприц або трубку для забирання крові або кров’яну лінію.
22. Спосіб інгібування дії протеолітичного ферменту, при якому зазначений фермент вводять у контакт зі сполукою за будь-яким з пп. 1-14.
23. Спосіб за п. 22, який відрізняється тим, що вищезгаданий фермент є еластазою лейкоцитів нейтрофілів, хімотрипсином, трипсином, урокіназою, активатором плазміногену, еластазою підшлункової залози, катепсином G, тромбіном або фактором Ха.
24. Застосування сполуки за будь-яким з пп. 1-14 для приготування лікарського засобу для лікування аберантного протеолізу, тромбозу, ішемії, інсульту, рестенозу або запалення у ссавців.
25. Застосування сполуки за будь-яким з пп. 1-14 для приготування лікарського засобу для лікування або профілактики станів, які характеризуються анормальним венозним або артеріальним тромбозом при виробленні або дії тромбіну у ссавців.
26. Застосування сполуки за будь-яким з пп. 1-14 для приготування лікарського засобу для інгібування дії протеолітичного ферменту.
27. Застосування за п. 26, яке відрізняється тим, що вказаний фермент є еластазою лейкоцитів нейтрофілів, хімотрипсином, трипсином, урокіназою, активатором плазміногену, еластазою підшлункової залози, катепсином G, тромбіном або фактором Ха.
28. Спосіб in vitro інгібування дії протеолітичного ферменту, при якому зазначений фермент вводять у контакт зі сполукою за будь-яким з пп. 1-14.
29. Спосіб за п. 28, який відрізняється тим, що зазначений фермент є еластазою лейкоцитів нейтрофілів, хімотрипсином, трипсином, урокіназою, активатором плазміногену, еластазою підшлункової залози, катепсином G, тромбіном або фактором Ха.
Текст
1. Сполука формули І: R5 C2 2 (19) 1 3 75093 4 одного до чотирьох гетероатомів, вибраних із груu приймає значення від 2 до 7, в оптимальному пи, яка складається з N, О та S, і гетероциклічне варіанті - від 2 до 5, а R9 та R10 є такими, як визнаабо негетероциклічне кільце є незаміщеним або чено вище; заміщеним галогеном або гідрокси, або R9 та R10 разом утворюють -(СН2)v-, де С1-12 алкілом, незаміщеним або заміщеним одним v приймає значення від 2 до 7, в оптимальному 7 8 або кількома гідрокси, СООН, аміно, необов'язково варіанті - від 2 до 5, а R та R є такими, як визнаС1-3 алкілзаміщеним арилом, С3-9 циклоалкілом, чено вище; СF3, N(CH3)2, гетероарилом або гетероциклоалкіабо R7 та R9 разом утворюють -(СН2)у-, де лом, у є 0 (зв'язок) або від 1 до 7, в оптимальному варіСF3, анті - 0-4, а R8 та R10 є такими, як визначено вище; С3-9 циклоалкілом, який незаміщений або заміщеХ є -О-, -NR18- або -CH=N- (де N є зв'язаним з ний арилом, NR13), де R18 є воднем, алкілом, циклоалкілом або С7-12 біциклічним алкілом або арилом, причому вищезгаданий алкіл, циклоалкіл С10-16 трициклічним алкілом; або арил є необов'язково заміщеним аміно, моноY є -NH- або -О-; алкіламіно, діалкіламіно, алкокси, гідрокси, карбоR3, R4, R5 та R6 незалежно є воднем, алкілом, циккси, алкоксикарбонілом, арилоксикарбонілом, аралоалкілом, алкенілом, алкінілом, необов'язково лкоксикарбонілом, арилом, гетероарилом, заміщеним арилом, необов'язково заміщеним ациламіно, ціано або трифторметилом; аралкілом, необов'язково заміщеним гетероариRa, Rb та Rc незалежно є воднем, алкілом, гідроклом, галоалкілом, гідрокси, алкокси, арилокси, си, алкокси, арилокси, аралкокси, алкоксикарбонігетероарилокси, галогеном, галоалкокси, гідроксілокси, ціано або -CO2Rw, де Rw є С1-12 алкілом, С3-9 х х х алкілом, ціано, нітро, -CO2R , -CH2OR або -OR , циклоалкілом, С6-14 арилом, С6-14ар(С1-12) алкілом, де Rх у кожному випадку незалежно є воднем, С1Rg O 12 алкілом або С3-9 циклоалкілом, причому вищеO згадана С1-12 алкільна або С3-9 циклоалкільна груO Ri O пи необов'язково можуть мати одну або кілька ненасиченостей; O Rh Re Rf R11 є воднем, алкілом або алкенілом; або , 12 R є де Re та Rf незалежно є воднем, С1-6 алкілом, С2-6 воднем або галогеном, алкенілом або С6-14 арилом, Rg є воднем, С1-6 алкіфенілом, нафтилом або біфенілом, кожен з яких є лом, С2-6 алкенілом або С6-14 арилом, Rh є воднем, незаміщеним або заміщеним одним або кількома С1-6 алкілом, С2-6 алкенілом або С6-14 арилом, і Ri є С1-4 алкілами, С1-4 алкокси, галогенами, гідрокси, С6-14ар(С1-12) алкілом або С1-12 алкілом; СF3, ОСF3, СООН або CONH2, n приймає значення від нуля до 8; і 5-7-членним моно- або 9-10-членним біциклічним m приймає значення від нуля до 6; гетероциклічним кільцем, яке може бути насичеR13 є воднем, алкілом, алкенілом, аралкілом, ариним або ненасиченим і яке містить від одного до лом, гідроксіалкілом, аміноалкілом, моноалкіламічотирьох гетероатомів, вибраних із групи, яка ноалкілом, діалкіламіноалкілом або карбоксіалкіскладається з N, О та S, лом; С1-12 алкілом, незаміщеним або заміщеним одним R14 та R15 незалежно є воднем, алкілом, циклоалабо кількома гідрокси, СООН, аміно, С6-14 арилом, кілом, галогеном або алкокси; і гетероарилом або гетероциклоалкілом, R16 та R17 незалежно є воднем, алкілом, гідрокси, СF3, алкокси, арилокси, алкоксикарбонілом, ціано або С3-9 циклоалкілом, CO2Rj, де Rj є С1-12 алкілом, С3-9 циклоалкілом, С6С7-12 біциклічним алкілом або 14 арилом, С6-14ар(С1-12) алкілом, гало(С1-12) алкіС10-16 трициклічним алкілом; лом або В є вибраним з групи, яка складається з: Rg O 8 R R13 Ra R9 R10 O R7 X N N O Rb m n NRc або R15 N m R9 R10 n N R16 R14 R17 Re Rf , де Re, Rf тa Rg незалежно є воднем або С1-12 алкілом, або її сольват, гідрат або фармацевтичнo прийнятна сіль. 2. Сполука формули (І): R5 , де R7, R8, R9 та R10 незалежно є воднем, алкілом, аралкілом, арилом, гідроксіалкілом, аміноалкілом, моноалкіламіноалкілом, діалкіламіноалкілом або карбоксіалкілом; або R7 та R8 разом утворюють -(СH2)u-, де R4 W R6 O Y N H R3 R11 (І) B , 5 75093 6 у якій або негетероциклічне кільце є незаміщеним або W є воднем, R1, R1OC(O), R1C(O), R1(CH2)sNHC(O), заміщеним галогеном або гідрокси, R1S(O)2 або (R1)2CH(CH2)sNHC(O), де s приймає С1-12 алкілом, незаміщеним або заміщеним одним значення 0-4; або кількома гідрокси, СООН, аміно, необов'язково R1 є С1-3 алкілзаміщеним арилом, С3-9 циклоалкілом, 2 R, СF3, N(CH3)2, гетероарилом або гетероциклоалкіR2(CH2)tC(R12)2, де t приймає значення 0-3, і кожен лом, з R12 може бути таким самим або іншим, СF3, (R2)(OR12)CH(CH2)p, де р приймає значення 1-4, С3-9 циклоалкілом, який незаміщений або заміще(R2)2(OR12)C(CH2)p, де р приймає значення 1-4, ний арилом, R2C(R12)2(CH2)t, де t приймає значення 0-3, і кожен С7-12 біциклічним алкілом або з R12 може бути таким самим або іншим, де (R12)2 С10-16 трициклічним алкілом; також може утворювати кільце з С, представленим Y є -NH- або -О-; С3-9 циклоалкілом, R3, R4, R5 та R6 незалежно є воднем, С1-12 алкілом, 2 12 12 R СF2С(R )2(CH2)q, де q є 0-2, і кожен з R може С3-9 циклоалкілом, галогеном, С2-20 алкенілом, C2-20 бути таким самим або іншим, де (R12)2 також може алкінілом, необов'язково заміщеним С6-14 арилом, утворювати кільце з С, представленим С3-9 циклонеобов'язково заміщеним С6-14ар(С1-12) алкілом, алкілом, необов'язково заміщеним гетероарилом, гало(С1R2CH2C(R12)2(CH2)q, де q є 0-2, і кожен з R12 може 12) алкілом, С1-12 алкокси, С6-14 арилокси, гетероабути таким самим або іншим, де (R12)2 також може рилокси, гало(С1-20)алкокси або гідроксі(С1-12) алкіутворювати кільце з С, представленим С3-9 циклолом; алкілом, R11 є воднем, С1-12 алкілом або С2-20 алкенілом, (R2)2CH(CH2)r, де r приймає значення 0-4, і кожен з R12 є 2 2 R може бути таким самим або іншим, і де (R )2 воднем або галогеном, фенілом, також може утворювати кільце з СН, представленафтилом або біфенілом, кожен з яких є незаміним С3-9 циклоалкілом, C7-12 біциклічним алкілом, щеним або заміщеним одним або кількома С1-4 С10-16 трициклічним алкілом або 5-7-членним моноалкілами, С1-4 алкокси, галогенами, гідрокси, CF3, або біциклічним гетероциклічним кільцем, яке моOCF3, COOH або CONH2, же бути насиченим або ненасиченим і яке містить 5-7-членним моно- або 9-10-членним біциклічним від одного до трьох гетероатомів, вибраних із гругетероциклічним кільцем, яке може бути насичепи, яка складається з N, О та S, ним або ненасиченим і яке містить від одного до R2O(CH2)p, де р є 2-4, чотирьох гетероатомів, вибраних із групи, яка 2 2 (R )2CF(CH2)r, де r є 0-4, і кожен з R може бути складається з N, О та S, таким самим або іншим, де (R2)2 також може утвоС1-12 алкілом, незаміщеним або заміщеним одним рювати кільце з С, представленим С3-9 циклоалкіабо кількома гідрокси, СООН, аміно, С6-14 арилом, лом, C7-12 біциклічним алкілом, С10-16 трициклічним гетероарилом або гетероциклоалкілом, алкілом або 5-7-членним моно- або біциклічним СF3, гетероциклічним кільцем, яке може бути насичеС3-9 циклоалкілом, ним або ненасиченим і яке містить від одного до С7-12 біциклічним алкілом або трьох гетероатомів, вибраних із групи, яка складаС10-16 трициклічним алкілом; ється з N, О та S, В є вибраним з групи, яка складається з: R8 R13 Ra R9 R10 7 (R2)2CH CH2 R X N N Rb m R12 R12 n NRc , R2(CH2)s , де s приймає значення 0 або 1, або R2CF2C(R12)2; R2 є фенілом, нафтилом або біфенілом, кожен з яких є незаміщеним або заміщеним одним або кількома С1-4 алкілами, С1-4 алкокси, галогенами, гідрокси, СF3, ОСF3, СООН, CONH2 або SO2NH2, 5-7-членним моно- або 9-10-членним біциклічним гетероциклічним кільцем або негетероциклічним кільцем, яке може бути насиченим або ненасиченим, причому гетероциклічне кільце містить від одного до чотирьох гетероатомів, вибраних із групи, яка складається з N, О та S, і гетероциклічне або R15 N m R9 R10 n N R16 R14 R17 , де R7, R8, R9 та R10 незалежно є воднем, С1-12 алкілом, С6-14ар(С1-12)алкілом, С6-14 арилом, гідроксі(С1-12) алкілом, аміно(С1-12) алкілом, моно(С112)алкіламіно(С1-12) алкілом, ді(С1-12)алкіламіно(С112) алкілом або карбоксі(С1-12) алкілом; X є –O-, NR18 або –CH=N- (де N є зв’язаним з NR13), де R18 є С1-12 алкілом, С3-9 циклоалкілом або С6-14 арилом, кожен з яких є необов'язково заміщеним аміно, моно(С1-12) алкіламіно, ді(С1-12) алкіламіно, С1-20 алкокси, гідрокси, карбокси, С1-20 алкоксикар 7 75093 8 бонілом, С6-14 арилоксикарбонілом, С6-14ар(С1-20) N-[(6-аміно-2-метил(3-піридил))метил]-2-{3-[(2,2алкоксикарбонілом, С6-14 арилом, С5-10 гетероаридифтор-2-фенілетил)-аміно]-6-хлор-2лом, ациламіно, ціано або трифторметилом; фторфеніл}ацетамідом, Ra, Rb та Rc незалежно є С1-12 алкілом, С1-20 алкокN-[(6-аміно-2,4-диметил(3-піридил))метил]-2-{3си, С6-14 арилокси, С6-14ар(С1-20) алкокси або С1-20 [(2,2-дифтор-2-фенілетил)-аміно]-6-хлор-2алкоксикарбонілокси; фторфеніл}ацетамідом, n приймає значення від нуля до 8; і N-[2-(амідиноамінооксі)етил]-2-(3-{[2,2-дифтор-2m приймає значення від нуля до 6; (4-фторнафтил)етил]-аміно}-6-хлор-2R13 є С1-12 алкілом, С1-20 алкокси, С6-14 арилокси фторфеніл)ацетамідом, або С1-20 алкоксикарбонілом; N-[(6-аміно-2-метил(3-піридил))метил]-2-(3-{[2,2R14 та R15 незалежно є С1-12 алкілом, С3-9 циклоалдифтор-2-(4-фторнафтил)-етил]аміно}-6-хлор-2кілом або С1-20 алкокси; і фторфеніл)ацетамідом, R16 та R17 незалежно є С1-12 алкілом, С1-20 алкокси, N-[2-(гуанідинооксі)етил]-2-(3С6-14 арилокси або С1-20 алкоксикарбонілом, {[бензилсульфоніл]аміно}феніл)ацетамідом, або її сольват, гідрат або фармацевтичнo прийняN-[2-(гуанідинооксі)етил]-2-(2-хлор-5тна сіль. {[бензилсульфоніл]аміно}-феніл)ацетамідом, 3. Сполука за п. 1, яка відрізняється тим, що В N-[2-(гуанідинооксі)етил]-2-(2-метил-5являє собою {[бензилсульфоніл]аміно}-феніл)ацетамідом, N-[2-(гуанідинооксі)етил]-2-(2-гідрокси-6-метил-3R8 R13 Ra R9 R10 {[(3-метилфеніл)R7 X N N сульфоніл]аміно}феніл)ацетамідом, Rb N-[(6-аміно-2-метил(3-піридил))метил]-2-(2m n гідрокси-6-метил-3-{[(3c NR метилфеніл)сульфоніл]аміно}феніл)ацетамідом . або 4. Сполука за п. 1, яка відрізняється тим, що В толуол-3-сульфонової кислоти 2-гідрокси-3-[(2являє собою гуанідинооксіетилкарбамоїл)-метил]-4R15 метилфеніловим естером, N або їх сольватом, гідратом або фармацевтичнo прийнятною сіллю. 16 R n m 15. Фармацевтична композиція, що містить сполуN ку за будь-яким з пп. 1-14 та фармацевтичнo приR14 R9 R10 йнятний носій. R17 . 16. Фармацевтична композиція за п. 15, яка відрі5. Сполука за будь-яким з пп. 1-4, яка відрізнязняється тим, що додатково містить принаймні ється тим, що Y являє собою -NH-. один компонент з-поміж антикоагулянтів, антитро6. Сполука за будь-яким з пп. 1-5, яка відрізнямбоцитарних агентів або тромболітичних агентів. 1 1 ється тим, що W являє собою R або R S(O)2, де 17. Фармацевтична композиція за п. 15, яка відрі1 2 2 R є R , і R необов'язково є заміщеним арилом зняється тим, що вищезгадана сполука є присутабо С1-7 алкілом, заміщеним арилом. ньою у кількості від приблизно 0,1 до приблизно 7. Сполука за будь-яким з пп. 1-5, яка відрізня500 мг. 1 1 2 ється тим, що W є R , де R є R або 18. Фармацевтична композиція за будь-яким з пп. 2 12 2 R CF2C(R )2(CH2)q, і R є необов'язково заміще15-17, яка відрізняється тим, що вона пристосоним арилом або С1-7 алкілом, заміщеним арилом, вана для перорального застосування. 12 R є воднем, і q приймає значення нуль. 19. Спосіб інгібування або лікування аберантного 8. Сполука за будь-яким з пп. 1 та 3-7, яка відрізпротеолізу, тромбозу, ішемії, інсульту, рестенозу 6 няється тим, що R являє собою С1-6 алкіл або або запалення у ссавців, які цього потребують, галоген. який відрізняється тим, що вищезгаданому ссав9. Сполука за п. 8, яка відрізняється тим, що R6 цеві вводять ефективну кількість сполуки за будьявляє собою метил, хлор або фтор. яким з пп. 1-14. 6 10. Сполука за п. 9, яка відрізняється тим, що R 20. Спосіб лікування або профілактики станів, які 3 являє собою хлор, а R являє собою фтор або характеризуються анормальним венозним або гідроксигрупу. артеріальним тромбозом при виробленні або дії 11. Сполука за будь-яким з пп. 1, 3-10, яка відрізтромбіну у ссавців, які цього потребують, який ві11 няється тим, що R являє собою водень. дрізняється тим, що вищезгаданому ссавцеві 12. Сполука за будь-яким з пп. 1, 3 та 5-11, яка вводять ефективну кількість композиції за п. 15. a b c 13 відрізняється тим, що кожен з R , R , R та R 21. Застосування сполуки за будь-яким з пп. 1-14 являють собою водень. для введення або фізичного зв’язування з медич13. Сполука за будь-яким з пп. 1 та 3-12, яка відріним засобом, призначеним для застосування при 7 8 9 10 зняється тим, що кожен з R , R , R та R являзаборі крові, зберіганні крові або кровообігу, вибють собою водень. раним з групи, що включає катетер, стент, при14. Сполука за п. 1, яка відрізняється тим, що є стрій для діалізу крові, шприц або трубку для заN-[2-амідиноамінооксі)етил]-2-{3-[(2,2-дифтор-2бирання крові або кров’яну лінію. фенілетил)аміно]-6-хлор-2-фторфеніл} ацетамі22. Спосіб інгібування дії протеолітичного фермендом, ту, при якому зазначений фермент вводять у контакт зі сполукою за будь-яким з пп. 1-14. 9 75093 10 23. Спосіб за п. 22, який відрізняється тим, що 27. Застосування за п. 26, яке відрізняється тим, вищезгаданий фермент є еластазою лейкоцитів що вказаний фермент є еластазою лейкоцитів нейтрофілів, хімотрипсином, трипсином, урокінанейтрофілів, хімотрипсином, трипсином, урокіназою, активатором плазміногену, еластазою підшзою, активатором плазміногену, еластазою підшлункової залози, катепсином G, тромбіном або лункової залози, катепсином G, тромбіном або фактором Ха. фактором Ха. 24. Застосування сполуки за будь-яким з пп. 1-14 28. Спосіб in vitro інгібування дії протеолітичного для приготування лікарського засобу для лікуванферменту, при якому зазначений фермент ввоня аберантного протеолізу, тромбозу, ішемії, інсудять у контакт зі сполукою за будь-яким з пп. 1-14. 29. Спосіб за п. 28, який відрізняється тим, що льту, рестенозу або запалення у ссавців. 25. Застосування сполуки за будь-яким з пп. 1-14 зазначений фермент є еластазою лейкоцитів нейдля приготування лікарського засобу для лікувантрофілів, хімотрипсином, трипсином, урокіназою, ня або профілактики станів, які характеризуються активатором плазміногену, еластазою підшлункоанормальним венозним або артеріальним тромбової залози, катепсином G, тромбіном або фактозом при виробленні або дії тромбіну у ссавців. ром Ха. 26. Застосування сполуки за будь-яким з пп. 1-14 для приготування лікарського засобу для інгібування дії протеолітичного ферменту. Даний винахід стосується нових сполук, які функціонують як інгібітори протеолітичних ферментів, зокрема, нового класу інгібіторів тромбіну. Протеази є ферментами, які розщеплюють білки в окремих місцях специфічних пептидних зв'язків. Протеази розділяють на чотири загальні класи: серин-, тіол- або цистеїніл-, кислі або аспартил- і металопротеази [Cuypers et al., J. Biol. Chem. 257:7086 (1982)]. Протеази є суттєвими для різних видів біологічної активності, таких як травлення, утворення або розчинення кров'яних згустків, відтворення та імунна реакція на сторонні клітини та організми. Аберантний протеоліз пов'язаний з багатьма хворобливими станами людини та інших ссавців. Вважається, що людські нейтрофільні протеази, еластаза та катепсин G відіграють свою роль у хворобливих станах, які відзначаються руйнуванням тканин. До цих хворобливих станів належать емфізема, ревматоїдний артрит, виразки рогівки та гломерулонефрит. [Barret, in Фермемт Inhibitors as Drugs, Sandier, ed., University Park Press, Battimore, (1980)]. [нші протеази, такі як плазмін, С-1 естераза, С-3 конвертаза, урокіназа, активатор плазміногену, акрозин та калікреїни, відіграють ключову роль у нормальних біологічних функціях ссавців. У багатьох випадках потрібний ефект забезпечує порушення функції одного або кількох протеолітичних ферментів у процесі терапевтичного лікування ссавця. До серинпротеаз належать такі ферменти, як еластаза (лейкоцити людини), катепсин G, плазмін, С-1 естераза, С-3 конвертаза, урокіназа, активатор плазміногену, акрозин, хімотрипсин, трипсин, тромбін, фактор Ха та калікреїни. Еластаза лейкоцитів людини вивільнюється поліморфноядерними лейкоцитами у місцях запалення і, таким чином, є однією з причин багатьох хворобливих станів. Катепсин G є іншою людською нейтрофільною серинпротеазою. Передбачається, що сполуки зі здатністю до інгібування активності цих ферментів мають протизапальний вплив, який використовують у лікуванні від подагри, ревматоїдного артриту та інших запальних хвороб, а також у лікуванні від емфіземи. Хімотрипсин та трипсин з травними ферментами. Iнгібітори цих ферментів використовують для лікування від панкреатиту. Інгібітори урокінази та активатор плазміногену використовують у лікуванні від хворобливих станів, пов'язаних із надмірним ростом клітин, таких як доброякісна гіпертрофія передміхурової залози, карцинома передміхурової залози та псоріаз. Тромбін серинпротеази відіграє ключову роль у гемостазі та тромбозі і, як багатофакторний білок, по-різному впливає на тромбоцити, ендотеліальні клітини, клітини гладенького м'яза, лейкоцити, серце та нейрони. Активація каскаду коагуляції або через внутрішній шлях (контактна активація), або через зовнішній шлях (активація шляхом дії на плазму неендотеліальної поверхні, пошкодження стінок судин або вивільнення тканинного фактора) веде до різних біохімічних явищ, які всі є пов'язаними з тромбіном. Тромбін розщеплює фібриноген, що зрештою призводить до гемостатичної пробки (утворення пробки), ефективно активує тромбоцити через унікальне протеолітичне розщеплення рецептора тромбіну поверхні клітини [Coughiin, Semіnars іn Hematology 37 (4):270-277 (1994)] й аутоампліфікує власне продукування через механізм зворотного зв'язку. Таким чином, функція інгібіторів тромбіну має терапевтичний потенціал в організмі, який страждає від серцевосудинних та інших захворювань. Фактор Ха є іншою серинпротеазою шляху коагуляції. Фактор Ха зв'язується з фактором Va та кальцієм на фосфоліпідній мембрані, утворюючи, таким чином, протромбіназний комплекс. Цей протромбіназний комплекс потім перетворює протромбін та тромбін [Claeson, Blood Соаgulation and Fibrinolysis 5:411-436 (1994); Harker, Blood Coagulation and Fibrinolysis 5 (Suppl 1):S47-S58 (1994)]. Вважається, що інгібітори фактора Ха забезпечують перевагу над агентами, які безпосередньо інгібують тромбін, оскільки безпосередні інгібітори тромбіну все ж допускають утворення нового тромбіну у значній кількості [Lefkovits and Topol, Circulаtiоn 90(3); 1522-1536 (1994); Barker, 11 75093 12 Blood Соаgulation and Fibrinolysis 5 (Suppl 1):S47сполуку згідно з винаходом у фармацевтично приS58 (1994)]. йнятному носії. Ці композиції необов'язково моРаніше повідомлялося про способи діагностижуть включати антикоагулянти, антитромбоцитарні чної візуалізації in νiνο для внутрішньосудинних агенти та тромболітичні агенти. Ці композиції мотромбів. У цих способах візуалізації застосовували жуть вводитися у кров, продукти крові або органи сполуки, мічені радіоактивними або парамагнітниссавців з метою досягнення потрібного інгібуванми атомами. Наприклад, тромбоцити, мічені гамня. ма-випромінювачем, ln-111, можуть бути застосоТакож пропонуються способи інгібування або вані як засоби візуалізації для виявлення тромбів лікування аберантного протеолізу у ссавців та [Thakur, Μ. L. et al., Тhromb Res. 9:345 (1976); способи лікування від інфаркту міокарда; нестійкої Powers et al., Nеurology 32:938 (1982)]. Як агент стенокардії; інсульту; рестенозу; тромбозу глибовізуалізації, було запропоновано тромболітичний кої вени; синдрому дисемінованої внутрішньосуфермент стрептокіназу, мічену Tc-99m, [Wong, динної коагуляції, викликаної травмою, сепсисом Патент США №4,418,052(1983)]. Як агенти візуаліабо метастазом пухлин; гемодіалізу; при операціях зації, було запропоновано фібринозв'язувальні за умов штучного кровообігу; синдрому розладу домени одержаного від Sfaphylococcus aureus білдихання у дорослих; ендотоксичного шоку; ревмака А, мічені гамма-випромінювачами, l-125 та l-131 тоїдного артриту; виразкового коліту; індурації; [Pang, Патент США №5,011,686 (1991)]. Як агенти метастазів; гіперкоагуляції під час хіміотерапії; візуалізації, було запропоновано моноклональні хвороби Альцгеймера; синдрому Дауна; утворення антитіла, які мають специфічність до фібрину (на фібрину в оці та для загоєння ран. Сполуки винавідміну від фібриногену) і мічені Тс-99m [Berger et ходу також можуть застосовуватись як антикоагуal., Патент США №5,024,829 (1991); Dean et al., лянти, введені або фізично зв'язані з матеріалами, Пат. США №4,980,148 (1990)]. Повідомлялося про які використовують у виробництві засобів, які зазастосування парамагнітного контрастного агента, стосовують для забирання крові, кровообігу та діетилентриамінпентаоцтової кислоти з іоном газберігання крові, таких як катетери, пристрої для долінію, у магнітній резонансній томографії пацієндіалізу крові, шприці та трубки для забирання кротів, яких піддавали лікуванню від гострого інфаркві, лінії та стенти. ту міокарда шляхом тромболізу [De Roos, А. et al., Винахід також охоплює спосіб зниження тромІnt. J. Card. lmaging 7:133 (1991)]. Як агенти візуабогенності поверхні у ссавців шляхом приєднання лізації тромбів, також пропонувалися радіоактивно до поверхні, ковалентно або нековалентно, сполумічені та парамагнітно мічені похідні альфаки винаходу. кетоамідів [Abeiman et al., Патент США В іншому аспекті даний винахід охоплює кори№5,656,600]. сні для in νiνο візуалізації тромбів у ссавців компоПродовжує існувати потреба у непептидних зиції, які включають сполуку даного винаходу, яка сполуках, які є ефективними і селективними інгібіпіддається виявленню поза межами організму. тооами протеази і які мають більшу біоакумуляцію Оптимальними є композиції, які включають сполуі менше побічних ефектів порівняно з нині існуюку даного винаходу та мітку, яка піддається виявчими інгібіторами протеази. Відповідним чином, ленню, таку як радіоактивний або парамагнітний нові класи ефективних інгібіторів протеази, які хаатом. рактеризуються великою інгібіторною здатністю та В іншому аспекті даний винахід забезпечує дінизькою токсичністю для ссавців, є потенційно агностичні композиції, корисні для in νiνο візуаліцінними терапевтичними засобами лікування від зації тромбів у ссавців, які включають фармацеврізних станів, включаючи лікування від багатьох тично прийнятний носій та діагностично ефективну протеолітичних хворобливих станів у ссавців. кількість сполуки або композиції даного винаходу. Даний винахід стосується нових амінопіридиВ іншому аспекті даний винахід охоплює споніл-, аміногуанідинілта алкоксигуанідинілсоби, корисні для in νiνο візуалізації тромбів у ссазаміщених фенілацетамідів, які мають Формулу l вців. (нижче). Пропонуються також способи одержання До сполук даного винаходу належать сполуки сполук Формули l. Нові сполуки даного винаходу є Формули І: ефективними інгібіторами протеаз, зокрема трипсиноподібних серинпротеаз, таких як хімотрипсин, трипсин, тромбін, плазмін та фактор Ха. Деякі зі сполук виявляють антитромботичну активність через пряме селективне інгібування тромбіну або є проміжними сполуками, які використовують для утворення сполук, які мають антитромботичну активність. Пропонуються також способи інгібування або лікування від аберантного протеолізу у ссавців та способи лікування від тромбозу, ішемії, інсульабо їх сольвати, гідрати або фармацевтично ту, рестенозу або запалення у ссавців шляхом прийнятні солі; у яких: введення ефективної кількості сполуки Формули l. W є воднем, R 1, R1OC(O), R1C(O), 1 1 Винахід охоплює композицію для стримування R (CH2)sNHC(O), R S(O)2 або втрати тромбоцитів крові, інгібування утворення (R1)2CH(CH2)sNHC(O), де s є 0-4; агрегатів тромбоцитів крові, інгібування утворення R1 є фібрину, інгібування утворення тромбів та інгібуR2, вання утворення емболів у ссавців, яка включає R2(CH2)tC(R12)2, де t є 0-3, і кожен з R12 може 13 75093 14 бути таким самим або іншим, ним арилом, (R2)(OR12)CH(CH2)p, де p є 1-4, С7-12 біциклічним алкілом або (R2)2(OR12)C(CH2)p, де p є 1-4, С10-16 трициклічним алкілом; R2C(R12)2(CH2)t, де t є 0-3, і кожен з R12 може Υ є -NH- або -О-; бути таким самим або іншим, де (R12)2 також може R3, R4, R5 та R6 незалежно є воднем, алкілом, утворювати кільце з С, представленим С3-9 циклоциклоалкілом, алкенілом, алкінілом, необов'язково алкілом, заміщеним арилом, необов'язково заміщеним R2CF2C(R12)2(CH2)q, де q є 0-2, і кожен з R12 аралкілом, необов'язково заміщеним гетероариможе бути таким самим або іншим, де (R12)2 також лом, галоалкілом, гідрокси, алкокси, арилокси, може утворювати кільце з С, представленим С3-9 гетероарилокси, галогеном, галоалкокси, гідроксіциклоалкілом, алкілом, ціано, нітро, -CO2Rx, -CH2ORx або -ORx, 2 12 12 R CH2C(R )2(CH2)q, де q є 0-2, і кожен з R де Rx у кожному разі незалежно є воднем, С1-12 може бути таким самим або іншим, де (R12)2 також алкілом або С3-9 циклоалкілом, причому вищезгаможе утворювати кільце з С, представленим С3-9 дана С1-12 алкільна або С3-9 циклоалкільна групи циклоалкілом, необов'язково можуть мати одну або кілька нена(R2)2CH(CH2)r, де r є 0-4, і кожен з R2 може бусиченостей; ти таким самим або іншим, і де (R2)2 також може R11 є воднем, алкілом або алкенілом; утворювати кільце з СН, представленим С3-9 цикR12 є лоалкілом, С7-12 біциклічним алкілом, С10-16 трициводнем або галогеном, клічним алкілом або 5-7-членним моно- або біцикфенілом, нафтилом або біфенілом, кожен з лічним гетероциклічним кільцем, яке може бути яких є незаміщеним або заміщеним одним або насиченим або ненасиченим і яке містить від одкількома С1-4 алкілами, С1-4 алкокси, галогенами, ного до трьох гетероатомів, вибраних із групи, яка гідрокси, CF3, OCF3, СООН або CONH2, складається з Ν, Ο та S, 5-7-членним моно- або 9-10-членним біциклічR2O(CH2)p, де p є 2-4, ним гетероциклічним кільцем, яке може бути наси(R2)2CF(CH2)r, де r є 0-4, і кожен з R2 може бути ченим або ненасиченим і яке містить від одного до таким самим або іншим, де (R2)2 також може утвочотирьох гетероатомів, вибраних із групи, яка рювати кільце з С, представленим С3-9 циклоалкіскладається з Ν, Ο та S, лом, С7-12 біциклічним алкілом, С10-16 трициклічним С1-12 алкілом, незаміщеним або заміщеним одалкілом або 5-7-членним моно- або біциклічним ним або кількома гідрокси, СООН, аміно, С6-14 аригетероциклічним кільцем, яке може бути насичелом, гетероарилом або гетероциклоалкілом, ним або ненасиченим і яке містить від одного до CF3, трьох гетероатомів, вибраних із групи, яка складаС3-9 циклоалкілом, ється з Ν, Ο та S, C7-12 біциклічним алкілом або С10-165 трициклічним алкілом; В є вибраним з групи, яка складається з: де s є 0 або 1, або R2CF2C(R12)2; R2 є фенілом, нафтилом або біфенілом, кожен з яких є незаміщеним або заміщеним одним або кількома С1-4 алкілами, С1-4 алкокси, галогенами, гідрокси, CF3, OCF3, ССОН, CONH2 або SO2NH2, 5-7-членним моно- або 9-10-членним біциклічним гетероциклічним кільцем або негетероциклічним кільцем, яке може бути насиченим або ненасиченим, причому гетероциклічне кільце містить від одного до чотирьох гетероатомів, вибраних із групи, яка складається з Ν, Ο та S, і гетероциклічне або негетероциклічне кільце є незаміщеним або заміщеним галогеном або гідрокси, С1-12 алкілом, незаміщеним або заміщеним одним або кількома гідрокси, СООН, аміно, необов'язково С1-3 алкіл-заміщеним арилом, С3-9 циклоалкілом, CF3, N(СН3)2, гетероарилом або гетероциклоалкілом, CF3, С3-9 циклоалкілом, незаміщеним або заміще де R7, R8, R9 та R10 незалежно є воднем, алкілом, аралкілом, арилом, гідроксіалкілом, аміноалкілом, моноалкіламіноалкілом, діалкіламіноалкілом або карбоксіалкілом; або R7 та R8 разом утворюють -(СН2)u-, де u становить від 2 до 7, в оптимальному варіанті - від 2 до 5, a R9 та R10 є такими, як визначено вище; або R9 та R10 разом утворюють -(CH2)v-, де ν становить від 2 до 7, в оптимальному варіанті - від 2 до 5, a R7 та R8 є такими, як визначено вище; або R7 та R8 разом утворюють -(СН2)у-, де у є 0 (зв'язок) або від 1 до 7, в оптимальному варіанті - 0-4, a R8 та R10 є такими, як визначено вище; X є -О-, -NR18- або -CH=N- (де N є зв'язаним з 13 NR ), де R18 e воднем, алкілом, циклоалкілом або арилом, причому вищезгаданий алкіл, циклоалкіл або арил є необов'язково заміщеним аміно, моноалкіламіно, діалкіламіно, алкокси, гідрокси, карбокси, алкоксикарбонілом, арилоксикарбонілом, ара 15 75093 16 лкоксикарбонілом, арилом, гетероарилом, ацилаС1-20 алкоксикарбонілокси; міно, ціано або трифторометилом; R13 є С1-12 алкілом, С1-20 алкокси, С6-14 арилокa b c R , R та R незалежно є воднем, алкілом, гідси або С1-20 алкоксикарбонілом; рокси, алкокси, арилокси, аралкокси, алкоксикарR14 та R15 незалежно є С1-12 алкілом, С3-9 цикw w бонілокси, ціано або -CO2R , де R є С1-12 алкілом, лоалкілом або С1-20 алкокси; і 16 17 С3-9 циклоалкілом, С6-14 арилом, С6-14ар(С1-12) алкіR та R незалежно є С1-12 алкілом, С1-20 аллом, кокси, С6-14 арилокси або С1-20 алкоксикарбонілом. Оптимальними сполуками вищевказаної Формули l є ті, в яких Υ є -ΝΗ-або -SO2NH-. Оптимальним підродом сполук вищевказаної Формули l є ті, в яких В є де Re та Rf незалежно є воднем, С1-6 алкілом, С2-6 алкенілом або С6-14 арилом, R9 є воднем, С1-6 алкілом, С2-6 алкенілом або С6-14 арилом, Rh є воднем, С1-6 алкілом, C2-6 алкенілом або С6-14 арилом, і R1 є С6-14ар(С1-12)алкілом або С1-12 алкілом; n становить від нуля до 8; і m становить від нуля до 6; R13 є воднем, алкілом, алкенілом, аралкілом, арилом, гідроксіалкілом, аміноалкілом, моноалкіламіноалкілом, діалкіламіноалкілом або карбоксіалкілом; R14 та R15 незалежно є воднем, алкілом, циклоалкілом, галогеном або алкокси; і R16 та R17 незалежно є воднем, алкілом, гідрокси, алкокси, арилокси, алкоксикарбонілом, ціано або -CO2Rj, де Rj є С1-12 алкілом, С3-9 циклоалкілом, С6-14 арилом, С6-14ар(С1-12)алкілом. гало(С112)алкілом або де Re, Rf тa Rg незалежно є воднем або С1-12 алкілом. Сполуками, які охоплюються обсягом даного винаходу, є ті, в яких: R3, R4, R5 та R6 незалежно є воднем, С1-12 алкілом, С3-9 циклоалкілом, галогеном, С2-20 алкенілом, С2-20 алкінілом, необов'язково заміщеним С614 арилом, необов'язково заміщеним С6-14ар(С112)алкілом, необов'язково заміщеним гетероарилом, гало(С1-12)алкілом, С1-12 алкокси, С6-14 арилокси, гетероарилокси, гало(С1-20)алкокси або гідроксі(С1-12)алкілом; R11 є воднем, С1-12 алкілом або С2-20алкенілом, R4, R8, R9 та R12 незалежно є воднем, С1-12 алкілом, С6-14ар(С1-12)алкілом, С6-14 арилом, гідроксі(С1-12)алкілом, аміно(С1-12)алкілом, моно(С1ді(С1-12)алкіламіно(С112)алкіламіно(С1-12)алкілом, 12)алкілом або карбоксі(С1-12)алкілом; R18 є С1-12 алкілом, С3-9 циклоалкілом або С6-14 арилом, кожен з яких є необов'язково заміщеним аміно, моно(С1-12)алкіламіно, ді(С1-12)алкіламіно, С1-20 алкокси, гідрокси, карбокси, С1-20 алкоксикарбонілом, С6-14 арилоксикарбонілом, С6-14ар(С120)алкоксикарбонілом, С6-14 арилом, С5-10 гетероарилом, ациламіно, ціано або трифторометилом; Ra, Rb та Rc незалежно є С1-12 алкілом, С1-20 алкокси, С6-14 арилокси, С6-14ар(С1-20)алкокси або де R7-R10, R13 та Ra-Rc є такими, як визначено вище. Іншими оптимальним підродом сполук вищевказаної Формули l є ті, в яких В є де R9, R12 та R14-R17 є такими, як визначено вище. Оптимальними сполуками вищевказаної Формули І є ті, в яких W є R1, де R1 є R2, і R2 є необов'язково заміщеним фенілом, необов'язково заміщеним нафтилом або С1-7 алкілом, заміщеним арилом. Оптимальними сполуками вищевказаної Формули І є ті, в яких R1 є R2CF2C(R12)2(CH2)q. Оптимальними сполуками вищевказаної Формули І є ті, в яких R6 є С1-6 алкілом або галогеном. Більшу перевагу серед сполук у межах оптимального підроду віддають тим, у яких R6 є метилом або хлоро, включаючи сполуки, в яких R6 є хлоро, a R3 є фторо. Оптимальними сполуками вищевказаної Формули І є ті, в яких R11 є воднем. Оптимальними значеннями Ra, Rb та Rc у Формулі l незалежно є водень, гідрокси, С1-6 алкіл, С1w w 6 алкокси, ціано або -CO2R , де R , у кожному разі, в оптимальному варіанті є одним з С1-4алкілу, С47циклоалкілу або бензилоксикарбонілу. Придатними значеннями Ra, Rb та Rc є водень, метил, етил, пропіл, n-бутил, гідрокси, метокси, етокси, ціано, СО2СН3, -CO2CH2CH3 та -СО2СН2СН2СН3. У найбільш оптимальних варіантах втілення кожен з Ra, Rb та Rc є воднем. Також оптимальною для Ra, Rb та Rc є група CO2Rw, де Rw є одним з 17 75093 18 через ферментативний або хімічний процес. Кориде Re-Ri є такими, як визначено вище. Якщо сними проліками є ті, в яких Ra, Rb, Rc та/або Rd є a b c w w R , R та R є -CO2R , коли R є одним з цих комCO2Rw, де Rw є визначеним вище. [Див. Патент понентів, одержані в результаті сполуки є пролікаСША №5,466,811 та Sautnier et al., Bioorg. Med. ми, які мають потрібний склад та характеристики Сhem. Lett. 4:1985-1990 (1994)]. біоакумуляції. Оптимальним значенням для кожноЯкщо якась змінна трапляється більше одного го з Re i Rf та Rh є водень, R9 є метил, і оптимальразу у будь-якому компоненті або у Формулі l, її ними значеннями для Ri є бензил та трет-бутил. визначення щоразу є незалежним від її визначенОптимальними сполуками є сполуки Формули ня у будь-якому іншому разі. Крім того, комбінації l, де R7, R8, R9 та R10 незалежно є воднем, С1-6 замісників та/або змінних допускаються лише в алкілом, С6-10 ар(С1-6)алкілом, С6-10 арилом, С2-10 тому разі, якщо такі комбінації в результаті забезгідроксіалкілом або С2-7 карбоксіалкілом. Придатпечують стійкі сполуки. ними значеннями для R7, R8, R9 та R10 є водень, В іншому аспекті даний винахід охоплює кориметил, етил, пропіл, n-бутил, бензил, фенілетил, сні для in νiνο візуалізації тромбів у ссавців компо2-гідроксіетил, 3-гідроксипропіл, 4-гідроксибутил, зиції, які включають сполуку даного винаходу, яка 2-карбоксиметил, 3-карбоксіетил та 4піддається виявленню поза межами організму. карбоксипропіл. Додатковими оптимальними споОптимальними є композиції, які включають сполулуками є ті, в яких R7 та R8 або R9 та R10 разом ку даного винаходу та мітку, яка піддається виявутворюють -(СН2)у-, де у є 2. ленню, таку як радіоактивний або парамагнітний Оптимальними сполуками, якщо X є NR18, є ті атом. в яких R18 є воднем або С1-6 алкілом, необов'язкоВ іншому аспекті даний винахід забезпечує діво заміщеним одним, двома або трьома, в оптиагностичні композиції, які застосовують для in νiνο мальному варіанті - одним з аміно, моноалкіламівізуалізації тромбів у ссавців і які включають фарно, діалкіламіно, алкокси, гідрокси, мацевтично прийнятний носій та діагностично алкоксикарбонілу, арилоксикарбонілу, аралкоксиефективну кількість сполуки або композиції даного карбонілу, карбоалкокси, фенілу, ціано, трифтовинаходу. рометилу, ацетиламіно, піридилу, тіофенілу, фуВ іншому аспекті даний винахід охоплює спорилу, піролілу або імідазолілу. соби, які застосовують для in νiνο візуалізації троПридатними значеннями для R18 є водень, мембів у ссавців. тил, етил, пропіл, n-бутил, бензил, фенетил, 2Згідно з оптимальним аспектом, корисними гідроксіетил, 3-гідроксипропіл, 4-гідроксибутил, сполуками є ті, в яких R1 замісник є заміщеним карбоксиметил та карбоксіетил. міткою, що піддається виявленню, такою, як радіоНайбільш оптимальними сполуками є ті, в яких активний атом йоду, такий як І-125, І-131 або І-123. X є киснем. У цьому аспекті R1 в оптимальному варіанті є феR6 може представляти водень, С1-3 алкіл, галонілом, що має пара І-123, пара І-125 або пара Іген або С1-2 алкокси. R6 в оптимальному варіанті є 131 заміщення, або бензилом, що має мета І-123, С1-3 алкілом, наприклад, метилом, або галогеном, мета І-125 або мета І-131 заміщення. наприклад, хлором, бромом або фтором. Мітка, що піддається виявленню, також може R3, R4, R5 та R6 незалежно можуть представбути радіоактивним або парамагнітним хелатом, у ляти, гідрокси, С1-3 алкіл, галоген або С1-2 алкокси. якому відповідний ліганд (L) є приєднаним до R1 3 В оптимальному варіанті R є фтором та гідрокси. замісника, безпосередньо або через двовалентну Оптимальні значення n у Формулі l включають зв'язувальну групу А". В альтернативному варіанті від нуля до 6, краще - від нуля до 4, найкраще група -Α"-L заміщує групу W у Формулі І. Під відпонуль, 1 або 2. Оптимальні значення m включають відним ліганд слід розуміти органічний компонент, від нуля до 4, краще - нуль, 1, 2 або 3. здатний на хелатування радіоактивного або параТакож слід розуміти, що даний винахід охопмагнітного іона металу. лює стереоізомери, а також оптичні ізомери, наУ цих сполуках двовалентна зв'язувальна груприклад, суміші енантіомерів, а також окремі енанпа А" включає групи, здатні на ковалентний зв'язок тіомери та діастереомери, які виникають внаслідок з вільною аміногрупою та хелатоутворювальним структурної асиметрії у вибраних сполуках даної засобом. Наприклад, A" may be —C(=S)—, — серії. Сполуки даного винаходу також можуть мати C(=O)—, —C(=NH)—(CH2)6-C(=NH)-, —C(=O)— поліморфні кристалічні форми, і всі поліморфні (СН2)6-С(=О)—, кристалічні форми охоплюються обсягом даного винаходу. Сполуки Формули l також можуть бути сольватовані, зокрема, гідратовані. Гідратування може відбуватися під час одержання сполук або композицій, які включають сполуки, або ж гідратування може відбуватися з часом, через гігроскопічних характер сполук. і т. ін. Деякі сполуки, які охоплюються Формулою l, є Також, у сполуках, представлених Формулою І, похідними, які називають проліками. Вираз "проліхелатоутворювальний ліганд, L включає групи, ки" означає похідну відомого медикаменту прямої здатні на ковалентний зв'язок або нековалентне дії, яка має поліпшені характеристики доставлення зв'язування з радіоактивним або парамагнітним та терапевтичну цінність порівняно з медикаменатомом. До хелатоутворювальних засобів налетом, і яку перетворюють на активний медикамент жать ті, які зазвичай застосовують для утворення 19 75093 20 комплексів із радіоактивних або парамагнітних є прямо приєднаним до азотного, кисневого або атомів. Ними є хелатоутворювальні засоби, які сірчаного компонента. містять від 3 до 12, в оптимальному варіанті - від 3 Вжитий авторами термін "алкокси" означає лідо 8 груп метиленфосфорної кислоти, груп метинійний або розгалужений радикал, що має від 1 до ленкарбогідроксамової кислоти, карбоксіетиліде20 атомів вуглецю, якщо довжина ланцюга не обнових груп або, особливо, карбоксиметиленових межується ними, зв'язаний з атомом кисню, вклюгруп, які є зв'язаними з атомом азоту. Якщо лише чаючи, крім інших, метокси, етокси, n-пропокси, одна або дві кислотні групи є зв'язаними з атомом ізопропокси і т. ін. В оптимальному варіанті алкоказоту, то цей азот є зв'язаним з іншим атомом азоси ланцюг має довжину від 1 до 10 атомів вуглету, що має такі групи, необов'язково заміщеною цю, краще - від 1 до 8 атомів вуглецю. етиленовою групою або відокремленими етиленоТермін "арил", застосований самостійно або як вими одиницями у кількості до чотирьох, які є відочастина іншої групи, стосується моноциклічної або кремленими атомом азоту, кисню або сірки. Оптибіциклічної ароматичної групи, яка містить від 6 до мальним доповнюючим засобом є діетилентримін14 атомів вуглецю у кільцевій частині, в оптимальN,N,N',N",N"-пентаоцтова кислота (DTPA). DTPA є ному варіанті - 6-10 атомів вуглецю у кільцевій добре відомою спеціалістам як хелатоутворювачастині, такої як феніл, нафтил або тетрагідрональний засіб для радіоактивних атомів індію-III (lnфтил. lll), технецію-99m (Тс-99m) та парамагнітного атоВжитий авторами термін "гетероарил" стосума гадолінію (Gd). [Khaw, et al., Science 209.295 ється групи, що має від 5 до 14 атомів кільця; 6, 10 (1980); Paik С. Η. et al., Пат. США №4,652,440 або 14 електронів, які є спільними у циклічній (1987); Cries, H. et al., Пат. США №4,957,939 послідовності; і містить атоми вуглецю та 1, 2 або (1990)]. Оптимальним хелатоутворювальним ліга3 гетероатоми кисню, азоту або сірки (прикладами ндом, L, є 1-(р-амінобензил)гетероарильних груп є: тієнільна, бендіетилентриамінпентаоцтова кислота. Також до зо[b]тієнільна, нафто[2,3-b]тіенільна, тіантренільхелатоутворювальних засобів належать сполуки, на, фурильна, піранільна, ізобензофуранільна, які містять сульфгідрильні або амінні компоненти, бензоксазолільна, хроменільна, ксантенільна, фезагальна кількість яких у будь-якій комбінації станоксантиїнільна, 2Н-піролільна, піролільна, імідановить не менше чотирьох. Ці сульфгідрильні або золільна, піразолільна, піридильна, піразинільна, амінні компоненти є відокремленими один від одпіримідинільна, піридазинільна, індолізинільна, ного принаймні двома атомами, які можуть бути ізоіндолільна, 3Н-індолільна, індолільна, індазолівуглецем, азотом, киснем або сіркою. Особливо льна, пуринільна, 4Н-хінолізинільна, ізохінолільна, оптимальним для хелатоутворювального засобу, хінолільна, фталазинільна, нафтиридинільна, хіL, є металотіонеїн, який є добре відомим спеціаліназолінільна, цинолінільна, птеридинільна, 4 Нстам як хелатоутворювальний засіб для Тс-99m. карбазолільна, карбазолільна, -карболінільна, Термін "алкіл", застосований самостійно або фенантридинільна, акридинільна, перимідинільна, як частина іншої групи, стосується як лінійних, так і фенантролінільна, феназинільна, ізотіазолільна, розгалужених радикалів, що мають до 12 атомів фенотіазинільна, ізоксазолільна, фуразанільна та вуглецю, таких як метил, етил, пропіл, ізопропіл, феноксазинільна групи). бутил, t-бутил, ізобутил, 19 пентил, гексил, ізогекТермін "аралкіл" або "ариломалкіл", застососил, гептил, 4,4-диметилпентил, октил, 2,2,4ваний самостійно або як частина іншої групи, стотриметилпентил, ноніл, децил, ундецил, додецил. сується С1-12 алкільних, в оптимальному варіанті В оптимальному варіанті алкіл має від 1 до 6 атоС1-6 алкільних груп, як було вказано вище, які мамів вуглецю. ють арильний замісник, такий як бензил, фенілеВжитий авторами термін "алкеніл" означає літил або 2-нафтиломметил. нійний або розгалужений радикал, що має 2-20 Термін "циклоалкіл", застосований самостійно атомів вуглецю, якщо довжина ланцюга не обмеабо як частина іншої групи, стосується циклоалкіжується ними, включаючи, крім інших, етеніл, 1льної групи, яка містить від 3 до 9 атомів вуглецю, пропеніл, 2-пропеніл, 2-метил-1-пропеніл, 1в оптимальному варіанті - від 3 до 7 атомів вуглебутеніл, 2-бутеніл, і т. ін. В оптимальному варіанті цю. Типовими прикладами є циклопропіл, циклоалкенільний ланцюг має довжину від 2 до 10 атобутил, циклопентил, циклогексил, циклогептил, мів вуглецю, краще - від 2 до 8 атомів вуглецю, циклооктил та циклононіл. найкраще - від 2 до 4 атомів вуглецю. Вжитий авторами термін "С7-12 біциклічний алВжитий авторами термін "алкініл" означає лікіл" охоплює біцикло[2.2.1]гептил (норборніл), бінійний або розгалужений радикал, що має 2-20 цикло[2.2.2]октил, 1,1,3атомів вуглецю, якщо довжина ланцюга не обметриметилбіцикло[2.2.1]гептил (борніл), і т. ін. жується ними, причому існує принаймні один потВжитий авторами термін "С10-16 трициклічний рійний зв'язок між двома з атомів вуглецю у ланалкіл" охоплює трицикло[5,2,1,02.6] децил, адаманцюгу, включаючи, крім інших, ацетилен, 1тил і т. ін. пропілен, 2-пропілен, і т. ін. В оптимальному варіТермін "галоген" або "гало", застосований саанті алкенільний ланцюг має довжину від 2 до 10 мостійно або як частина іншої групи, стосується атомів вуглецю, краще - від 2 до 8 атомів вуглецю, хлору, брому, фтору або йоду з хлором та фтонайкраще - від 2 до 4 атомів вуглецю. ром, причому перевагу віддають фторові. В усіх описаних авторами випадках, коли існує Термін "моноалкіламін", застосований самосалкенільний або алкінільний компонент як замінна тійно або як частина іншої групи, стосується аміногрупа, ненасичений зв'язок, тобто, вініленовий або групи, яка є заміщеною однією алкільною групою, ацетиленовий зв'язок, в оптимальному варіанті не яка має від 1 до 12, в оптимальному варіанті - від 21 75093 22 1 до 6 атомів вуглецю. Термін "діалкіламін", застосований самостійно або як частина іншої групи, стосується аміногрупи, яка є заміщеною двома алкільними групами, кожна з яких має від 1 до 12, в оптимальному варіанті від 1 до 6 атомів вуглецю. Вжитий авторами термін "гідроксіалкіл" стосується будь-якої з вищезгаданих алкільних груп, заміщених одним або кількома гідроксильними компонентами. Вжитий авторами термін "карбоксіалкіл" стосується будь-якого з вищезгаданих алкільних груп, заміщених одним або кількома карбоновокислотними компонентами. Вжитий авторами термін "гетероцикл" або "гетероциклічне кільце", за винятком окремо зазначених випадків, означає стійку 5-7-членну моноабо біциклічну або стійку 7-10-членну біциклічну гетероциклічну кільцеву систему, кожне кільце якої може бути насиченим або ненасиченим, і яка складається з атомів вуглецю та від одного до трьох гетероатомів, вибраних із групи, яка складається з Ν, Ο та S, причому гетероатоми азоту та сірки необов'язково можуть бути окисненими, і гетероатом азоту необов'язково може бути кватернізованим, і включає будь-яку біциклічну групу, в якій будь-яке з визначених вище гетероциклічних кілець є злитим з бензольним кільцем. Особливо На Схемі 1 показано, як боковий ланцюг оцтопридатними є кільця, які містять один атом кисню вої кислоти вводять у бензольне кільце шляхом або сірки, від одного до трьох атомів азоту, або реакції фторованого нітробензолу 1, такого як один атом кисню або сірки у комбінації з одним 1,2,3-трифторо-4-нітробензол, з металевою сіллю або двома атомами азоту. Гетероциклічне кільце заміщеного або незаміщеного малонатного естеможе бути приєднане на будь-якому гетероатомі ру, такою, як діетилмалонат, у відповідному розабо атом вуглецю, що в результаті забезпечує чиннику, такому як тетрагідрофуран (THF), з настійку структуру. Прикладами таких гетероциклічступним кислотним гідролізом та них груп є піперидиніл, піперазиніл, 2декарбоксилюванням після нагрівання, для одероксопіперазиніл, 2-оксопіперидиніл, 2жання сполуки 2 [Yokomoto, M, W., et al., опублікооксопіролодиніл, 2-оксоазепініл, азепініл, піроліл, вана ЕР заявка №0470578 А1 (1991)]. Карбоксиль4-піперидоніл, піролідиніл, піразоліл, піразолідину групу сполуки 2 перетворюють на гідроксильну ніл, імідазоліл, імідазолініл, імідазолідиніл, піригрупу за типових відновних умов, таких як комдил, піразиніл, піримідиніл, піридазиніл, оксазоліл, плекс боран (ВН3)-ТНР та борогідриду натрію оксазолідиніл, ізоксазоліл, ізоксазолідиніл. мор(NaBH4) у відповідному розчиннику, такому як THF, фолініл, тіазоліл, тіазолідиніл, ізотіазоліл, хінуклідля одержання спирту 3 [Yokomoto, Μ, W., et al., диніл, ізотіазолідиніл, індоліл, хінолініл, ізохіноліibid]. Введення відповідної функціональності пара ніл, бензімідазоліл, тіадіазоїл, бензопіраніл, до нітрогрупи у кільці досягають шляхом ароматибензотіазоліл, бензоксазоліл, фурил, тетрагідрочного нуклеофільного заміщення фториду у спофурил, тетрагідропіраніл, тієніл, бензотієніл, морлуці 3 відповідним нуклеофільним реагентом, тафолініл, тіаморфолінілсульфоксид, тіаморфолінілким як трет-бутиламін, у відповідних розчинниках, сульфон та оксадіазоліл. Морфоліно означає те ж таких як диметилсульфоксид (DMSO) та толуол, з саме, що й морфолініл. дефлегмацією, для одержання сполуки 4 Вжитий авторами термін "гетероатом" означає [Yokomoto, Μ, W., et al., ibid]. Захисну групу азоту, атом кисню ("О"), атом сірки ("S") або атом азоту таку як трет-бутил, у сполуці 4 видаляють за стан("N"). Зрозуміло, що у разі, коли гетероатом є азодартних умов, таких як концентрована соляна кисa b том, він може утворювати компонент NR R , у лота (HCI), з дефлегмацією, для одержання споa b якому R та R незалежно один від одного є водлуки 5 [Yokomoto, Μ, W., et al., ibid]. Гідроксильну нем або C1-C8 алкілом, або разом з азотом, з яким групу сполуки 5 захищають відповідною захисною вони є зв'язаними, утворюють насичене або ненагрупою, такою, як ацетил, за стандартних умов, сичене 5-, 6- або 7-членне кільце. добре зідомих спеціалістам [Greene, T.W., and Схеми 7-8 показують шлях синтезу сполук ФоWuts, P.G.M., Profecting Groups in Orgranic nd рмули l. Synthesis, 2 ed., John Wiley and Sons, Inc., New York (1991)], таких як ацетилхлорид у дихлорoметані (DCM) у присутності основи, такої як триетиламін або діізопропілетиламін (DlEA), для одержання сполуки 6. З'єднання активованої карбонільної сполуки ACOCl зі сполукою 6 у відповідному розчиннику, такому як DCM, дає сполуку 7. 23 На Схемі 2 показано, що відновлення арилнітросполуки 7 за типових умов, таких як каталітична гідрогенізація воднем у присутності паладію на активованому вугіллі в етанолі або метанолі дає ариламін 8. Ацетильну захисну групу сполуки 8 видаляють (для підвищення розчинності сполуки перед обробкою аміногрупи) шляхом гідролізу за основних умов, таких як водний розчин карбонату калію (К2СО3) у метанолі, для звільнення захищеної гідроксильної групи, одержуючи сполуку 9. Потрібний R6 вводять у the центральний каркас сполуки 9 шляхом реакції Зандмайера [(а) Gunstone, F.D., et al., Org. Syn. Collect Vol.1, Wiley, New York, N.Y. (1941), p.170; (b) Yokomoto, M, W., et al., опублікована ЕР заявка №0470578 A1 (1991)] з відповідними реагентами, такими, як нітрит натрію (NaNO2) та HCl, а потім хлорид міді (l) (CuCl), або шляхом замінного дезамінування [Doyte, Μ. P., et al., J. Org. Chem. 42:2426 (1977)] з відповідними реагентами, такими, як трет-бутилнітрит (t-BuONO) та хлорид міді (ll) (СuСl2), для одержання сполуки 10. Аміногрупу ариламіну 9 перетворюють на метильну групу за умов вуглець-вуглецевого з'єднання у присутності паладієвого каталізатора через проміжну арендіазонієву сіль [Kikukawa, К., et al., J. Org. Chem. 48.7333 (1983)]. Сполуку 10, у свою чергу, відновлюють відповідним відновником, таким як ВН3, для утворення потрібного фрагмента WY сполуки 11, де Υ є -ΝΗ-. Окиснення сполуки 11 окиснювачем, таким як комплекс триоксид сірки піридин, (SO3 - піридин) у DCM, дає альдегід 12. Побудови центру та лівого фрагмента заданої сполуки зрештою досягають шляхом подальшого окиснення альдегіду 12 до карбонової кислоти 13 за відповідних умов окиснення, таких як хлорит натрію (NaClO2), у присутності дигідрофосфату натрію (NaH2PO4) та DMSO [Daicanate, Ε., et al., J. Org. Chem. 57:567(1986)]. 75093 24 На Схемі 3 показано, як кислоту 13 з'єднують із відповідним аміном 14, таким як захищений Огуанідиніламін [Tiartbao Lu, et al., WO 99/26926 (1999)], або амінопіридиніламін [Sanderson, P. Ε., et al., WO 97/01338 (1997)], у присутності типового реагента пептидного зв'язування, такого як реагент Castro (ВОР), та основи, такої як DlEA, у відповідному розчиннику, такому як Ν,Νдиметилформамід (DMF), для одержання аміду 15. Захисні групи, такі як трет-(бутокси)карбоніл (Вос), необов'язково видаляють за типових умов депротекції, таких як розчин трифторооцтової кислоти (TFA) у DCM, якщо В є О-гуанідином, або розчин НСl у 1,4-діоксані, якщо В є амінопіридином, для утворення вільного О-гуанідину або амінопіридину відповідно. На Схемі 4 показано, як похідну фенілоцтової кислоти 16 нітрують у мета-позиції бензольного кільця, застосовуючи стандартні умови, такі як 96% азотна кислота у конц. сірчаній кислоті [Sindetar et al., Coll. Czechosloy. Chem. Commun. 42:2231 (1977)], для одержання нітросполуки 17. Карбоновокислотну групу сполуки 17 після цього захищають, застосовуючи стандартні умови, добре відомі спеціалістам [Greene, Т.W. and Wuts, P.G.Μ., Profective Groups in Оrgаniс Synthesis, 2nd 25 75093 26 ed., John Wiley and Sons, New York (1991)], такі як рогенізація над паладієм(0) на вугіллі, у відповідперетворення на естер шляхом реакції з оксалілхному розчиннику, такому як етанол. Потім амін лоридом, а потім спиртом ΡΟΗ, для одержання ацилюють або сульфонілують, як показано на естеру 18 (де Ρ є типовою карбоновокислотною Схемі 4, для одержання проміжної сполуки 25 і захисною групою). Відновлення нітрогрупи здійсалкоксіамін піддають депротекції, застосовуючи нюють, застосовуючи відповідний реагент, такий стандартні умови, добре відомі спеціалістам як хлорид олова (ll), у відповідному розчиннику, [Greene, Т.W. and Wuts, P.G.Μ., Profectivе Groups такому як етанол, і одержаний у результаті амін 19 in Оrgаniс Synthesis, 2nd edition, John Wiley and приводять у реакцію з ацилюючим агентом Sons, New York (1991)], такі як водний розчин ме(W=R1C(O)) або сульфонілуючим агентом тиламіну в етанолі/THF. Гуанідинілування одержа(W=R1S(O)2), таким як бензилсульфонілхлорид, та ного в результаті алкоксіаміну 26 здійснюють за відповідною основою, такою, як N-метилморфолін, допомогою стандартного реагента для гуанідиніу розчиннику, такому як DCM, для одержання Nлування, такого як N,N'-бiс(трет-бутоксикарбонiл)заміщеного амінофенілацетату 20 (Y=-NH-). Кар3-метилтіосечовина [Bergeron, R.J. and McManis, боновокислотну групу піддають депротекції, застоJ.S., J. Org. Сhem. 52:1700 (1987)] або N-Ra-N'совуючи стандартні умови, добре відомі спеціалісRb,Rc-1H-пipaзoл-1-кapбoкcaмiдин [Bernatowicz, там [Greene, Т.W. and Wuts, P.G.Μ., Profecfive M.S. et al., Tetrahegron Lett. 34:3389 (1993)], і гуаніGroups in Organic Synthesis, 2nd, edition, John Wiley дин необов'язково піддають депротекції, як покаand Sons, New York (1991)], такі як гідроліз водним зано на Схемі 3, для одержання кінцевої сполуки розчином гідроксиду, для одержання кислоти 13 27. (Υ=-ΝΗ-). Потім и з'єднують з аміном 14 і піддають депротекції, як показано на Схемі 3, для одержання фенілацетаміду 15 (Υ=ΝΗ). На Схемі 5 показано, як нітрофенілоцтову кислоту 17 з'єднують з аміноспиртом 21, таким як етаноламін, застосовуючи стандартну процедуру пептидного зв'язування, таку як показано на Схемі 3, для одержання спирту 22. Спирт перетворюють на захищений алкоксіамін шляхом з'єднання з Nгідроксифталімідом, застосовуючи стандартні реагенти [Mitsunobu, О., Synthesis 1/1 (1981)], такі як трифенілфосфін та діетилазодикарбоксилат, у відповідному розчиннику, такому як THF, для одержання сполуки 23, яку потім перетворюють на анілін 24 у типових відновних умовах, таких як гід На Схемі 6 показано, як вихідний матеріал кетон, альдегід (R11=H) або карбонову кислоту (R11=OH) 28 відновлюють відповідним реагентом, таким як боран-THF, для одержання спирту 29, який потім перетворюють на краще відщеплювану групу шляхом реакції з сульфонілхлоридом, таким як метансульфонілхлорид, у відповідному розчиннику, такому як DCM, для одержання сполуки 30. Сульфонат заміщують ціанідом за стандартних умов, таких як ціанід калію у підданому дефлегмації ацетонітрилі, для одержання нітрилу 31, який потім піддають гідролізові типовим реагентом, таким як водний розчин гідроксиду. З'єднання одержаної в результаті кислоти 17 з аміном 14 здійснюють, як показано на Схемі 3, для одержання проміжної сполуки 32, і нітрогрупу відновлюють, як показано на Схемі 4 або 5, для одержання аніліну 33. Його ацилюють або сульфонілують, як показа 27 75093 но на Схемі 4, і гуанідин необов'язково піддають депротекції, як показано на Схемі 3, для одержання кінцевої сполуки 15 (Y=NH). На Схемі 7 показано, як нітрофенол 34 алкілують аліловим галідом 35 та відповідною основою, такою, як карбонат цезію, у полярному апротонному розчиннику, такому як DMF, одержуючи проміжну сполуку 36, яку потім перетворюють на сполуку 37 через ароматичне перегрупування Кляйзена шляхом нагрівання. Фенол захищають, застосовуючи типові реагенти, такі як бензилбромід та карбонат цезію, у розчиннику, такому як DMF, для одержання сполуки 38 (де Ρ є типовою гідроксильною захисною групою) і нітрогрупу відновлюють, як показано на Схемі 4 або 5, для одержання аніліну 39. Анілін 39 перетворюють на проміжну сполуку 40, як показано на Схемі 4, і алкен піддають окиснювальному розщепленню, застосовуючи стандартні умови, такі як перйодат натрію та тетраоксид осмію у діоксані/воді, а потім реагент Джонса, для одержання кислоти 41. Потім Π з'єднують з аміном 14, гуанідин необов'язково піддають де протекції, як показано на Схемі 3, і фенольну групу необов'язково піддають де протекції, застосовуючи стандартні умови, такі як гідрогенізація над паладієм (0) на вугіллі, у відповідному розчиннику, такому як етанол, для одержання заданої сполуки 42. 28 На Схемі 8 показано, як монозахищений катехол 43 сульфонілують реагентом W-Cl, таким як мета-толуолсульфонілхлорид, у розчиннику, такому як DCM, у присутності основи, такої як триетиламін, одержуючи сполуку 44. Захисну групу видаляють, застосовуючи стандартні умови, такі як трибромід бору у DCM, і одержаний в результаті фенол 45 алкілують аліловим галідом 35 для одержання сполуки 46, яку перегруповують у фенол 47 і піддають захистові для одержання проміжної сполуки 48, як показано на Схемі 7. Алкен піддають окиснювальному розщепленню, застосовуючи стандартні умови, такі як перйодат натрію та хлорид рутенію(lll) в ацетонітрилі/воді [Ashby, Ε.С. and Goel, А.В., J. Оrg. Chem. 46:3936 (1981)], а потім реагент Джонса, одержуючи кислоту 49, яку потім з'єднують з аміном 14 і необов'язково піддають депротекції, як показано на Схемах 3 та 7, для одержання заданої сполуки 50. До фармацевтично прийнятних солей сполук Формули l (у формі розчинних або диспергованих у воді або олії продуктів) належать традиційні нетоксичні солі або четвертинні амонієві солі, які утворюються, наприклад, з неорганічних або органічних кислот або солей. Прикладами таких кислих адиційних солей є ацетат, адипат, альгінат, аспартат, бензоат, бензолсульфонат, бісульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропіонат, диглюконат, додецилсульфат, етансульфонат, фумарат, глюкогептаноат, гліцерофосфат, гемісульфат, гептаноат, гексаноат, гідрохлорид, гідробромід, гідройодид, 2гідроксіетансульфонат, лактат, малеат, метансульфонат, 2-нафталінсульфонат, нікотинат, нітрат, оксалат, памоат, пектинат, персульфат, 3фенілпропіонат, пікрат, півалат, пропіонат, сукцинат, сульфат, тартрат, тіоціанат, тозилат, трифтороацетат та ундеканоат. До основних солей належать солі амонію, солі лужних металів, такі як солі натрію та калію, солі лужноземельних металів, такі як солі кальцію та магнію, солі з органічними осно 29 75093 30 вами, такі як дициклогексиламінні солі, N-метил-Dабо фізично зв'язаних з матеріалами, які викорисглюкамін, та солі з амінокислотами, такими як артовують у виробництві засобів, які застосовують гінін, лізин і т. ін., включаючи солі з гуанідинільним для забирання крові, кровообігу та зберігання крокомпонентом. Крім того, основні азотовмісні групи ві, таких як катетери, пристрої для діалізу крові, можуть бути кватернізовані такими агентами, як шприці та трубки для забирання крові та лінії. галіди нижчих алкілів, такі як метил-, етил-, пропілСполуки даного винаходу також застосовують як та бутилхлориди, броміди та йодиди; діалкілсульантикоагулянти у системах штучного кровообігу. фатами, такими як диметил-, діетил-, дибутил та Було виявлено, що стенти зменшують рестедіамілсульфати; довго ланцюговими галідами, нозу, але вони є тромбогенними. Для зниження такими як децил-, лаурил-, міристил- та стеарилхтромбогенності стентів їх вкривають агентом, що лориди, броміди та йодиди; аралкілгалідами, таінгібує тромбін, або вводять, адсорбують або кокими як бензил- та фенетилброміди та ін. Оптимавалентно приєднують його до поверхні стента. льними кислотами для утворення кислих Сполуки даного винаходу можуть бути застосовані адиційних солей є HCI, оцтова кислота та трифтоз цією метою. Сполуки винаходу можуть бути прирооцтова кислота. єднані або введені у розчинні та/або біодеградоСполуки даного винаходу представляють новані полімери, а після цього нанесені на матеріали вий клас ефективних інгібіторів метало-, кислотстентів. Такими полімерами можуть бути полівінілних, тіол- та серинпротеаз. Прикладами серинпропіролідон, полігідроксипропілметакриламідфенол, теаз, які інгібуються сполуками, які охоплюються полігідроксіетиласпартамідфенол або поліетилевинаходом, є еластаза нейтрофілів, протеолітичноксидполілізин, заміщені пальмітоїловими залишний фермент, який бере участь у патогенезі емфіками, полімолочна кислота, полігліколева кислота, земи; хімотрипсин та трипсин, травні ферменти; співполімери полі молочної та полігліколевої киселастаза підшлункової залози та катепсин G, хімолоти, поліепсилонкапролактон, полігідроксимаслятрипсиноподібна протеаза, також пов'язана з лейна кислота, поліортоестери, поліацеталі, полідигікоцитами; тромбін та фактор Ха, протеолітичні дропірани, поліціаноакрилати та зшиті або ферменти шляху коагуляції крові. амфіпатичні блок-співполімери гідрогелів. [Див. Iнгібування термолізину, металопротеази, та Європейську заявку 761251, Європейську заявку пепсину, кислотної протеази, також розглядають 604022, патент Канади №2,164,684 та опубліковані як можливість застосування сполук даного винаРСТ заявки №№ WO 96/11668, WO 96/32143 та ходу. Сполуки даного винаходу в оптимальному WO 96/38136]. варіанті застосовують для інгібування трипсиноЗавдяки впливові тромбіну на клітини-хазяї, подібних протеаз. такі як клітини гладенького м'яза, ендотеліальні Для кінцевого застосування ефективність та клітини та нейтрофіли, сполуки даного винаходу інші біохімічні параметри, що стосуються характемають додаткове застосування у лікуванні або ристик сполук даного винаходу щодо інгібування профілактиці синдрому розладу дихання у доросферментів, легко визначаються стандартними біолих, запальних реакцій; для загоєння ран; реперхімічними способами, відомими спеціалістам. Нафузійних пошкоджень; атеросклерозу та рестенозу приклад, кінцевим застосуванням сполук, які інгіпісля пошкодження, такого як балонна ангіопласбують хімотрипсин та трипсин, є застосування з тика, атеректомія та розміщення артеріальних метою лікування панкреатиту. Діапазони доз для стентів. конкретного кінцевого застосування, звичайно, Сполуки даного винаходу можуть застосовузалежать від визначених діагностом характеру та ватися у лікуванні від неоплазії та метастазів, а тяжкості хвороби пацієнта або тварини, яких підтакож нейродегенеративних захворювань, таких як дають лікуванню. Передбачається, що ефективний хвороба Альцгеймера та хвороба Паркінсона. діапазон доз має становити приблизно від 0,01 до При застосуванні як інгібіторів тромбіну сполу10мг/кг на день для дієвого терапевтичного ефекки даного винаходу вводять в ефективній кількості ту. у діапазоні доз зід приблизно 0,1 до приблизно Сполуки даного винаходу, які розрізняють за їх 500мг/кг, в оптимальному варіанті - від 0,1 до здатністю інгібувати тромбін, застосовують для 10мг/кг маси тіла, у режимі єдиної дози на день різних терапевтичних цілей. Як інгібітори тромбіну, або розподіленої на 2-4 дози на день. сполуки даного винаходу інгібують вироблення При застосуванні як інгібіторів тромбіну сполутромбіну. Отже, ці сполуки є корисними для лікуки даного винаходу можуть застосовуватись у вання або профілактики станів, які характеризукомбінації з тромболітичними агентами, такими як ються анормальним венозним або артеріальним тканинний активатор плазміногену, стрептокіназа тромбозом, пов'язаним з виробленням або дією та урокіназа. Крім того, сполуки даного винаходу тромбіну. До цих станів, крім інших, належать троможуть застосовуватись у комбінації з іншими анмбоз глибокої вени; дисемінована внутрішньосутитромботичними або антикоагулянтними ліками, динна коагулопатія, яка трапляється під час сепдо яких, крім інших, належать антагоністи фібринотичного шоку, вірусні інфекції та рак; інфаркт гену та антагоністи тромбоксанового рецептора. міокарда; інсульт; шунтування коронарної артерії; інгібітори тромбіну також можуть бути з'єднані утворення фібрину в оці; ендопротезування тазосз розчинними полімерами як носії спрямованих тегнового суглоба; утворення тромбу в результаті лікарських засобів. До таких полімерів належать або тромболітичної терапії, або крізьшкірної транполівінілпіролідон, пірановий співполімер, полігідслюмінальної коронарної ангіопластики (РСТА). рокси-пропілметакриламід-фенол, полігідроксіеіншими прикладами є застосування вищезгаданих тил-аспартамід-фенол або поліетиленоксидінгібіторів тромбіну як антикоагулянтів, введених полілізин, заміщений пальмітоїловими залишками. 31 75093 32 Крім того, інгібітори тромбіну можуть бути з'єднані ки даного винаходу також можуть бути корисними з класом біодеградованих полімерів, які застосоу лікуванні від доброякісної гіпертрофії передміхувують для досягнення контрольованого вивільрової залози та карциноми передміхурової залози, нення ліків, такими як, наприклад, полімолочна лікування від псоріазу та як абортивні засоби. При кислота, полігліколева кислота, співполімери полі практичному застосуванні в ефективності та інших молочної та полігліколевої кислоти, поліепсилонбіохімічних параметрах характеристик сполук дакапролактон, полігідроксимасляна кислота, поліоного винаходу щодо інгібування ферментів можна ртоестери, поліацеталі, полідигідропірани, поліцілегко пересвідчитися стандартними біохімічними аноакрилати та зшиті або амфіпатичні блокспособами, добре відомими спеціалістам. Фактичспівполімери гідрогелів. ний діапазон доз для цього застосування залежить Еластаза лейкоцитів людини вивільнюється від характеру та тяжкості хворобливого стану паціполіморфноядерними лейкоцитами у місцях запаєнта або тварини, яких піддають лікуванню, і вилення і, таким чином, є однією з причин численних значається діагностами. Передбачається, що захворобливих станів. Очікується, що сполуки даногальний діапазон доз має становити приблизно від го винаходу матимуть протизапальний вплив, ко0,01 до 10мг/кг на день для дієвого терапевтичнорисний для лікування від подагри, ревматоїдного го ефекту. артриту та інших запальних хвороб, а також для Крім того, сполуки даного винаходу застосолікування від емфіземи, інгібіторні властивості вують для аналізу комерційних реагентівсполук даного винаходу щодо еластази лейкоцитів ферментів на концентрацію в активних ділянках. визначають описаними нижче способами. КатепНаприклад, хімотрипсин реалізується як стандартсин G також є пов'язаним з хворобливими станами ний реагент для клінічного кількісного аналізу акартриту, подагри та емфіземи, а також з гломерутивності хімотрипсину у підшлункових соках та лонефритом та інвазіями легенів, викликаними екскрементах. Такі аналізи дозволяють діагностуінфекціями у легенях. При практичному застосувати шлунково-кишкові та панкреатичні порушенванні в інгібіторних властивостях сполук Формули I ня. Еластаза підшлункової залози також продаєтьщодо ферментів можна легко пересвідчитись стася як реагент для кількісного аналізу 1ндартними біохімічними способами, які є добре антитрипсину у плазмі. Концентрація оивідомими спеціалістам. антитрипсину у плазмі зростає у процесі різних !нгібіторні властивості сполук, які охоплюються запальних хвороб, і дефіцит 1-антитрипсину є обсягом даного винаходу, щодо катепсину G випов'язаним зі збільшенням випадків легеневих значають описаним нижче способом. Композицію хвороб. Сполуки даного винаходу можуть застосочастково очищеного людського катепсину G одервуватися для підвищення точності та відтворюважують, застосовуючи процедуру, описану в роботі ності цих аналізів через титраметричну стандарти[Baugh et al., Biochemistry 75; 836 (1979)]. Гранули зацію комерційної еластази, яка продається як лейкоцитів є головним джерелом для одержання реагент. [Див. Патент США №4,499,082]. еластази лейкоцитів та катепсину G (хімотрипсиАктивність протеази в екстрактах деяких білків ноподібної активності). Лейкоцити розчиняють і під час очищення певних білків є поширеною програнули відокремлюють. Гранули лейкоцитів екстблемою, яка ускладнює і піддає ризикові результарагують 0,20Μ ацетат натрію, pH 4,0, і екстракти ти процедур виділення білка. Деякі протеази, придіалізують, застосовуючи 0,05Μ Tris-буфера, pH сутні в таких екстрактах, можуть інгібуватися під 8,0, що містить 0,05Μ NaC), до наступного дня при час етапів очищення сполуками даного винаходу, 4°С. Білкову фракцію осаджують під час діалізу і які міцно зв'язуються з різними протеолітичними відокремлюють шляхом центрифугування. Ця ферментами. фракція містить більшу частину хімотрипсиноподіФармацевтичні композиції винаходу можуть бної активності гранул лейкоцитів. Для кожного вводитись будь-якій тварині, яка може відчувати ферменту приготовляють специфічні субстрати, а цілющий вплив сполук винаходу. Головними серед саме, N-Suc-Ala-Ala-Pro-Val-p-нітроанілід та Suсцих тварин є люди, хоча винахід не обмежується Аlа-Аlа-Рго-Рhе-р-нітроанілід. Останній не гідролілише застосуванням для людини. зується еластазою лейкоцитів. Препарати фермеФармацевтичні композиції даного винаходу нтів піддають аналізові у 2,00мл 0,10Μ Hepesвводять будь-яким способом, який дозволяє досябуфера, pH 7,5, що містить 0,50Μ NaC!, 10% дигти потрібної мети. Наприклад, введення може метилсульфоксиду та 0,0020Μ Suс-Аlа-Аlа-Рrовідбуватися парентеральним, підшкірним, внутріРhе-р-нітроаніліду як субстрат. Гідроліз ршньовенним, внутрішньом'язовим, внутрішньоченітроанілідного субстрату спостерігають при 405нм ревинним, крізьшкірним, букальним або очним і 25°С. шляхом. В альтернативному варіанті або паралеПридатний діапазон доз для застосування льно введення може здійснюватися пероральним сполук даного винаходу як інгібіторів еластази шляхом. Дозування залежить від віку, стану здонейтоофілів і як інгібіторів катепсину G залежить ров'я та маси отримувача, типу паралельного лівід характеру та тяжкості хворобливого стану, які кування, якщо таке здійснюється, частоти лікуванвизначаються діагностами, і становить від 0,01 до ня та характеру потрібного ефекту. 10мг/кг маси тіла на день для вищезгаданих хвоКрім фармакологічно активних сполук, нові робливих станів. фармацевтичні композиції можуть містити відповіСполуки даного винаходу, які інгібують урокідні фармацевтично прийнятні носії, включаючи назу або активатор плазміногену, є потенційно наповнювачі та допоміжні речовини, які сприяють корисними для лікування від хворобливих станів, переробці активних сполук на композиції, придатні пов'язаних з надмірним ростом клітин. Такі сполудля фармацевтичного застосування. 33 75093 34 Фармацевтичні композиції даного винаходу До придатних композицій для парентеральноодержують звичним способом, наприклад, шляхом го введення належать водні розчини активних традиційного змішування, гранулювання, дражусполук у розчинній у воді формі, наприклад, розвання, розчинення або ліофілізації. Таким чином, чинні у воді солі, лужні розчини та циклодекстрифармацевтичні композиції для перорального занові сполуки включення. Найкращими лужними стосування можуть бути одержані шляхом комбісолями є солі амонію, одержані, наприклад, з Tris, нування активних сполук з твердими наповнювахолінгідроксидом, Bis-Tris-пропаном, Nчами, необов'язкового розтирання одержаної в метилглюкаміном або аргініном. Для стабілізації та результаті суміші та обробки суміші гранули після підвищення розчинності сполук даного винаходу у додавання відповідних допоміжних речовин, якщо воді застосовують один або кілька модифікованих це бажано або необхідно, для одержання ядра або немодифікованих циклодекстринів. Циклодектаблеток або драже. стрини, які застосовують з цією метою [описано у Для композицій даного винаходу, придатних патентах США №№ 4,727,064, 4,764,604 та для введення людині, термін "наповнювач" охоп5,024,998]. лює, крім інших, наповнювачі, описані у довіднику Крім того, суспензії активних сполук вводять як [Handbook of Pharmaceutical Excipienis, American придатні олійні суспензії для ін'єкцій. До придатних Pharmaceutical Association, 2nd Ed. (1994)], на який ліпофільних розчинників або зв'язувальних речоавторами робиться посилання в повному обсязі. вин належать жирні олії, наприклад, кунжутова Придатними наповнювачами є, зокрема, такі напоолія, або естери синтетичних жирних кислот, навнювачі, як сахариди, наприклад, лактоза або цукприклад, етилолеат або тригліцериди або поліетироза, маніт або сорбіт, целюлозні композиції ленгліколь-400 (сполуки, розчинні у PEG-400). Вота/або фосфати кальцію, наприклад, трифосфат дні суспензії для ін'єкцій можуть містити речовини, кальцію або гідрофосфат кальцію, а також зв'язуякі підвищують в'язкість суспензії, наприклад, навальні речовини, такі як крохмальна паста з викотрійкарбоксиметилцелюлозу, сорбіт та/або декристанням, наприклад, кукурудзяного крохмалю, стран. Суспензія необов'язково також може містипшеничного крохмалю, рисового крохмалю, картоти стабілізатори. пляного крохмалю, желатин, трагакант, метилцеСполуки Формули l можуть бути мічені радіоалюлоза, гідроксипропілметилцелюлоза, натрійкарктивним йодом шляхом застосування реакції обмібоксиметилцелюлоза та/або полівінілпіролідон. ну. Обмін гарячого йоду на холодний йод є добре Якщо потрібно, додають дезінтегратори, такі як відомим спеціалістам. В альтернативному варіанті вищезгадані крохмалі, а також карбоксиметиловий мічену радіоактивним йодом сполуку одержують із крохмаль, зшитий полівінілпіролідон, агар або альвідповідної бромзаміщеної сполуки через трибутигінова кислота або її сіль, така як альгінат натрію. лстанілову проміжну сполуку. [Див. Патент США Допоміжними речовинами є, насамперед, регуля№5,122,361, на який авторами робиться посилантори витрати та мастила, наприклад, кремнезем, ня]. тальк, стеаринова кислота або її солі, такі як, стеДаний винахід також охоплює композиції, коарат магнію або стеарат кальцію, та/або поліетирисні для in vivо візуалізації тромбів у ссавців, ленгліколь. Ядра драже забезпечують відповідним причому композиції складаються зі сполуки Форпокриттям, яке, у разі потреби, є стійким перед мули l у комплексі з радіоактивним атомом. дією шлункових соків. Для цього використовують Для сполук Формули l, придатними радіоактиконцентровані розчини сахаридів, які необов'язковними атомами є Со-57, Сu-67, Ga-67, Ga-68, Ruво можуть містити гуміарабік, тальк, полівінілпіро97, Tc-99m, ln-111, !n-113m, Hg-197, Au-198 та Pbлідон, поліетиленгліколь та/або діоксид титану, 203. Деякі радіоактивні атоми мають відмінні власлакоутворювальні розчини та придатні органічні тивості для використання у різних способах радіорозчинники або суміші розчинників. Для забезпехімічної візуалізації. Зокрема, технецій-99m (Тсчення покриття, стійкого перед дією шлункових 99m) є ідеальним радіоактивним атомом для візусоків, використовують розчини відповідних целюалізації завдяки його ядерним характеристикам. лозних композицій, таких як фталат ацетилцелюРеній-186 та -188 також мають гаммалози або фталат гідроксипропілметилцелюлози. випромінення, що забезпечує візуалізацію. ОптиДо покриття таблеток або драже додають барвнимальні композиції містять радіоактивний атом, Тски або пігменти, наприклад, для розпізнання або 99m. для розрізнення комбінацій доз активних сполук. Сполуки Формули l можуть бути мічені будьіншими фармацевтичними композиціями, які яким з багатьох відомих спеціалістам способів для можуть застосовуватися перорально, є push-fit забезпечення композиції даного винаходу. Наприкапсули, виготовлені з желатину, а також м'які заклад, ці сполуки можуть бути мічені хелатоутворюпаяні капсули, виготовлені з желатину та пластивальним агентом, таким як діетилентриамінпентафікатора, такого як гліцерин або сорбіт. Push-fit оцтова кислота (DTPA) або металотіонеїн, обидва капсули можуть містити активні сполуки у формі з яких можуть бути ковалентно зв'язані зі сполукою гранул, які можуть бути змішані з наповнювачами, Формули l. такими як лактоза, зв'язувальними речовинами, Взагалі, композиції даного винаходу, що містакими як крохмалі, та/або мастилами, такими як тять технецій-99m, одержують шляхом утворення тальк або стеарат магнію, і, необов'язково, стабіліводної суміші технецію-99m і відновника та роззаторами. У м'яких капсулах активні сполуки в опчинного у воді ліганду з наступним контактуванням тимальному варіанті розчиняють або суспендують суміші зі сполукою даного винаходу, представлеу відповідних рідинах, таких як жирні олії або рідною Формулою l. Наприклад, візуалізуючі сполуки кий парафін. Крім того, додають стабілізатори. згідно з цим винаходом одержують шляхом реакції 35 75093 36 технецію-99m (в окисненому стані) зі сполуками ють у кількості, яка в оптимальному варіанті стаданого винаходу, які мають хелатоутворювальний новить приблизно 1-50мКі. Кількість мКі на мг спозасіб, у присутності відновника для утворення стійлуки даного винаходу в оптимальному варіанті кого комплексу між технецієм-99m у відновленому становить приблизно 30-150. стані (валентність lV або V). Реакція між сполукою Формули l та комплекОдин варіант втілення композиції даного винасом іона металу - ліганду перенесення в оптимаходу одержують шляхом мічення сполуки Формули льному варіанті здійснюють у водному розчині при l, що має хелатоутворювальний засіб DTPA, з техрівні pH, на якому сполука Формули і є стійкою. нецієм-99m. Його здійснюють шляхом комбінуван"Стійка" означає, що сполука залишається розчиння заданої кількості (від 5мкг до 0,5мг) сполуки ною і зберігає свою інгібіторну активність щодо даного винаходу з водним розчином, що містить тромбіну. Зазвичай рівень pH для реакції станоцитратний буфер та олов'яний відновник, з настувить приблизно від 5 до 9, причому оптимальний пним додаванням щойно елюйованого пертехнерівень pH становить більше 6-8. Комплекс технетату натрію, що має заданий рівень радіоактивноцію-99m-цитрату та сполуку Формули l інкубують, в сті (15мКі). Після інкубування суміші при кімнатній оптимальному варіанті - при температурі від прибтемпературі реакційну суміш набирають у захищелизно 20°С до приблизно 60°С, найкраще - від ний шприц крізь стерильний фільтр (0,2-0,22 мікприблизно 20°С до приблизно 37°С, протягом досрона), потім розподіляють у 0,9% соляного розчитатнього періоду часу для забезпечення перенену для ін'єкцій, якщо потрібно. сення іона металу з цитратного комплексу до хеінший варіант втілення композиції даного вилатоутворювального засобу сполуки Формули l. Як находу одержують шляхом мічення сполуки Форправило, для завершення реакції перенесення за мули l, що має металотіонеїновий хелатоутворюцих умов потрібно не більше години. вальний засіб, з технецієм-99m. Його здійснюють Альтернативні композиції даного винаходу шляхом комбінування водного розчину пертехневключають мічену ln-111 сполуку даного винаходу. тату-99m натрію з водним розчином олов'яного Даний винахід також охоплює композиції споглюкогептонату для утворення розчинного комплелук даного винаходу, які є корисними для in vivо ксу технецію-99m (у відновленому стані) з двома візуалізації тромбів у ссавців і включають сполуку, молекулами глюкогептонату з наступним комбінупредставлену Формулою l, у комплексі з парамагванням цього розчину зі сполукою Формули l, що нітним атомом. має приєднаний до неї металотіонеїн. Після інкуОптимальними парамагнітними атомами є бування суміші протягом періоду часу і за умов, які двовалентні або тривалентні іони елементів з забезпечують заміну технецію-99m з глюкогептоатомним номером від 21 до 29, 42, 44 і від 58 до натного комплексу на металотіонеїн сполуки Фор70. Придатними іонами є хром(lll), марганець(ll), мули l, утворюється мічена технецієм композиція залізо(lll), залізо(ll), кобальт(ll), нікель(ll), мідь(ll), даного винаходу. празеодим(lll), неодим(lll), самарій(lll) та ітербій(lll). Відновники для застосування згідно зі спосоЗавдяки їх потужним магнітним моментам, оптибом є фізіологічно прийнятними для відновлення мальними вважають гадоліній(lll), тербій(lll), дистехнецію-99m з його окисненого стану до валентпрозій(lll), гольмій(lll) та ербій(lll). Особливу переності lV або V або для відновлення ренію з його вагу віддають парамагнітному атомові окисненого стану. Відновниками, які можуть застогадолінію(lll). совуватися, є хлорид олова, фторид олова, глюкоКомпозиції даного винаходу одержують шлягептонат олова, тартрат олова, дитіонат натрію. хом комбінування сполуки Формули l з парамагнітОптимальними агентами є олов'яні відновники, ним атомом. Наприклад, оксид металу або сіль зокрема, хлорид олова або глюкогептонат олова. металу (наприклад, нітрат, хлорид або сульфат) Кількість відновника є кількістю, необхідною для придатного парамагнітного атома розчиняють або відновлення технецію-99m для забезпечення зв'ясуспендують у середовищі, яке складається з зоди зування з хелатоутворювальним засобом сполуки та спирту, такого як метиловий, етиловий або ізоФормули l у відновленому стані цього радіоізотопу. пропіловий спирт. Цю суміш додають до розчину Наприклад, відновником є хлорид олова (SnCl2), еквімолярної кількості сполуки Формули l у подібякий застосовують у кількості 1-1,000мкг/мл. ному водному середовищі і перемішують. РеакційЛимонна кислота швидко утворює комплекс із ну суміш помірно нагрівають до завершення реактехнецієм-99m для утворення стійкого комплексу ції. Утворені нерозчинні композиції виділяють технецій-99m-цитрат. Після контакту зі сполукою шляхом фільтрування, а розчинні композиції видіФормули l швидко і за помірних умов досягають ляють шляхом випарювання розчинника. Якщо перенесення суттєвої кількості технецію-99m з кислотні групи хелатоутворювального засобу збейого цитратного комплексу до хелатоутворювальрігаються у композиції даного винаходу, додають ного засобу сполуки Формули l. Кількість лимонної неорганічні або органічні основи і навіть амінокискислоти (як цитрату натрію) може становити від лоти для перетворення кислотного комплексу на приблизно 0,5мг/мл до кількості, яка є максимальнейтральний комплекс з метою сприяння виділенно розчинною у середовищі. Оптимальна кількість ню або очищенню гомогенної композиції. Органічні лимонної кислоти становить від 15 до 30мкг/мл. основи або основні амінокислоти застосовують як Кількість сполуки Формули l, що має хелатоутнейтралізуючі агенти, так само, як і неорганічні ворювальний засіб, може становити від 0,001 до основи, такі як гідроксиди, карбонати або бікарбоприблизно 3мг/мл, в оптимальному варіанті - від нати натрію, калію або літію. приблизно 0,017 до приблизно 0,15мг/мл. l нарешДаний винахід також охоплює діагностичні ті, технецій-99m у формі пертехнетату застосовукомпозиції, корисні для in vivо візуалізації тромбів 37 75093 38 у ссавців, які включають фармацевтично прийнятпозиції, які міцно зв'язуються з тромбіном, пов'язаний носій та діагностично ефективну кількість комним з тромбом і, таким чином, знижують "передупозицій, які походять від сполук Формули l. мови" завдяки циркулюючій радіоактивності або "Діагностично ефективна кількість" композиції, парамагнетизмові, що виникають через незв'язані яка вимагається як доза, залежить від шляху ввезасоби візуалізації. Крім того, очікується, що in vivо дення, типу ссавця, якого піддають лікуванню, та візуалізація шляхом внутрішньокоронарної ін'єкції фізичних характеристик конкретного ссавця. Ці сполук, композицій або діагностичних композицій чинники та їх зв'язок із визначенням цієї дози є даного винаходу, має бути майже миттєвою, оскідобре відомими спеціалістам, які практикують у льки ці агенти візуалізації відразу насичують зв'ягалузі діагностики. Крім того, діагностично ефектизування тромбіну з тромбом. вна кількість та спосіб введення можуть спеціальВідповідним чином, даний винахід також охопно підбиратися для досягнення оптимальної ефеклює способи in vivо візуалізації тромбу у ссавців, тивності, але вони залежать від таких чинників, як причому ці способи включають етапи: (1) введення маса, режим харчування, паралельне лікування та ссавцеві діагностично прийнятної кількості сполуінші чинники, які визнаються спеціалістами у галузі ки, композиції або діагностичної композиції даного медицини. З будь-якої точки зору, доза для візуавинаходу та (2) виявлення тромбу у кровоносній лізації має бути достатньою для виявлення присусудині. тності засобу візуалізації у місці тромбу. Як правиВжитий авторами термін " in vivо візуалізація" ло, радіологічна візуалізація вимагає, щоб доза, стосується способів виявлення тромбу у ссавців, а яка забезпечується фармацевтичною композицією також визначення розміру, розташування та кільданого винаходу, становила приблизно від 5 до кості тромбів у ссавців та спостереження за роз20мкКі, в оптимальному варіанті - приблизно чиненням або збільшенням тромбу. 10мкКі. Магнітно-резонансна томографія вимагає, При застосуванні сполук, композицій або діагщоб доза, яка забезпечується, становила приблиностичних композицій in vivо цими способами зно від 0,001 до 5ммоль/кг, в оптимальному варіа"введення" здійснюють парентерально, системним нті - приблизно від 0,005 до 0,5ммоль/кг сполуки або місцевим способом. Системне введення здійФормули l у комплексі з парамагнітним атомом. У снюють шляхом ін'єкції сполук, композицій або будь-якому разі, спеціалістам відомо, що фактична діагностичних композицій даного винаходу у зручдоза залежить від розташування тромбу. ну і доступну вену або артерію. Воно включає, крім "Фармацевтично прийнятні носії" для застосуінших, введення через кубітальну вену. Місцеве вання in vivо є добре відомими спеціалістам у гавведення здійснюють шляхом ін'єкції сполук, комлузі фармацевтики і описані, наприклад, у позицій або діагностичних композицій даного ви[Remington's Phatmaceutical Sciences, Mack находу у місце, наближене у напрямку кровотоку Publishing Co. (A.R. Gennaro edit. 1985)]. Фармацедо вени або артерії, яка, за припущенням, містить втичні композиції даного винаходу можуть бути тромби, віддалені від місця ін'єкції. До таких спорецептовані з фармацевтично прийнятним носієм собів, крім інших, належать пряма ін'єкція у кородля забезпечення стерильних розчинів або сунарні артеріальні судини для візуалізації коронарспензій для введення шляхом ін'єкції. Зокрема, них тромбів, у сонну артерію для візуалізації композиції для ін'єкцій можуть бути одержані у тромбів у судинах мозку, або у ножну вену для традиційних формах, або як рідкі розчини або сувізуалізації тромбозу глибокої вени ноги. спензії, або у твердих формах, придатних для розТак само, спосіб доставления композиції даночинення або суспендування у рідині перед ін'єкціго винаходу до місця тромбу вважається таким, що єю, або як емульсії. Придатними наповнювачами охоплюється обсягом терміну "введення". Наприє, наприклад, вода, розсіл, декстроза, маніт, лакклад, представлену Формулою l сполуку, яка має тоза, лецитин, альбумін, глутамат натрію, цистеїнхелатоутворювальний засіб, приєднаний до неї, гідрохлорид або ін. Крім того, якщо потрібно, фарвводять ссавцеві з наступним введенням радіоакмацевтичні композиції для ін'єкцій можуть містити тивного атома, таким чином, утворюючи in vivо у незначну кількість нетоксичних допоміжних речомісці тромбу композиції, яка містить сполуку форвин, таких як зволожувальні засоби, рН-буферуючі мули у комплексі з радіоактивним атомом. В альагенти і т. ін. Якщо потрібно, застосовують препатернативному варіанті ссавцеві вводять композирати, що збільшують абсорбцію (наприклад, ліпоцію, яка включає сполуку формули у комплексі з соми). радіоактивним атомом. Даний винахід також охоплює діагностичні "Діагностично ефективна кількість" сполук, композиції, одержані для зберігання або введення. композицій або діагностичних композицій, застоВони додатково мають містити консерванти, стасовуваних у способах даного винаходу, як уже білізатори та барвники. Наприклад, бензоат назгадувалося, залежить від шляху введення, типу трію, сорбінову кислоту та естери рссавця, якого піддають лікуванню, та фізичних гідроксибензойної кислоти додають як консерванхарактеристик конкретного ссавця, якого піддають ти. Див. 1449. Крім того, застосовують антиоксилікуванню. Ці чинники та їх зв'язок із визначенням данти та суспендуючі агенти. цієї дози, є добре відомими спеціалістамСпособи in vivо візуалізації згідно з даним випрактикам у галузі медичної діагностики. В усяконаходом також забезпечують кілька переваг над му разі, доза для in vivо візуалізації має бути досіснуючими способами візуалізації для виявлення татньою для виявлення присутності засобів візуаабо визначення присутності, розміру, регресії або лізації у місці тромбу. Як правило, радіологічна збільшення тромбу. Зокрема, даний винахід завізуалізація вимагає, щоб доза, яка забезпечуєтьбезпечує сполуки, композиції та діагностичні комся діагностичною композицією даного винаходу, 39 75093 40 становила приблизно від 5 до 20мкКі, в оптимальсилікагелю, елююючи з 50% DCM/гексану. Фільтному варіанті - приблизно 10мкКі. Магнітнорат концентрували для одержання названої сполурезонансна томографія вимагає, щоб доза, яка ки (12,3г, 88%-й вихід) у вигляді бурої рідини. 1Н забезпечується діагностичною композицією, стаЯМР (400МГц, CDCI3) 7,65-7,63 (m, 2Η), 7,52-7,43 новила приблизно від 0,001 до 5ммоль/кг, в опти(m, 3Н), 4,30 (q, J=7,1Гц, 2 Η), 1,30 (t, J=7,1Гц, 3Η). мальному варіанті - приблизно від 0,005 до 2. 2,2-дифторо-2-фенілоцтова кислота 0,5ммоль/кг сполуки Формули l у комплексі з параPhCF2CO2Н магнітним атомом. У будь-якому разі, спеціалістам Суспензію етил 2,2-дифторо-2-фенілацетату відомо, що фактична доза залежить від розташу(6,0г, 30ммоль), одержану на попередньому етапі, вання тромбу. у 1N NaOH (36мл, 36ммоль) перемішували при Виявлення тромбу шляхом візуалізації стає навколишній температурі. Через 36 годин реакційможливим завдяки присутності радіоактивних або на суміш ставала майже гомогенною. Суміш підкипарамагнітних атомів, розташованих у такому слювали 1N НСІ (36мл) і двічі екстрагували DCM. тромбі. Екстракти комбінували, промивали Н2О, висушуРадіоактивні атоми, пов'язані з композиціями вали над Na2SO4 і концентрували для одержання та діагностичними композиціями даного винаходу, названої сполуки (3,85г, 81%-й вихід) у вигляді в оптимальному варіанті візуалізують, застосовублідо-жовтої твердої речовини, яку використовуючи засоби радіаційного виявлення, здатні вияввали без подальшого очищення. ляти гамма-випромінення, такі як гамма-камера 3. 2,2-дифторо-2-фенілацетилхлорид або інші. Як правило, у камерах візуалізації радіаPhCF2COСІ ції використовують середовище перетворення (у У колбу з 2,2-дифторо-2-фенілоцтовою кислоякому високоенергетичний гамма-промінь абсортою (0,8г, 5,06ммоль), одержаною на попередньобується, витісняючи електрон, який випромінює му етапі, в атмосфері аргону у льодяній ванні дофотон, після його повернення до орбітального давали оксалілхлорид (5мл) і реакційну суміш стану), фотоелектричні детектори, розташовані у перемішували протягом 15хв. Додавали розчин просторовій камері виявлення (для визначення диметилформаміду (DMF) (37мг, 0,506ммоль) у позиції випромінених фотонів) та схему для аналіDCM (0,5мл). Через 2 години льодяну ванну видазу фотонів, виявлених у камері, та створення золяли і суміш продовжували перемішувати протябраження. гом 1 години. Розчинники випарювали, додавали Парамагнітні атоми, пов'язані з композиціями DCM, a потім випарювали in vacuo, одержуючи та діагностичними композиціями даного винаходу, названу сполуку (0,88г, 98%-й вихід), яку відразу виявляють у системах магнітно-резонансної томовикористовували без подальшого очищення. графії (MRl). У таких системах застосовують силь4. 2-(2,3-дифторо-6-нітрофеніл)оцтова кислота не магнітне поле для регулювання вектора момен[Yokomoto, M., W., et al., 1991, ЕР 0470578 A1]. ту ядра атомів в організмі пацієнта. Поле порушують присутністю парамагнітних атомів, розташованих у тромбі, і зображення пацієнта зчитують коли ядра повертаються у позицію рівноваги. Нижчеподані приклади пояснюють спосіб та композиції даного винаходу, не обмежуючи його обсягу, інші придатні модифікації та адаптації різних умов та параметрів, які зазвичай трапляються До суспензії NaH (11,3г, 60% олійна дисперсія, і є очевидними для спеціалістів, охоплюються сут282ммоль) у тетрагідрофурані (THF) (35мл) у льоністю та обсягом винаходу. дяній ванні додавали розчин діетилмалонату Приклади (45,2г, 42,9мл, 282ммоль) у THF (70мл) протягом Приклад 1 періоду однієї години таким чином, щоб темпераТрифтороацетатна сіль N-[2тура реакції підтримувалася на рівні, нижчому за (амідиноамінооксі)етил]-2-{3-[(2,2-дифторо-220°С. Під час додавання осаджувалася певна кільфенілетил)аміно]-6-хлоро-2кість білої твердої речовини. До вищезгаданої реафторофеніл}ацетаміду кційної суміші додавали розчин 1,2,3-трифторо-4 1. Етил 2,2-дифторо-2-фенілацетат [MiddІeton, W., et al., J. Оrg. Сhem. 42:2883(1980)]. PhCF2CO2Et Суміш етилбензоїлформату (12,5г, 70,0ммоль) та трифториду (діетиламіно)сірки (DAST, 18,5мл, 140ммоль) перемішували протягом 48 годин при навколишній температурі, а потім виливали на лід. Утворену олію захоплювали у дихлорометан (DCM), промивали Н2О, висушували над Na2SO4, концентрували і фільтрували крізь коротку колонку нітробензолу (25,0г, 141ммоль) у THF (35мл) протягом періоду 1 години таким чином, щоб температура реакції підтримувалася на рівні, нижчому за 10°С. Льодяну ванну видаляли і суміш перемішували при навколишній температурі протягом 2 годин. До реакційного розчину додавали оцтову кислоту (18мл) і THF випарювали в умовах зниженого тиску. Додавали хлороформ (200мл), Н2О (250мл) та концентровану НСІ (18мл). Органічний шар відокремлювали, концентрували, змішували з 4N НС) (45мл) та оцтовою кислотою (35мл) і нагрівали з дефлегмацією протягом 14 годин. Реакційній суміші давали охолонути до кімнатної температури. Тверду речовину, осаджену після охолодження, відфільтровували, промивали діізопропіловим етером і розчиняли у МеОН (70мл). 41 75093 42 Після обробки активованим вугіллям розчинник J=5,3Гц, 1Η), 1,46 (s, 9Η). випарювали, кристалічний залишок промивали 7. 2-(3-аміно-2-фторо-6-нітрофеніл)етанол ізопропіловим етером і відфільтровували для оде[Yokomoto, M, W., et al., EP 0470578 A1 (1991)]. ржання названої сполуки (17,6г, 58%-й вихід) у вигляді білої твердої речовини. 1Н-ЯМР (400МГц, CDCI3) 8,05-8,01 (m, 1H), 7,47 (dd, J=17,4, 8,9Гц, 1H), 4,10 (s, 2H). 5. 2-(2,3-дифторо-6-нітрофеніл)етанол [Yokomoto, M, W., et al., ЕР 0470578 А1 (1991)]. До суміші NaBH4 (3,60г, 95,4ммоль) у THF (12мл), охолодженої до температури, нижчої за 10°С, додавали розчин 2-(2,3-дифторо-6нітрофеніл)оцтової кислоти (10,9г, 50,2ммоль), одержаної на попередньому етапі, у THF (4мл) протягом періоду 1 години. До цієї суміші додавали розчин комплексу діетилетерату трифтористого бору (16,5мл, 131ммоль) у THF (24мл) протягом періоду 1 години, підтримуючи температуру реакції на рівні, нижчому за 10°С. Після додавання реакційну суміш продовжували перемішувати на льоді протягом 15 хвилин, а потім при навколишній температурі протягом 20 хвилин. До суміші DCM (180мл) та Н2О (140мл) додавали NaНСО3 (15г, 179ммоль). Реакційну суміш повільно додавали до вищевказаного розчину NaНСО3 і перемішували до наступного дня. Органічний шар відокремлювали, висушували над Na2SO4 і концентрували для одержання названої сполуки (10,1г, 99%-й вихід) у вигляді світло-бурої олії. 1Н ЯМР (400МГц, CDCI3) 7,82 (dd, J=9,1, 4,4Гц, 1H), 7,27-7,18 (m, 1H), 3,95 (t, J=6,3Гц, 2H), 3,30-3,27 (m, 2H), 1,82 (s, 1Η). 6 2-{3-[(трет-бутил)амiнo]-2-фторо-6нітрофеніл}етанол [Yokomoto, Μ, W., et al., ЕР 0470578 A1 (1991)]. Суміш 2-(2,3-дифторо-6-нітрофеніл)етанолу (6,00г, 29,6ммоль), одержаного на попередньому етапі, трет-бутиламіну (18,6мл, 1,77ммоль), DMSO (30мл) та толуолу (5мл) нагрівали з дефлегмацією протягом 16 годин. Після охолодження до навколишньої температури бурий розчин виливали у Н2О (300мл) і осаджені жовті кристали фільтрували і двічі промивали Н2О. Жовту тверду речовину розчиняли у СНCI3 (70мл), висушували над Na2SO4, концентрували і кристалізували з гексану для одержання названої сполуки (4,70г, 62%-й вихід) у вигляді жовтої твердої речовини. 1Н ЯМР (400МГц, CDCI3) 7,92 (dd, J=9,3, 1,5Гц, 1 Η), 6,79 (t, J=8,7Гц, 1Η), 4,69 (br s, 1Η), 3,96 (dd, J=11,4, 5,9Гц, 2 Η), 3,32 (dt, J=6,5, 3,1Гц, 2Η), 1,75 (t, Розчин 2-{3-[(трет-бутил)аміно]-2-фторо-6нітрофеніл}етанолу (3,9г, 15ммоль), одержаного на попередньому етапі, у концентрованій НСI (40мл) нагрівали з дефлегмацією протягом 2 годин. Після охолодження до кімнатної температури суміш екстрагували етилацетатом (6 50мл). Екстракти комбінували, промивали насиченим NaНСО3 (двічі) та розсолом, висушували над Na2SO4 і концентрували для одержання необробленого продукту у вигляді твердої речовини. Цю тверду речовину розтирали у гексані, фільтрували і висушували у високому вакуумі для одержання названої сполуки (2,8г, 93%-й вихід) у вигляді жовтої твердої речовини. 1Н-ЯМР (400МГц, CD3OD) 7,80 (dd, J=9,1, 1,5Гц, 1H), 6,70 (t, J=9,0Гц, 1H), 3,77 (t, J=7,1Гц, 2Н), 3,26 (dt, J=7,3, 2,8Гц, 2Н). 8. 2-(3-амiно-2-фторо-6-нітрофеніл)етилацетат До розчину DBBA (1,80мл, 10,6ммоль) та 2-(3аміно-2-фторо-6-нітрофеніл)етанолу (0,88г, 4,40ммоль), одержаного на попередньому етапі, у THF (10мл) у льодяній ванні додавали розчин ацетилхлориду (319мкл, 4,49ммоль) у THF (5мл). Після перемішування протягом 1,5год. льодяну ванну видаляли і суміш продовжували перемішувати при навколишній температурі до наступного дня. Ще додавали ацетилхлорид (63мкл, 0,88ммоль) і суміш перемішували ще 16 годин. Розчинники видаляли і суміш розподіляли між DCM та Н2О. Органічний шар відокремлювали і водний шар повторно екстрагували DCM. Органічні шари комбінували, промивали Н2О (двічі), висушували над Na2SO4, концентрували і піддавали флеш-хроматографії на силікагелі, елююючи з EtOAc/DCM (0, 1, 2 та 5%) для одержання названої сполуки (0,73г, 69%-й вихід) у вигляді жовтої твердої речовини. 1Н-ЯМР (400МГц, CDCI3) 7,85 (dd, J=9,0, 1,5Гц, 1Н), 6,68 (t, J=8,9Гц, 1Н), 4,38-4,35 (m, 4H), 3,38 (dt, J=6,6, 2,8Гц, 2H), 2,03 (s, 3Н). 9. 2-[3-(2,2-дифторо-2-фенілацетиламіно)-2фторо-6-нітрофеніл]етилацетат 43 До розчину DIEA (1,49мл, 8,55ммоль) та 2-(3аміно-2-фторо-6-нітрофеніл)етилацетату (690мг, 2,85ммоль), одержаного на попередньому етапі, у DCM (6мл) додавали розчин 2,2-дифторо-2фенілацетилхлориду (0,99г, 5,20ммоль), одержаного згідно з процедурою етапу 3 Прикладу 1, у DCM (3мл). Після перемішування протягом 24 годин суміш концентрували і розподіляли між DCM та Н2О. Органічний шар відокремлювали і водний шар екстрагували DCM. Органічні шари комбінували, промивали Н2О та розсолом, висушували над Na2SO4, концентрували і піддавали флешхроматографії на силікагелі, елююючи з EtOAc/DCM (0, 2,5 та 5% ) для одержання названої сполуки (1,04г, 92%-й вихід) у вигляді оранжевої олії. 1Н-ЯМР (400МГц, CDCI3) 8,49-8,43 (m, 2H), 7,87 (d, J=9,2Гц, 1H), 6,68 (d, J=7,1Гц, 2H), 7,557,49 (m, 3Н), 4,35 (t, J=6,4Гц, 2H), 3,37 (dt, J=6,3, 2,3Гц, 2Η), 2,01 (s, 3Н). 10. 2-[2-амiно-5-(2,2-дифторо-2фенілацетиламіно)-6-фторофенил]етилацетат Суміш 2-[3-(2,2-дифторо-2-фенілацетиламіно)2-фторо-6-нітрофеніл] етилацетату (0,84г, 2,12ммоль), одержаного на попередньому етапі, та паладієвого каталізатора (226мг, 10% на активованому вугіллі, 0,212ммоль) в етанолі (17мл) гідрогенізували під водневим балоном протягом 3,5 години. Суміш фільтрували крізь целіт (інфузорна земля) і промивали МеОН. Фільтрат та промиї комбінували, концентрували і піддавали флешхроматографії на силікагелі, елююючи з EtOAc/DCM (5, 10 та 20%) для одержання названої сполуки (0,713г, 92%-й вихід) у вигляді білої твердої речовини. 1Н-ЯМР (400МГц, CDCI3) 8,10 (bs, 1H), 7,81 (t, J=8,7Гц, 1H), 7,68-7,66 (m, 2H), 7,527,44 (m, 3Н), 6,45 (dd, J=8,8, 1,2Гц, 1H), 4,18 (t, J=7,4Гц, 2H), 4,07 (bs, 2H), 2,90 (dt, J=7,4, 1,9Гц, 2Н), 2,07 (s, 3Н). Мас-спектр (LCMS, ESІ) розрах. для C18H18F3N2O3 (M+H): 367,1. Виявлено: 367,1. 11. N-[4-амiно-2-фторо-3-(2гідроксіетил)феніл]-2,2-дифторо-2-фенілацетамід 75093 44 До розчину 2-[2-аміно-5-(2,2-дифторо-2фенілацетиламіно)-6-фторофеніл]етилацетату (0,67г, 1,84ммоль), одержаного на попередньому етапі, у МеОН (19мл) по краплях додавали розчин К2СО3 (280мг, 2,03ммоль) у Н2О (4,8мл). Суміш перемішували протягом 45 хвилин, а потім нейтралізували 1N НСІ. МеОН випарювали і суміш двічі екстрагували EtOAc. Екстракти комбінували, промивали Н2О, висушували над Na2SO4 і концентрували для одержання названої сполуки (0,55г, 92%-й вихід) у вигляді блідо-жовтої твердої речовини. 1Н-ЯМР (400МГц, CD3OD) 7,70-7,68 (m, 2Н), 7,54-7,48 (m, 3Н), 7,01 (t, J = 8,5Гц, 1Н), 6,53 (dd, J=8,6, 1,3Гц, 1Н), 3,70 (t, J=6,7Гц, 2Н), 2,80 (dt, J=6,7, 2,0Гц, 2Η). Мас-спектр (LCMS, ESІ) розрах. для C16H16F3N2O2 (M+H): 325,1. Виявлено: 325,3. 12. N-[4-хлоро-2-фторо-3-(2гідроксіетил)феніл]-2,2-дифторо-2-фенілацетамід [Yokomoto, Μ, W., et al., 1991, ЕР 0470578 А1]. Суспензію N-[4-аміно-2-фторо-3-(2гідроксіетил)феніл]-2,2-дифторо-2-фенілацетаміду (1,63г, 5,00ммоль), одержаного згідно з процедурою попереднього етапу, у 6N НСІ (9мл) охолоджували у льодяній ванні, а потім протягом періоду 5 хвилин додавали розчин NaNO2 (434мг, 6,30ммоль) у Н2О (2,4мл). Через 30 хвилин додавали оцтову кислоту (2,9мл) та концентровану HCІ (2,9мл) і реакційну суміш перемішували протягом 1 години. До цієї суміші додавали розчин СuСl (848мг, 8,55ммоль) у концентрованій НСl (5мл) протягом періоду 20 хвилин. Після перемішування у льодяній ванні протягом 3 годин реакційну суміш екстрагували EtOAc (200мл х 3). Екстракти комбінували, промивали Н2О (двічі) та розсолом, висушували над Na2SO4, концентрували і піддавали флеш-хроматографії на силікагелі, елююючи з EtOAc/DCM (0, 2,5 та 5%) для одержання названої сполуки (0,845г, 48%-й вихід) у вигляді блідооранжевої олії. 1Н-ЯМР (400МГц, CDCI3) 8,31 (s, 1H), 8,14 (t, J=8,6Гц, 1Н), 7,68-7,66 (m, 2H), 7,547,46 (m, 3Н), 7,19 (dd, J=8,9, 1,7Гц, 1H), 3,86 (dd, J=12,6, 6,5Гц, 2H), 3,09 (dt, J=6,7, 2,3Гц, 2Н), 1,58 (t, J=5,7Гц, 1Н). Мас-спектр (LCMS, ESI) розрах. для C16H14CIF3NO2 (M+H): 344,1. Виявлено: 344,2. 13. 2-{3-[(2,2-дифторо-2-фенілетил)аміно]-6хлоро-2-фторофеніл}етанол До розчину N-[4-хлоро-2-фтор-3-(2гідроксіетил)феніл]-2,2-дифторо-2-фенілацетаміду (1,05г, 3,06ммоль), одержаного згідно з процедурою попереднього етапу, у THF (12мл) при 0°С в 45 75093 46 атмосфері аргону додавали розчин комплексу бохроматографії на силікагелі, елююючи з ран-THF у THF (12,3мл, 12,3ммоль, 1,0М) протяMeOH/DCM (0, 2 та 4%) для одержання названої гом періоду 10 хвилин і реакційну суміш продовсполуки (0,77г, 51%-й вихід) у вигляді блідо-бурої жували перемішувати до зникнення льодяної твердої речовини. 1Н-ЯМР (400МГц, CD3OD) ванни. Реакційну суміш нагрівали з дефлегмацією 7,53-7,51 (m, 2H), 7,44-7,41 (m, 3Н), 6,93 (dd, J=8,9, протягом 20 годин і залишали охолоджуватися до 1,8Гц, 1H), 6,62 (t, J=9,1Гц, 1H); 3,80 (t, J=13,7Гц, кімнатної температури. Додавали розчин К2СО3 2Н), 3,74 (d, J=2,2Гц, 2H). Мас-спектр (LCMS, ESl) (1,7г, 12ммоль) у Н2О (12мл), THF видаляли in розрах. для C16H14OF3NO2 (М+Н): 344,1. Виявлено: vacuo і суміш екстрагували DCM (тричі). Екстракти 344,4. комбінували, промивали розсолом, висушували 16. Трет-бутил 2-аза-3-{[2-(2-{3-[(2,2-дифторонад Na2SO4, концентрували і піддавали флеш2-фенілетил)аміно]-6-хлоро-2-фторофеніл}ацетил хроматографії на силікагелі, елююючи з аміно)eтокси]аміно}-3-{(третEtOAc/DCM (0 та 2,5%) для одержання названої бутокси)карбоніломаміно]проп-2-енат сполуки (815мг, 81%-й вихід) у вигляді безбарвної олії. 1Н-ЯМР (400МГц, CDCI3) 7,52-7,43 (m, 5H), 6,97 (dd, J=8,8, 1,7Гц, 1H), 6,51 (t, J=8,9Гц, 1H), 4,17 (bs, 1H), 3,83 (t, J=6,9Гц, 2Н), 3,74 (dt, J=13,4, 6,6Гц, 2Н), 3,04 (dt, J=6,9, 2,4Гц, 2Н), 1,43 (s, 1H). Мас-спектр (LCMS, ESl) розрах. для C16H16ClF3NO (M+H): 330,1. Виявлено: 330,3. 14. 2-{3-[(2,2-дифторо-2-фенілетил)аміно]-6До розчину 2-{3-[(2,2-дифторо-2хлоро-2-фторофеніл}етанал фенілетил)аміно]-6-хлоро-2-фторофеніл}оцтової кислоти (28мг, 82мкмоль), одержаної на попередньому етапі, у DMF (0,3мл) у льодяній ванні додавали DMF (58мг, 130мкмсль), сіль з НСI [Ν,Ν'ди(трет-бутоксикарбоніл)]-2-аміноетоксигуанідину (36мг, 102ммоль) [Tianbao Lu, et al., WO 99/26926 (1999)], та розчин DІEA (42мг, 33мкмоль) у DMF (0,1мл). Після зникнення льодяної ванни реакційну суміш продовжували перемішувати при навколишДо розчину DMSO (1,03мл, 14,5ммоль), DIΕΑ ній температурі до наступного дня. Розчинники (1,99мл, 11,4ммоль) та 2-{3-[(2,2-дифторо-2випарювали і одержаний в результаті залишок фенілетил)аміно]-6-хлоро-2-фторофеніл}етанолу розподіляли між насиченим NaHCО3 та DCM. Вод(1,45г, 4,4ммоль), одержаного згідно з процедурою ну фазу екстрагували DCM і органічні шари комбіпопереднього етапу, у DCM (140мл) у льодяній нували, промивали 10% КHSO4, Н2О та розсолом, ванні додавали піридиновий комплекс триоксиду висушували над Na2SO4, концентрували і піддавасірки (1,82г, 11,4ммоль) і перемішували при такій ли флеш-хроматографії на силікагелі, елююючи з самій температурі протягом 3,5 години. Суміш роMeOH/DCM (1%) для одержання названої сполуки зводили DCM (300мл), промивали 10% лимонною (44мг, 83%-й вихід) у вигляді безбарвної олії. 1Нкислотою (тричі), Н2О та розсолом, висушували ЯМР (400МГц, CDCI3) 7,54-7,50 (m, 2H), 7,45-7,42 над Na2SO4 і концентрували для одержання на(m, 3Н), 6,93 (dd, J=8,8, 1,7Гц, 1H), 6,63 (t, J=9,0Гц, званої сполуки (1,43г, 99%-й вихід) у вигляді оран1H), 4,03 (t, J=4,8Гц, 2Н), 3,81 (t, J=13,7Гц, 2H), жевої олії, яку використовували без подальшого 3,71 (d, J=1,9Гц, 2H), 3,47 (t, J=5,1Гц, 2H), 1,50 (s, очищення. 9H), 1,48 (s, 9H). Мас-спектр (LCMS, ESІ) розрах. 15. 2-{3-[(2,2-дифторо-2-фенілетил)аміно-6для C29H38OF3N5O6 (M+H): 644,2. Виявлено: 644,1. хлоро-2-фторофеніл}оцтова кислота [DatcanaІe, 17. Трифтороацетатна сіль N-[2Ε., et al., J. Org. Chem., 57:567 (1986)]. (амідиноамінооксі)етил]-2-{3-[(2,2-дифторо-2фенілетил)аміно]-3-хлоро-2фторофеніл}ацетаміду Розчин хлориту натрію (692мг, 6,11ммоль) у Н2О (6,1мл) додавали протягом періоду 30 хвилин до перемішуваної суміші 2-{3-[(2,2-дифторо-2фенілетил)аміно]-6-хлоро-2-фторофеніл}етаналу (1,43г, 4,37ммоль), одержаного на попередньому етапі, у DMSO (4,5мл) та NaH2PO4 (141мг, 1,18ммоль) у Н2О (1,7мл). Після додавання суміш перемішували при навколишній температурі до наступного дня, підкислювали 10Μ НСI до pH 1 і екстрагували DCM (тричі). Екстракти комбінували, промивали Н2О та розсолом, висушували над Na2SO4 і концентрували in vaсuо. Одержаний в результаті залишок піддавали флеш Розчин трет-бутил 2-аза-3-{[2-(2-{3-[(2,2дифторо-2-фенілетил)аміно]-6-хлоро-2фторофеніл}ацетиламіно)етокси]аміно}-3-[(третбутокси)карбоніломаміно]проп-2-еноату (44мг, 68мкмоль), одержаного на попередньому етапі, у TFA/DCM (2мл, 2/3) перемішували при кімнатній температурі протягом 4 годин. Розчинники випарювали і одержаний в результаті залишок піддавали флеш-хроматографії на силікагелі, елююючи з 0,05% TFA у MeOH/DCM (5 та 10%) для одер 47 75093 48 жання названої сполуки (37мг, 98%-й вихід) у випіридил)}метил)ацетамідом (770мг, 1,37ммоль), гляді білої твердої речовини. 1Н-ЯМР (400МГц, одержаним на попередньому етапі, додавали розчин НСI у 1,4-діоксані (5мл, 20ммоль, 4,0М). Після CD3OD) 7,67-7,52 (m, 2H), 7,47-7,42 (m, 3Н), 6,96 перемішування при навколишній температурі про(dd, J=8,9, 1,7Гц, 1Н), 6,66 (t, J=9,1Гц, 1Н), 3,93 (t, тягом 1,5год. осаджувалася певна кількість тверJ=5,4Гц, 2H), 3,82 (t, J=13,8Гц, 2H), 3,71 (d, дої речовини. Для розчинення цієї твердої речовиJ=2,0Гц, 2H), 3,50 (t, J=5,4Гц, 2Н). Мас-спектр ни додавали розчин МеОН (1мл) у DCM (3мл) і (LCMS, ESІ) розрах. для C19H22CІF3N5O2 (М+Н): суміш перемішували ще 4 години. Розчинники ви444,1. Виявлено: 444,2. даляли і одержаний в результаті залишок промиПриклад 2 вали DCM (5мл x 2), етером (8мл x 2) і висушували Гідрохлорид N-[(6-амiно-2-метил(3у високому вакуумі для одержання названої сполупіридил))метил]-2-{3-[(2,2-дифторо-2ки (620мг, 91%-й вихід) у вигляді блідо-бурої тверфенілетил)аміно]-6-хлоро-2дої речовини. 1Н-ЯМР (400МГц, CD3OD) 7,81 (d, фторофеніл}ацетаміду J=9,1Гц, 1H), 7,54-7,51 (m, 2H), 7,45-7,42 (m, 3Н), 6,94 (dd, J=8,9, 1,6Гц, 1H), 6,80 (d, J=9,1Гц, 1H), 6,65 (t, J=9,1Гц, 1H), 4,25 (s, 2H), 3,81 (t, J=13,8Гц, 2Н), 3,70 (d, J=1,8Гц, 2Н), 2,50 (s, 3Н). Мас-спектр (LCMS, ESl) розрах. для С23Н23СIF3N4О (М+Н): 463,1. Виявлено: 463,7. Приклад 3 1. 2-{3-[(2,2-дифторо-2-фенілетил)аміно]-6Гідрохлорид N-[(6-аміно-2,4-диметил(3хлоро-2-фторофеніл}-N-({6-[(третпіридил))метил]-2-{3-[(2,2-дифторо-2бутокси)карбоніломаміно}-2-метил(3фенілетил)аміно]-6-хлоро-2піридил)}метил)ацетамід фторофеніл}ацетаміду До розчину 2-{3-[(2,2-дифторо-2фенілетил)аміно]-6-хлоро-2-фторофеніл} оцтової кислоти (516мг, 1,5ммоль), одержаної на етапі 15 Прикладу 1, у DMF (8,0мл) додавали N-[5(амінометил)-6-метил(2-піридил)](третбутокси)карбоксамід (498мг, 2,1ммоль) [Sanderson, P.E., et al., WO 97/01338 (1997)), BOP (1,06г, 2,4ммоль) та DІEA (0,78мл, 4,5ммоль). Після перемішування протягом 18 годин ще додавали амін (107мг, 450мкмоль) і суміш продовжували перемішувати протягом 18 годин. Розчинники випарювали і реакційну суміш розподіляли між DCM та насиченим NаНСО3. Органічний шар відокремлювали і водний шар екстрагували DCM. Органічні шари комбінували, промивали 10% КHSO4 (двічі), Н2О та розсолом, висушували над Na2SO4, концентрували і піддавали флешхроматографії на силікагелі, елююючи з MeOH/DCM (0, 1,5 та 2,5%) для одержання названої сполуки (770мг, 91%-й вихід) у вигляді блідобурої піни. 1Н-ЯМР (400МГц, CDCI3) 7,66 (d, J=8,4Гц, 1H), 7,51-7,41 (m, 6H), 7,23 (bs, 1H), 7,01 (dd, J=8,8, 1,5Гц, 1H), 6,57 (t, J=9,0Гц, 1H), 5,64 (br s, 1H), 4,37 (d, J=5,6Гц, 2H), 4,26-4,22 (m, 1H), 3,793,70 (m, 4H), 2,35 (s, 3H), 1,50 (s, 9H). Мас-спектр (LCMS, ESІ) розрах. для С28Н31СIF3N4О3 (М+Н): 563,2. Виявлено: 562,9. 2. Гідрохлорид N-[(6-аміно-2-метил(3піридил))метил]-2-{3-[(2,2-дифторо-2фенілетил)аміно]-6-хлоро-2фторофеніл}ацетаміду У колбу з 2-{3-[(2,2-дифторо-2фенілетил)аміно]-6-хлоро-2-фторофеніл}rN-({6[(трет-бутокси)карбоніломаміно]-2-метил(3 1. 2-{3-[(2,2-дифторо-2-фенілетил)аміно]-6хлоро-2-фторофеніл}-N-({6-[(третбутокси)карбоніломаміно]-2,4-диметил(3піридил)}метил)ацетаміду До розчину 2-{3-[(2,2-дифторо-2фенілетил)аміно]-6-хлоро-2-фторофеніл}оцтової кислоти (25мг, 73мкмоль), одержаної на етапі 15 Прикладу 1, у DMF (0,25мл) додавали ВОР (52мг, 116мкмоль), розчин DІEA (38мг, 295моль) у DMF (0,1мл) та N-[5-(амінометил)-4,6-диметил(2піридил)](трет-бутокси)карбоксамід (23мг, 91ммоль) [Sanderson, P. E., et al., WO 97/01338 (1997)]. Після перемішування при навколишній температурі протягом 2 днів ще додавали амін (7мг, 28мкмоль), ВОР (16мг, 36мкмоль) та DIΕΑ (9мг, 70мкмоль) і суміш перемішували ще 16 годин. Розчинники випарювали і одержаний в результаті залишок розподіляли між насиченим NaНСО3 та DСМ. Органічний шар відокремлювали і водний шар екстрагували DCM. Органічні шари комбінували, промивали 10% лимонною кислотою, Н2О та розсолом, висушували над Na2SO4, концентрували і піддавали флеш-хроматографії на силікагелі, елююючи з MeOH/DCM (0, 1, 2%) для одержання названої сполуки (18,5мг, 44%-й вихід) у вигляді блідо-бурої твердої речовини. 1Н-ЯМР 49 75093 50 20°С, потім додавали до розчину діетилоксалату (400МГц, CDCI3) 7,58 (s, 1H), 7,50-7,41 (m, 5H), (29,2г, 200ммоль) у THF (40мл) при -78°С. Після 7,24 (s, 1H), 6,98 (dd, J=8,8, 1,1Гц, 1Н), 6,55 (t, повільного нагрівання до кімнатної температури J=9,0Гц, 1H), 5,33 (bs, 1H), 4,40 (d, J=4,7Гц, 2H), додавали EtOAc (100мл), 10% HCІ (50мл) та воду 4,24-4,20 (m, 1H), 3,78-3,70 (m, 4H), 2,39 (s, 3Н), (50мл) і фази відокремлювали. Водний шар екст2,28 (s, 3Н), 1,50 (s, 9H). Мас-спектр (LCMS, ESI) розрах. для С29Н33СIF3N4О3 (М+Н): 577,0. Виявлерагували EtOAc (2 100мл), органічні шари комбіно: 577,1. нували, промивали розсолом (50мл) і висушували 2. Гідрохлорид N-[(6-амiно-2,4-диметил(3над Na2SO4. Після випарювання розчинника та піридил))метил]-2-{3-[(2,2-дифторо-2надлишку діетилоксалат у високому вакуумі залифенілетил)аміно]-6-хлоро-2шок очищали шляхом колонкової флешфторофеніл}ацетаміду хроматографії (1:1 DСМ:гексан) для одержання названої сполуки (9,4г, 76%-й вихід) у вигляді білої твердої речовини. 1Н-ЯМР (400МГц, CDCI3) (9,13 (d, J=8,6Гц, 1H), 8,20 (d, J=8,4Гц, 1H), 8,01 (dd, J=8,2, 5,4Гц, 1Н), 7,76 (t, J=7,2Гц, 1Н), 7,67 (t, J=8,1Гц, 1Н), 7,21 (t, J=8,5Гц, 1Н), 4,49 (q, J=7,1Гц, 2Н), 1,45 (t, J=7,1Гц, 3Н). 2. Етил 2,2-дифторо-2-(4-фторонафтил)ацетат Розчин НСІ у 1,4-діоксан (4,0Μ, 0,5мл, 2ммоль) додавали до 2-{3-[(2,2-дифторо-2фенілетил)аміно]-6-хлоро-2-фторофеніл}-N-({6[(трет-бутокси)карбоніломаміно]-2,4-диметил(3піридил)}метил)ацетаміду (18,5мг, 32мкмоль), одержаного на попередньому етапі. Після перемішування при навколишній температурі протягом 3 годин осаджувалася тверда речовина. Для розчинення цієї твердої речовини додавали розчин МеОН (0,1мл) у DCM (1мл). Після перемішування протягом додаткових 2 годин реакційну суміш концентрували для одержання бурої твердої речовини, яку промивали етером та DCM і висушували in vaсuо для одержання названої сполуки (12,6мг, 77%-й вихід) у вигляді блідо-бурої твердої речовини. 1Н-ЯМР (400МГц, CD3OD) 8,40 (bs, 1H), 7,537,51 (m, 2Н), 7,47-7,40 (m, 3Н), 6,93 (dd, J=8,8, 1,3Гц, 1Н), 6,68 (s, 1H), 6,64 (t, J=9,1Гц, 1H), 4,31 (d, J=4,6Гц, 2H), 3,81 (t, J=13,8Гц, 2 Η), 3,67 (d, J=1,2Гц, 2H), 2,54 (s, 3Н), 2,42 (s, 3Н). Мас-спектр (LCMS, ESІ) розрах. для С24Н25СIF3N4О (M+H): 477,2. Виявлено: 477,5. Приклад 4 Трифтороацетат N-[2-(амідиноамінооксі)етил]2-(3-{[2,2-бифторо-2-(4-фторонафтил)етил]аміно}6-хлоро-2-фторофеніл)ацетаміду 1. Етил 2-(4-фторонафтил)-2-оксоацетат Розчин n-бутиллітію (2,5Μ у THF, 20мл, 50ммоль) охолоджували до -78°С, повільно додавали розчин 1-бромо-4-фторонафталіну (11,25г, 50ммоль) у THF (40мл) і суміш перемішували протягом 1 години. Реакційну суміш нагрівали до До розчину етил 2-(4-фторонафтил)-2оксоацетату (9,4г, 38,2ммоль), одержаного на попередньому етапі, у DCM (60мл) додавали DAST (16,1г, 100ммоль). Суміш перемішували при кімнатній температурі до наступного дня, повільно виливали на лід і екстрагували DCM (3 50мл). Органічні шари комбінували, промивали розсолом і висушували над Na2SO4. Після випарювання розчинника залишок очищали шляхом колонкової флеш-хроматографії (1:1 DСМ:гексан) для одержання названої сполуки (9,7г, 95%-й вихід) у вигляді світло-бурої олії. 1Н-ЯМР (400МГц, CDCI3) 8,20 (m, 2H), 7,82 (dd, J=8,2, 5,3Гц, 1H), 7,63 (m, 2H), 7,20 (t, J=8,4Гц, 1H), 4,28 (q, J=7,1Гц, 2H), 1,24 (t, J=7,1Гц, 3Н). 3. 2,2-дифторо-2-(4-фторонафтил)оцтова кислота До розчину етил 2,2-дифторо-2-(4фторонафтил)ацетату (9,6г, 35,8ммоль), одержаного на попередньому етапі, у метанолі (20мл) та THF (20мл) додавали розчин NaOH (2,0г, 50ммоль) у воді (40мл). Реакційну суміш перемішували при кімнатній температурі протягом 2 годин. Після випарювання метанолу та THF in vaсuо водну фазу підкислювали до pH 2, використовуючи 10% НСІ, і екстрагували DCM (3 50мл). Екстракти комбінували, промивали розсолом, висушували над Na2SO4 і концентрували для одержання названої сполуки (8,1г, 94%-й вихід) у вигляді білуватої твердої речовини. 1Н-ЯМР (400МГц, CDCI3) 9,68 (br s, 1H), 8,18 (m, 2H), 7,83 (dd, J=8,1, 5,3Гц, 1Н), 7,62 (m, 2H), 7,19 (t, J=8,3Гц, 1H). 51 75093 4. 2-{3-[2,2-дифторо-2-(4фторонафтил)ацетиламіно]-2-фторо-6нітрофеніл}етилацетат До розчину DlEA (7,8мл) та 2-(3-аміно-2фторо-6-нітрофеніл)етилацетату (4,6г, 19ммоль), одержаного на етапі 8 Прикладу 1, у DCM (60мл) додавали 2,2-дифторо-2-(4фторонафтил)ацетилхлорид (одержаний шляхом дефлегмації 2,2-дифторо-2-(4фторонафтил)оцтової кислоти, одержаної на попередньому етапі, з оксалілхлоридом) (7,8г, 30ммоль) у DCM (40мл). Суміш перемішували при кімнатній температурі протягом 1 години. Ще додавали DCM (100мл), одержану в результаті суміш промивали 10% лимонною кислотою (3 40мл) та розсолом і висушували над Na2SO4. Після випарювання розчинника залишок очищали шляхом колонкової флеш-хроматографії, елююючи з DCM для одержання названої сполуки (5,3г, 61%) у вигляді жовтої олії. 1Н-ЯМР (400МГц, CDCI3) 8,45 (m, 2H), 8,21 (d, J=7,0Гц, 2H), 7,87 (s, 1H), 7,85 (t, J=4,1Гц, 1H),7,66 (m, 2H), 7,22 (t, J=8,3Гц, 1Н), 4,34 (t, J=6,4Гц, 2Н), 3,36 (t, J=6,4Гц, 2H), 2,00 (s, 3Н). 5. 2-{2-аміно-5-[2,2-дифторо-2-(4фторонафтил)ацетиламінo]-6фторофеніл}етилацетат Суміш 2-{3-[2,2-дифторо-2-(4фторонафтил)ацетиламіно]-2-фторо-6нітрофеніл}етилацетату (4,9г, 10,5ммоль), одержаного на попередньому етапі, та Pd/C (10%, 500мг) в етанолі (50мл) та THF (50мл) перемішували в атмосфері водню протягом 5 годин. Реакційну суміш фільтрували крізь целіт і промивали THF та МеОН. Фільтрат та промиї комбінували, концентрували in vaсuо і піддавали флешхроматографії на силікагелі, елююючи з EtOAc/DCM (від 0 до 2%) для одержання названої сполуки (3,8г, 83%) у вигляді білуватої твердої речовини. 1Н-ЯМР (400МГц, CDCI3) 8,27 (d, J=8,2Гц, 1H), 8,19 (d, J=8,6Гц, 1H), 8,10 (s, 1H), 7,82 (m, 2H), 7,63 (m, 2H), 7,19 (t, J=8,6Гц, 1Н), 6,46 (d, J=8,7Гц, 1H), 4,19 (t, J=7,4Гц, 2H), 4,08 (s, 2H), 2,91(1, J=7,3Гц, 2H), 2,08 (s, 3Н). 6. N-[4-амiно-2-фторо-3-(2-гідроксіетил)феніл]2,2-дифторо-2-(4-фторонафтил)ацетамід 52 До розчину 2-{2-аміно-5-[2,2-дифторо-2-(4фторонафтил)ацетиламіно]-6фторофеніл}етилацетату (3,8г, 8,8ммоль), одержаного на попередньому етапі, у МеОН (40мл) та THF (20мл) додавали розчин К2СО3 (1,68г, 12ммоль) у воді (30мл). Суміш перемішували при кімнатній температурі протягом 3 годин. Ще додавали води (50мл) і одержану в результаті суміш екстрагували EtOAc (3 50мл). Екстракти комбінували, промивали розсолом, висушували над Na2SO4 і концентрували in vaсuо для одержання названої сполуки (3,3г, 96%) у вигляді білуватої твердої речовини. 1Н-ЯМР (400МГц, CDCI3) 8,27 (d, J=8,4Гц, 1Н), 8,19 (d, J=8,2Гц, 1Н), 8,13 (s, 1H), 7,81 (m, 2H), 7,64 (m, 2H), 7,19 (t, J=8,7Гц, 1Н), 6,47 (d, J=8,7Гц, 1Н), 4,07 (s, 2H), 3,89 (t, J=5,6Гц, 2Н), 2,85 (t, J=5,5Гц, 2H). 7. N-[4-хлоро-2-фторо-3-(2-гідроксіетил)феніл]2,2-дифторо-2-(4-фторонафтил)ацетамід [Doyle, Μ. P., et al., J. Оrg. Chem., 42:2426 (1977)]. У колбу з хлоридом міді(ll) (1,84г, 13,7ммоль) додавали розчин трет-бутилнітриту (1,46г, 12,8ммоль, 90%, Atdrich) в ацетонітрилі (35мл) в атмосфері аргону. Одержану в результаті зелену реакційну суміш охолоджували у льодяній ванні до 0°С і протягом періоду 45 хвилин додавали розчин N-[4-аміно-2-фтор-3-(2-гідроксіетил)феніл]-2,2дифторо-2-(4-фторонафтил)ацетаміду (3,58г, 9,13ммоль), одержаний згідно з процедурою попереднього етапу, в ацетонітрилі (60мл). Після перемішування протягом додаткових 6 годин при 0°С одержаній в результаті бурій суміші давали нагрітися до навколишньої температури, потім виливали у 20% водний розчин НСI (160мл) і екстрагували DCM (тричі). Екстракти комбінували, промивали 20% НСI, Н2О та розсолом, висушували над Na2SO4, концентрували і піддавали флешхроматографії на силікагелі, елююючи з EtOAc/DCM (0 та 2,5%) для одержання названої сполуки (2,1г, 56%-й вихід) у вигляді білої твердої речовини. 1Н-ЯМР (400МГц, CDCI3) 8,31 (br s, 1Η), 8,24-8,12 (m, 3H), 7,84 (dd, J=8,2, 5,3Гц, 1H). 7,68-7,60 (m, 2H), 7,22-7,20 (m, 2H), 3,87 (dd, J=12,6, 6,5Гц, 2H), 3,09 (dt, J=6,7, 2,2Гц, 2H), 1,47 (t, J=5,6Гц, 2H). Мас-спектр (LCMS, ESI) розрах. для С20Н15СIF4NО2 (M+H): 412,1. Виявлено: 412,6. 8. 2-(3-{[2,2-дифторо-2-(4фторонафтил)етил]аміно}-6-хлоро-2 53 фторофенiл)етанол До розчину N-[4-хлоро-2-фторо-3-(2гідроксіетил)феніл]-2,2-дифторо-2-(4фторонафтил)ацетаміду (1,9г, 4,6ммоль), одержаного на попередньому етапі, у THF (19мл) при 0°С по краплях додавали розчин комплексу ВН3-THF (19,4мл, 19,4ммоль, 1,0Μ у THF) протягом періоду 20 хвилин і реакційну суміш продовжували перемішувати до зникнення льодяної ванни. Суміш після цього нагрівали з дефлегмацією в олійній ванні при температурі від 75 до 80°С протягом 3 годин і продовжували перемішувати при навколишній температурі до наступного дня. Додавали розчин NaНСО3 (1,63г, 19,4ммоль) у Н2О (20мл), THF випарювали і одержану в результаті суміш двічі екстрагували DCM. Екстракти комбінували, промивали Н2О та розсолом, висушували над Na2SO4, концентрували і піддавали флешхроматографії на силікагелі, елююючи з EtOAc/DCM (0, 1, 1,5%) для одержання названої сполуки (805мг, 44%-й вихід) у вигляді білої твердої речовини. 1Н-ЯМР (400МГц, CDCI3) 8,24-8,19 (m, 2H), 7,70-7,61 (m, 3Н), 7,14 (t, J=9,3Гц, 1H), 6,90 (dd, J=8,7, 1,6Гц, 1H), 6,42 (t, J=8,9Гц, 1H), 4,224,16 (m, 1H), 4,00 (dt, J=13,4, 6,8Гц, 2Н), 3,82 (dd, J=12,1, 6,4Гц, 2Н), 3,02 (dt, J=6,8, 2,3Гц, 2Н), 1,39 (br s, 1H). Мас-спектр (LCMS, ESl) розрах. для С20Н17СIF4NО (M+H): 398,1. Виявлено: 398,3. 9. 2-(3-{[2,2-дифторо-2-(4фторонафтил)етил]аміно}-6-хлоро-2фторофеніл)етанал До розчину DMSO (470мг, 6,0ммоль), DІEA (823мкл, 4,74ммоль) та 2-(3-{[2,2-дифторо-2-(4фторонафтил)етил]аміно}-6-хлоро-2фторофеніл)етанолу (723мг, 1,82ммоль), одержаного на попередньому етапі, у DCM (55 мл) у льодяній ванні додавали піридиновий комплекс триоксиду сірки (754мг, 4,74ммоль). Після перемішування протягом 3,5 години реакційну суміш розводили DCM (110мл). Органічний шар відокремлювали і зодний шар екстрагували DCM (100мл). Органічні шари комбінували, промивали 10% лимонною кислотою (тричі), Н2О та розсолом, висушували над Na2SO4 і концентрували для одержання названої сполуки (722мг, кількісний вихід) у вигляді оранжевої олії. 1Н-ЯМР (400МГц, CDCI3) 9,69 (d, J=1,1Гц, 1H), 8,22-8,18 (m, 2H), 7,67-7,60 (m, 3Н), 7,14 (t, J=9,2Гц, 1H), 6,94 (d, J=8,8Гц, 1H), 75093 54 6,49 (t, J=8,7Гц, 1Н), 4,20 (bs, 1H), 4,00 (dt, J=13,3, 6,7Гц, 2Н), 3,83 (s, 2H). 10. 2-(3-{[2,2-дифторо-2-(4фторонафтил)етил]аміно}-6-хлоро-2фторофеніл)оцтова кислота Розчин хлориту натрію (309мг, 2,73ммоль, 80%) у Н2О (3,0мл) по краплях додавали протягом періоду 30 хвилин до перемішуваної суміші 2-(3{[2,2-дифторо-2-(4-фторонафтил)етил]аміно}-6хлоро-2-фторофеніл)етанолу (722мг, 1,82ммоль), одержаного на попередньому етапі, у DMSO (3,6мл) та NaH2PO4 (74мг, 0,55ммоль) у Н2О (0,9мл). Після додавання суміш перемішували при навколишній температурі протягом 48 годин, потім підкислювали 10Μ НСІ до pH 1 і екстрагували DCM (тричі). Екстракти комбінували, промивали Н2О та розсолом, висушували над Na2SO4 і концентрували in vaсuо. Одержаний в результаті залишок піддавали флеш-хроматографії на силікагелі, елююючи з MeOH/DCM (0, 1, 1,5 та 2%) для одержання вихідного альдегіду 2-(3-{[2,2-дифторо-2-(4фторонафтил)етил]аміно}-6-хлоро-2фторофеніл)етанал (165мг, 23%-й вихід) та названої сполуки (570мг, 76%-й вихід) у вигляді твердої речовини. 1Н-ЯМР (400МГц, CDCI3) 8,32 (d, J=8,4Гц, 1H), 8,15 (d, J=8,0Гц, 1Н), 7,71-7,61 (m, 3Н), 7,18 (dd, J=9,8, 8,5Гц, 1Н), 6,78 (dd, J=8,8, 1,5Гц, 1Н), 6,44 (t, J=9,1Гц, 1H), 4,05 (t, J=13,5Гц, 2H), 3,69 (d, J=2,1Гц, 2Н). 11. Трет-бутил 2-аза-3-({2-[2-(3-{[2,2-дифторо2-(4-фторонафтил)етил]аміно}-6-хлоро-2фторофеніл)ацетиламіно]стокси}аміно)-3-[(третбутокси)карбоніломаміно]проп-2-еноат До розчину 2-(3-{[2,2-дифторо-2-(4фторонафтил)етил]аміно}-6-хлоро-2фторофеніл)оцтової кислоти (570мг, 1,39ммоль), одержаної на попередньому етапі, у DMF (7,5мл) у льодяній ванні додавали ВОР (981мг, 2,22ммоль), сіль з НСl [N,N'-ди(трет-бутоксикарбоніл)]-2аміноетоксигуанідину (689мг, 1,94ммоль) та DIEA (0,96мл, 5,55ммоль). Після зникнення льодяної ванни суміш продовжували перемішувати при навколишній температурі до наступного дня. Ще додавали ВОР (123мг, 0,28ммоль) та сіль з HCI [Ν,Ν-ди(трет-бутоксикарбоніл)]-2аміноетоксигуанідину (98мг, 0,28ммоль) і реакційну суміш перемішували протягом 24 годин. Розчинники випарювали і одержаний в результаті залишок розподіляли між насиченим NаНСО3 та 55 75093 56 DCM. Органічний шар відокремлювали і водний шар екстрагували DCM. Органічні шари комбінували, промивали 10% КHSO4, Н2О та розсолом, висушували над Na2SO4, концентрували і піддавали флеш-хроматографії на силікагелі, елююючи з MeOH/DCM (0, 0,5 та 1%) для одержання названої До розчину 2-(3-{[2,2-дифторо-2-(4сполуки (720мг, 73%-й вихід) у вигляді білої піни. 1 фторонафтил)етил]аміно}-6-хлоро-2Н-ЯМР(400МГц, СD3ОD) 9,12 (s, 1H), 8,24-8,19 фторофеніл)оцтової кислоти (15мг, 37мкмоль), (m,2H), 7,78-7,81 (m, 1H), 7,70-7,60 (m, 4H), 7,14 одержаної згідно з процедурою етапу 10 Прикладу (dd, J=9,6, 8,4Гц, 1Н), 6,91 (dd, J=8,8, 1,6Гц, 1H), 4, у DMF (0,3мл) додавали ВОР (26мг, 58мкмоль), 6,44 (t, J=8,8Гц, 1H), 4,20-4,15 (m, 1H), 4,13-4,10 N-[5-(амінометил)-6-метил(2-піридил)](трет(m, 2H), 3,98 (dt, J=13,4, 6,7Гц, 2Н), 3,78 (d, бутокси)карбоксамід (12мг, 51мкмоль) та розчин J=1,9Гц, 2Н), 3,60 (dd, J=8,6, 4,9Гц, 2H), 1,51 (s, DlEA (19мг, 146мкмоль) у DMF (0,1мл) [Sanderson, 9H), 1,48 (s, 9H). Мас-спектр (LCMS, ESІ) розрах. P. E., et al., WO 97/01338 (1997)]. Суміш перемішудля С33Н39СIF4N5О6 (M+H): 712,2. Виявлено: 712,3. вали до наступного дня, розчинники випарювали і 12. Трифтороацетат N-[2одержану в результаті суміш розподіляли між на(амідиноамінооксі)етил]-2-(3-{[2,2-дифторо-2-(4сиченим NaНСО3 та DCM. Органічний шар відофторонафтил)етил]аміно)-6-хлоро-2кремлювали і водний шар екстрагували DCM. Орфторофеніл)ацетаміду ганічні шари комбінували, промивали 10% КHSO4, Н2О та розсолом, висушували над Na2SO4, концентрували і піддавали флеш-хроматографії на силікагелі, елююючи з MeOH/DCM (0,3, 0,6 та 1%) для одержання названої сполуки (11мг, 49%-й вихід) у вигляді білої твердої речовини. 1Н-ЯМР (400МГц, CD3OD) 8,33 (d, J=8,4Гц, 1H), 8,17-8,14 (m, 1Н), 7,72-7,61 (m, 4Н), 7,55 (d, J=8,5Гц, 1Н), 7,19 (dd, J=10,0, 8,3Гц, 1Н), 6,81 (dd, J=8,8, 1,7Гц, 1Н), 6,47 Розчин трет-бутил 2-аза-3-({2-[2-(3-{[2,2(t, J=9,1Гц, 1H), 4,32 (s, 2Н), 4,12-4,03 (m, 2Н), 3,67 дифторо-2-(4-фторонафтил)етил]аміно}-6-хлоро-2(d, J=2,0Гц, 2H), 2,40 (s, 3Н), 1,50 (s, 9H). Масфторофеніл)ацетиламіно]етокси}аміно)-3-[(третспектр (LCMS, ESІ) розрах. для С32Н32СIF4N4О3 бутокси)карбоніломаміно]проп-2-еноату (720мг, (М+Н): 631,2. Виявлено: 631,1. 1,01ммоль), одержаного на попередньому етапі, у 2. Гідрохлорид N-[(3-амiно-2-метил(3TFA/DCM (2:3,30мл) перемішували при навколишпiридил))метил]-2-(3-{[2,2-дифторо-2-(4ній температурі протягом 4 годин. Розчинники вифторонафтил)етил]амiно}-6-хлоро-2парювали і одержаний в результаті залишок підфторофенил)ацетаміду давали флеш-хроматографії на силікагелі, елююючи з 0,05% TFA у MeOH/DCM (5 та 10%) для одержання названої сполуки (626мг, 99%-й вихід) у вигляді блідо-бурої піни. 1Н-ЯМР (400МГц, CD3OD) 8,33 (d, J=8,5Гц, 1Н), 8,17-8,15 (m, 1Н), 7,73-7,63 (m, 3Н), 7,20 (dd, J=10,0, 8,3Гц, 1H), 6,82 (dd, J=8,8, 1,6Гц, 1Н), 6,92 (t, J=9,1Гц, 1Н), 4,07 (t, J=13,7Гц, 2Н), 3,92 (t, J=5,4Гц, 2H), 3,67 (d, J=1,8Гц, 2H), 3,52-3,51 (m, 2Н). Мас-спектр (LCMS, ESІ) розрах. для С23Н23СIF4N5О2 (M+H): 512,1. ВиРозчин 2-(3-{[2,2-дифторо-2-(4явлено: 512,2. фторонафтил)етил]аміно}-6-хлоро-2-фторофеніл)Приклад 5 N-({6-[(трет-бутокси)карбоніломаміно]-2-метил(3Гідрохлорид N-[(6-амiно-2-метил(3піридил)}метил) ацетаміду (10мг, 16мкмоль), одепіридил))метил]-2-(3-{[2,2-дифторо-2-(4ржаного на попередньому етапі, у HCІ (0,5мл, 4,0Μ фторонафил)етил]амiно}-6-хлоро-2у 1,4-діоксані) перемішували протягом 2 годин при фторофеніл)ацетаміду навколишній температурі. Додавали розчин MeOH/DCM (25%, 0,4мл) і суміш продовжували перемішувати до наступного дня. Розчинники випарювали і одержаний в результаті бурий залишок піддавали флеш-хроматографії на силікагелі, елююючи з MeOH/DCM (2,5, 5 та 10%) для одержання твердого продукту. Його обробляли розчином НСІ (0,01мл, 4,0Μ у 1,4-діоксані, 40мкмоль) у DCM (0,5мл), перемішували протягом 5 хвилин і 1. 2-(3-{[2,2-дифторо-2-(4розчинники випарювали для одержання названої фторонафтил)етил]амiно}-6-хлоро-2-фторофеніл)сполуки (6,2мг, 69%-й вихід) у вигляді білої твердої N-({6-[(трет-бутоксикарбоніломамімно-2-метил(3речовини. 1Н-ЯМР (400МГц, CD3OD) 8,26 (d, піридил)}метил)ацетамід J=8,4Гц, 1H), 8,17-8,14 (m, 1H), 7,80 (d, J=9,1Гц, 1H), 7,73-7,64 (m, 4H), 7,20 (dd, J=10,0, 8,3Гц, 1H), 6,82-6,79 (m, 1H), 6,49 (t, J=9,1Гц, 1H), 4,24 (s, 2H), 57 75093 58 4,10-4,02 (m, 2H), 3,66 (d, J=2,3Гц, 2H), 2,49 (s, 3Н). 1H, J=8,3Гц, 2,3Гц, 1,0Гц), 7,82 (m, 4H), 7,74 (m, Мас-спектр (LCMS, ESD розрах. для 1H), 7,53 (t, 1H, J=7,9Гц), 7,03 (br s, 1H), 4,26 (m, С27Н24СIF4N4О (M+H): 531,1. Виявлено: 531,6. 2H), 3,76 (s, 2H), 3,57 (dd, 2H, J=9,8Гц, 5,7Гц). Приклад 6 3. N-[2-N'-фталімідил)гідроксіетил]-2-(3Трифтороацетат N-[2-(гуанідинооксі)етил]-2-(3амінофеніл)ацетамід {[бензилсульфоніл]аміно}феніл)ацетаміду 1. N-(2-гідроксіетил)-2-(3-нітрофеніл)ацетамід До розчину 3-нітрофенілоцтової кислоти (3,21г, 17,7ммоль), етаноламіну (2,8г, 46ммоль) та триетиламіну (3,0мл, 22ммоль) у безводному DMF (110мл) додавали розчин бензотриазол-1-іл-окситрис-піролідино-фосфонію гексафторофосфату (РуВОР, 9,37г, 18,0ммоль) у безводному DMF (80мл). Після перемішування протягом 16 годин при навколишній температурі (в атмосфері азоту), реакційну суміш концентрували in vaсuо, розчиняли у DCM і фільтрували. Фільтрат промивали 10% водним розчином лимонної кислоти, насиченим водним NаНСО3, буфером з pH 7 та розсолом, висушували над Na2SO4 і фільтрували. Випарений фільтрат після цього очищали шляхом флешхроматографії (10% метанол у DCM), одержуючи названу сполуку (1,02г, 26%) у вигляді світложовтої твердої речовини. 1Н ЯМР (300МГц, CDCI3/CD3OD) 8,18 (m, 1Н), 8,11 (ddd, 1Н, J=8,1Гц, 2,4Гц, 1,1Гц), 7,72 (m, 1H), 7,60 (t, 1H, J=7,8Гц), 3,62 (s, 2Н), 3,44 (t, 2Н, J=5,9Гц), 3,16 (t, 2Н, J=5,9Гц). 2. N-[2-(N'-фталiмідил)гідроксіетил]-2-(3нітрофеніл)ацетамід До розчину продукту попереднього етапу (1,02г, 4,55ммоль), N-гідроксифталіміду (0,76г, 4,64ммоль) та трифенілфосфіну (1,22г, 4,65ммоль) у безводному THF (100мл) через шприц додавали діетилазадикарбоксилат (0,75мл, 4,77ммоль). Після перемішування до наступного дня при навколишній температурі (в атмосфері азоту) реакційну суміш концентрували in vaсuо і очищали шляхом флеш-хроматографії (40% етилацетату у DCM), одержуючи неочищений продукт, який розчиняли у DCM, охолоджували і фільтрували. Випарений фільтрат після цього очищали шляхом флеш-хроматографії (66%-100% етилацетату в гексані), одержуючи названу сполуку (0,86г, 51%) у вигляді білої твердої речовини. 1Н ЯМР (300МГц, CDCI3) 8,26 (t, 1H, J=1,7Гц), 8,15 (ddd, Розчин продукту попереднього етапу (0,66г, 1,80ммоль) та 10% паладію на вугіллі (15мг) у дегазованій суміші (1:1) етанолу:ТНР (40мл) перемішували в атмосфері водню при навколишній температурі. Через 6 годин реакційну суміш фільтрували крізь целіт, фільтрат випарювали і очищали шляхом флеш-хроматографії (5% метанол у DCM), одержуючи названу сполуку (0,20г, 33%) у вигляді жовтої твердої речовини. 1Н ЯМР (300МГц, CDCI3) 7,81 (m, 4Н), 7,14 (t, 1Н, J=8,0Гц), 6,72 (m, 2H), 6,61 (ddd, 1H, J=8,0Гц, 2,2Гц, 1,0Гц), 4,23 (m, 2H), 3,55 (m, 4Н). Масспектр (MALD)-TOF, матриця -ціано-4гідроксикорична кислота) розрах. для С18Н17N3О4: 362,1 (M+Na), 340,1 (М+Н). Виявлено: 362,2, 340,3. 4. N-[2-(N'-фталімідил)гідроксіетил]-2-(3{[бензилусульфоніл]-аміно}феніл)ацетамід До охолодженого до льодяної температури розчину продукту попереднього етапу (0,20г, 0,58ммоль) у безводному DCM (50мл) додавали розчин -толуолсульфонілхлориду (0,11г, 0,58ммоль) у безводному DCM (20мл) з наступним додаванням N-метилморфоліну (0,10мл, 0,91ммоль). Після перемішування протягом 16 годин при навколишній температурі ще додавали -толуолсульфонілхлорид (0,07г, 0,36ммоль) та Nметилморфолін (0,10мл, 0,91ммоль), реакційну суміш перемішували протягом додаткових 4 годин і випарювали in vaсuо. Залишок розчиняли у DCM, промивали 10% водним розчином лимонної кислоти, буфером з pH 7 та розсолом, висушували над Na2SO4, фільтрували і фільтрат випарювали, одержуючи названу сполуку (0,20г, 69%) у вигляді світло-жовто! твердої речовини. 1Н ЯМР (300МГц, CDCI3) 7,77 (m, 4H), 7,35 (m, 1H), 7,22 (s, 5H), 7,17 (m, 1H), 7,11 (m, 1H), 7,05 (s, 1H), 6,71 (br m, 1H), 4,37 (s, 2H), 4,25 (m, 2H), 3,64 (s, 2H), 3,64 (dd, 2H, J=10Гц, 5,5Гц). 5. N-[2-(амiнооксi)етил]-2-(3{[бензилсульфоніл]амiно}феніл)ацетамід 59 Продукт попереднього етапу (0,19г, 0,39ммоль) розчиняли у суміші (1:1) етанолу:ТНР (20мл) і приводили у реакцію з 40% водним розчином метиламіну (10мл) протягом 1 години при навколишній температурі. Реакційну суміш випарювали in vaсuо і очищали на колонці Waters Sep-Pak (5г силікагелю, 1:1 DСМ:етилацетат), одержуючи неочищену жовту тверду речовину. Потім її очищали шляхом препаративної тонкошарової хроматографії (10% метанол у DCM), одержуючи названу сполуку (0,10г, 72%) у вигляді білої твердої речовини. 1Н ЯМР (300МГц, CDCI3/CD3OD) 7,34 (m, 3Н), 7,28 (m, 3Н), 7,10 (m, 1Н), 7,05 (m, 2Н), 4,35 (s, 2Н), 3,69 (t, 2Н, J=5Гц), 3,51 (s, 2Н), 3,43 (t, 2Н, J=5Гц). Мас-спектр (MALDI-TOF, матриця ціано-4-гідроксикорична кислота) розрах. для C17H21N3O4S: 386,1 (M+Na). Виявлено: 386,6. 6. N-[2-({N,N'-ди[третбутоксикарбоніл]}гуанідинооксі)етил]-2-(3{[бензилсульфоніл]аміно}феніл)ацетамід Розчин продукту попереднього етапу (89мг, 0,24ммоль) та [Ν,Ν'-ди(третбутоксикарбоніл)]амідинопіразолу (86мг, 0,28ммоль) у DMF (5мл) перемішували протягом 4 днів при навколишній температурі. Реакційну суміш випарювали in vaсuо і неочищений продукт очищали шляхом флеш-хроматографії (5% метанол у DCM), одержуючи неочищену жовту олію. Її потім очищали шляхом препаративної тонкошарової хроматографії (5% метанол у DCM), одержуючи названу сполуку (72мг, 49%) у вигляді безбарвної твердої речовини. 1Н ЯМР (300МГц, CDCI3) 9,19 (s, 1H), 8,22 (br t, 1H, J=5,0Гц), 7,62 (s, 1H), 7,23 (m, 10H (Аr + NH)), 4,27 (s, 2H), 4,08 (m, 2H), 3,57 (m, 4H), 1,51 (s, 9H), 1,49 (s,9H). 7. Трифтороацетат N-[2-(гуанідинооксі)етил]-2(3-{[бензилсульфоніл]аміно}феніл)ацетаміду Продукт попереднього етапу (72мг, 0,12ммоль) розчиняли у DCM (5мл) і приводили в реакцію з трифторооцтовою кислотою (2мл) протягом 4 годин при навколишній температурі. Реакційну суміш концентрували in vaсuо і неочищений продукт очищали шляхом препаративної тонкошарової хроматографії (20% метанол у DCM), одержуючи названу сполуку (44мг, 71%) у вигляді блідо-жовтого воску. 1Н ЯМР (300МГц, CDCI3/CD3OD) 7,34 (m, 3H), 7,28 (m, 3Н), 7,11 (m, 1H), 7,05 (m, 2H), 4,35 (s, 2H), 3,90 (t, 2H, J=4,9Гц), 3,52 (s, 2H), 3,47 (t, 2H, J=4,8Гц). Мас-спектр (MALDІ-TOF, матриця -ціано-4-гідроксикорична кислота) розрах. для C18H23N5O4S: 428,1 (M+Na), 406,2 (М+Н). Виявлено: 428,4,406,4. Приклад 7 75093 60 Трифтороацетат N-[2-(гуанідинооксі)етил]-2-(2хлоро-5-{[бензилсульфоніл]амiно]феніл)ацетаміду 1. Моногідрат 2-хлоро-5-нітрофенілоцтової кислоти Розчин 2-хлорофенілоцтової кислоти (10,0г, 58,6ммоль) у концентрованій сірчаній кислоті (40мл) охолоджували до -10°С і повільно приводили у реакцію з розчином димлячої азотної кислоти (2,80мл, 66,7ммоль) у концентрованій сірчаній кислоті (7,2мл). Через 2,5 години реакційну суміш повільно виливали на льодяну воду (400мл), фільтрували крізь грубий фрит, одноразово промивали холодною водою і висушували на фриті до наступного дня, одержуючи названу сполуку (13,5г, 98%) у вигляді білої твердої речовини, інтеграція протонного спектру ЯМР показала продукт, який містив приблизно 0,2 еквівалента 2хлорофенілоцтової кислоти, але тонкошарова хроматографія показала, її невіддільність від продукту. 1Н ЯМР (300МГц, CDCI3/CD3OD) 8,25 (d, 1Н, J=2,7Гц), 8,13 (dd, 1Н, J=8,7Гц, 2,7 Гц), 7,61 (d, 1Н, J=8,8Гц), 3,89 (s, 2Н). 2. Етил 2-(3-аміно-6-хлорофеніл)ацетат Продукт попереднього етапу (4,14г, 17,7ммоль) суспендували у DCM (70мл) і приводили в реакцію з оксалілхлоридом (4,0мл, 46ммоль) та кількома краплями DMF. Після перемішування протягом 1 години при навколишній температурі реакційна суміш ставала гомогенною, додавали очищений для реакції етанол (30мл) і реакційну суміш перемішували протягом додаткових 30 хвилин. Неочищений продукт випарювали in vaсuо і очищали шляхом флеш-хроматографії (від 10% до 15% етилацетату в гексані), одержуючи названу сполуку (4,6г) у вигляді блідо-жовтої олії. Протонний спектр ЯМР показав продукт, який містить приблизно 0,8 еквівалента діетилоксалату, який не міг бути виявлений шляхом тонкошарової хроматографії. 1Н ЯМР (300МГц, CDCI3) 8,21 (d, 1Н, J=2,7Гц), 8,11 (dd, 1Н, J=8,8Гц, 2,7Гц), 7,57 (d, 1H, J=8,8Гц), 4,21 (q, 2Н, J=7,2Гц), 3,87 (s, 2Н), 1,28 (t, 3Н, J=7,2Гц). 3. Етил 2-(3-аміно-6-хлорофеніл)ацетат
ДивитисяДодаткова інформація
Назва патенту англійськоюAminopyridinyl-,aminoguanidinyl-, and alkoxyguanidinesubstituted phenylsubstituted phenylacetamides as protease inhibitors
Автори англійськоюTomczuk Bruce E.
Назва патенту російськоюАминопиридинил-, аминогуанидинил-, и алкоксигуанидинилзамещенные фенилацетамиды как ингибиторы протеазы
Автори російськоюТомчук Брюс Э.
МПК / Мітки
МПК: A61K 31/165, C07C 309/00, C07C 291/00, A61K 31/44, A61L 31/00, A61P 9/08, C07D 213/75, A61P 29/00, A61P 7/02, A61P 9/10, C07C 311/13, A61K 31/155, C07C 311/21, A61K 45/00, C07C 279/04, C07D 213/73, A61K 31/18, C07C 279/00, A61K 31/255, A61P 43/00
Мітки: алкоксигуанідинілзаміщені, фенілацетаміди, протеази, аміногуанідиніл, амінопіридиніл, інгібітори
Код посилання
<a href="https://ua.patents.su/39-75093-aminopiridinil-aminoguanidinil-ta-alkoksiguanidinilzamishheni-fenilacetamidi-yak-ingibitori-proteazi.html" target="_blank" rel="follow" title="База патентів України">Амінопіридиніл-, аміногуанідиніл-, та алкоксигуанідинілзаміщені фенілацетаміди як інгібітори протеази</a>
Попередній патент: Спосіб і пристрій зондування ретранслятора
Наступний патент: Фармацевтична композиція, що містить сполуку модафінілу, та спосіб лікування
Випадковий патент: Нанокомпозит металів, як потенційний компонент біопрепаратів і кормових добавок для тварин