Піразолопіримідинові сполуки
Формула / Реферат
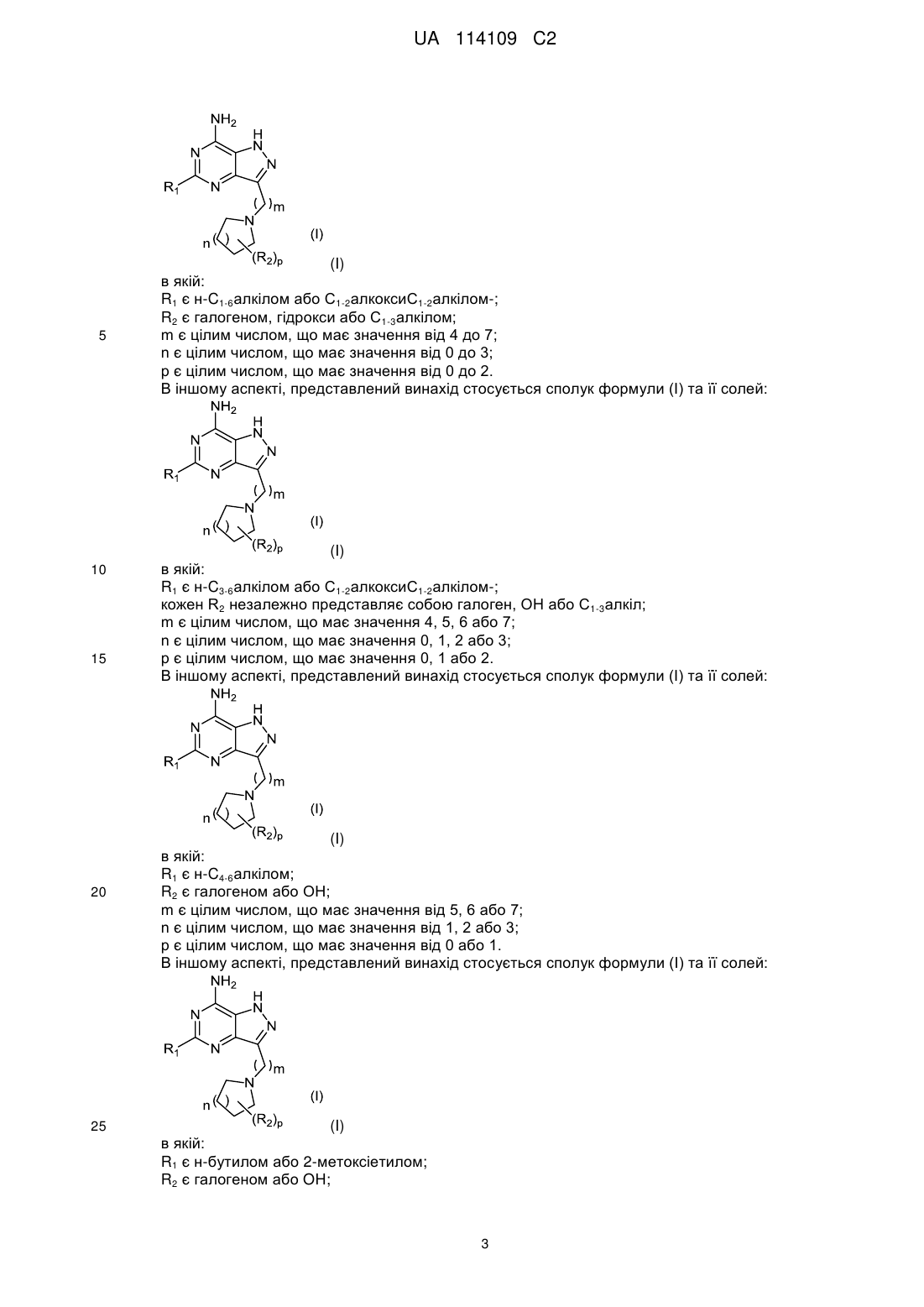
1. Сполука формули (І) або її сіль:
 , (I)
, (I)
в якій:
R1 є н-С3-6алкілом або або С1-2алкоксіС1-2алкілом-;
кожен R2 незалежно являє собою галоген, ОН або С1-3алкіл;
m є цілим числом, що має значення 4, 5, 6 або 7;
n є цілим числом, що має значення 0, 1, 2 або 3;
р є цілим числом, що має значення 0, 1 або 2.
2. Сполука за п. 1 або її сіль, в якій R1 є н-бутилом.
3. Сполука за п. 1 або її сіль, в якій R1 є 2-метоксіетилом.
4. Сполука за будь-яким з пп. 1-3 або її сіль, в якій m є цілим числом, що має значення 5 або 6.
5. Сполука за будь-яким з пп. 1-4 або її сіль, в якій n є 1.
6. Сполука за будь-яким з пп. 1-4 або її сіль, в якій n є 2.
7. Сполука за будь-яким з пп. 1-6 або її сіль, в якій р є 0 або 1.
8. Сполука за будь-яким з пп. 1-7 або її сіль, в якій кожен R2 незалежно являє собою галоген або ОН.
9. Сполука за п. 8 або її сіль, в якій кожен R2 незалежно являє собою F або ОН.
10. Сполука за п. 1 або її сіль, вибрана з групи, що складається з:
5-бутил-3-(6-(піперидин-1-iл)гексил)-1H-піразоло[4,3-d]піримідин-7-аміну;
5-(2-метоксіетил)-3-(6-(піперидин-1-іл)гексил)-1Н-піразоло[4,3-d]піримідин-7-аміну;
5-бутил-3-(6-(піролідин-1-іл)гексил)-1Н-піразоло[4,3-d]піримідин-7-аміну;
5-(2-метоксіетил)-3-(6-(піролідин-1-іл)гексил)-1H-піразоло[4,3-d]піримідин-7-аміну;
5-бутил-3-(5-(піперидин-1-іл)пентил)-1Н-піразоло[4,3-d]піримідин-7-аміну;
5-бутил-3-(5-(піролідин-1-іл)пентил)-1Н-піразоло[4,3-d]піримідин-7-аміну;
5-бутил-3-(7-(піперидин-1-іл)гептил)-1Н-піразоло[4,3-d]піримідин-7-аміну;
5-бутил-3-(7-(піролідин-1-іл)гептил)-1Н-піразоло[4,3-d]піримідин-7-аміну;
3-(6-(азепан-1-іл)гексил)-5-бутил-1H-піразоло[4,3-d]піримідин-7-аміну;
3-(5-(азепан-1-іл)пентил)-5-бутил-1Н-піразоло[4,3-d]піримідин-7-аміну;
(S)-5-бутил-3-(6-(3-флуорпіролідин-1-іл)гексил)-1H-піразоло[4,3-d]піримідин-7-аміну;
(S)-5-бутил-3-(5-(3-флуорпіролідин-1-іл)пентил)-1Н-піразоло[4,3-d]піримідин-7-аміну;
(R)-5-бутил-3-(6-(3-флуорпіролідин-1-іл)гексил)-1Н-піразоло[4,3-d]|піримідин-7-аміну
форміату;
(R)-5-бутил-3-(5-(3-флуорпіролідин-1-іл)пентил)-1Н-піразоло[4,3-d]піримідин-7-аміну;
1-(6-(7-аміно-5-бутил-1H-піразоло[4,3-d]піримідин-3-іл)гексил)піперидин-4-олу;
1-(5-(7-аміно-5-бутил-1H-піразоло[4,3-d]піримідин-3-іл)пентил)піперидин-4-олу;
5-бутил-3-(6-(4-флуорпіперидин-1-іл)гексил)-1Н-піразоло[4,3-d]піримідин-7-аміну та
5-бутил-3-(5-(4-флуорпіперидин-1-іл)пентил)-1H-піразоло[4,3-d]піримідин-7-аміну.
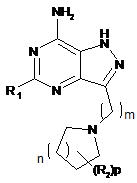
11. Сполука за п. 1 або її сіль, яка є 5-бутил-3-(6-(піролідин-1-іл)гексил)-1Н-піразоло[4,3-d]піримідин-7-аміном формули:
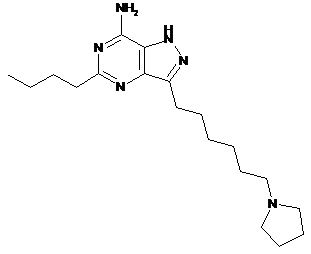 .
.
12. Сполука за будь-яким з пп. 1-11, яка знаходиться в формі фармацевтично прийнятної солі.
13. Сполука за п. 12, вибрана з групи, що складається з:
5-бутил-3-(6-(піролідин-1-іл)гексил)-1Н-піразоло[4,3-d]піримідин-7-аміну малеату;
5-бутил-3-(6-(піролідин-1-іл)гексил)-1Н-піразоло[4,3-d]піримідин-7-аміну дималеату та
5-бутил-3-(6-(піролідин-1-іл)гексил)-1Н-піразоло[4,3-d]піримідин-7-аміну гемісукцинату.
14. Сполука за п. 12, яка є 5-бутил-3-(6-(піролідин-1-іл)гексил)-1Н-піразоло[4,3-d]піримідин-7-аміну дималеатом формули:
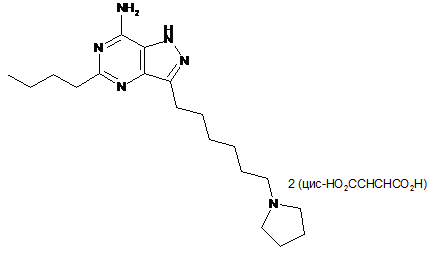 .
.
15. Сполука за п. 14, яка знаходиться в твердому стані в кристалічній формі, яка характеризується даними рентгенівської порошкової дифрактометрії, що має дифракційні піки при значеннях 2θ: 5,3, 5,8, 6,4, 9,0, 10,1, 10,9, 11,6, 12,7, 16,0 та 19,1.
16. Сполука за будь-яким з пп. 1-11, яка знаходиться в формі вільної основи.
17. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-16 та один або більше фармацевтично прийнятних ексципієнтів.
18. Вакцинна композиція, що містить сполуку за будь-яким з пп. 1-16 та антиген або антигенну композицію.
19. Сполука за будь-яким з пп. 1-16 для застосування в терапії.
20. Сполука за будь-яким з пп. 1-16 для застосування в лікуванні алергічних захворювань та інших запальних станів, інфекційних захворювань або раку.
21. Сполука за будь-яким з пп. 1-16 для застосування в лікуванні алергічного реніту.
22. Сполука за будь-яким з пп. 1-16 для застосування в лікуванні астми.
23. Вакцинна композиція за п. 18 для застосування в терапії.
Текст
Реферат: Сполука формули (І) та її солі: NH2 H N N R1 N N m N n (R2)p , (I) в якій R1 є н-С1-6алкілом або С1-2алкоксіС1-2алкілом-, R2 є галогеном, ОН або С1-3алкілом, m є цілим числом, що має значення 4, 5, 6 або 7, n є цілим числом, що має значення 0, 1, 2 або 3, та р є цілим числом, що має значення 0, 1 або 2, є стимулятором інтерферону людини. Сполуки, які індукують інтерферон людини, можуть застосовувати в лікуванні різних розладів, наприклад лікуванні алергічних захворювань та інших запальних станів, наприклад алергічного UA 114109 C2 (12) UA 114109 C2 реніту та астми, інфекційних захворювань та раку, та, крім того, можуть застосовувати як допоміжний засіб у вакцинах. UA 114109 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь винаходу Винахід стосується сполук, способів їх одержання, композицій, які їх містять, їх застосування в лікуванні різних розладів, зокрема, алергічних захворювань та інших запальних станів, наприклад, алергічного реніту та астми, інфекційних захворювань, та раку, та як допоміжний засіб вакцини. Передумови створення винаходу Хребетним тваринам постійно загрожує зараження мікрорганізмами, та механізми імунного захисту розвиваються для знищення інфекційних патогенів. У ссавців, дана імунна система включає дві гілки: вроджений імунітет та набутий імунітет. Перша лінія захисту організму представляє собою вроджену імунну систему, яка є опосередкованою макрофагами та дендритними клітинами. Набутий імунітет включає знищення патогенів на пізніх стадіях інфекції та також дозволяє генерувати імунологічну пам'ять. Набутий імунітет є дуже специфічним, з огляду на чисельний імунний спектр лімфоцитів з антиген-специфічними рецепторами, що випробували перегрупування гена. Центральне місце в генерації ефективного вродженої імунної відповіді у ссавців посідають механізми, які провокують індукування інтерферонів та інших цитокінів, які діють на клітини, щоб викликати ряд ефектів. У людини інтерферони типу I представляють собою родину споріднених протеїнів, кодованих генами на хромосомі 9 та, які кодують щонайменше 13 ізоформ інтерферон альфа (IFNα) та одну ізоформу інтерферону бета (IFNβ). Інтерферон вперше був описаний як речовина, яка могла захистити клітини від вірусної інфекції (Isaacs & Lindemann, J. Virus Interference. Proc. R. Soc. Lon. Ser. B. Biol. Sci. 1957: 147, 258-267). Рекомбінантний IFNα вперше був дозволений до застосування в біологічній терапевтичній практиці та став важливою терапією при вірусних інфекціях та при раку. Відомо, що разом з безпосередньою антивірусною активністю щодо клітин, інтерферони є потенційними модуляторами імунної відповіді, діючи на клітини імунної системи (Gonzalez-Navajas J.M. et al Nature Reviews Immunology, 2012; 2, 12535). Толл-подібні рецептори (TLR) є родиною з десяти рецепторів розпізнавання образів, описаною у людини (Gay, N.J. et al, Annu. Rev. Biochem., 2007: 46, 141-165). TLR експресуються переважно вродженими імунними клітинами, де їх роль полягає в моніторингу навколишнього середовища щодо наявності ознак інфекції та, в активації, мобілізуванні захисних механізмів, спрямованих на знищення інвазивних патогенів. Ранні вроджені імунні відповіді, стимульовані TLR, обмежують поширення інфекції, тоді як про-запальні цитокіни та хемокіни, які вони індукують, призводять до набору та активації клітин, що представляють антиген, B клітин та T клітин. TLR можуть модулювати природу адаптивних імунних відповідей, щоб надати відповідний захист через активацію дендритних клітин та вивільнення цитокінів (Akira S. et al, Nat. Immunol., 2001: 2, 675-680). Вважають, що профіль відповіді від різних TLR агоністів залежить від типу клітин, що активуються. TLR7 є членом підгрупи TLR (TLR 3, 7, 8, та 9), локалізованих в ендосомальному відсіку клітин, які стали спеціалізованими для детектування "не своїх" нуклеїнових кислот. TLR7 відіграє ключову роль в противірусному захисті через розпізнавання олРНК (Diebold S.S. et al, Science, 2004: 303, 1529-1531; та Lund J. M. et al, PNAS, 2004: 101, 5598-5603). TLR7 має обмежений профіль експресії у людини та експресується переважно B клітинами та плазмацитоїдними дендритними клітинами (pDC), та в меншій мірі моноцитами. Плазмацитоїдні DC є унікальною популяцією лімфоїдного походження дендритних клітин (0,2-0,8 % від мононуклеарних клітин периферійної крові (МКПК)), які є первинними клітинами, що продукують інтерферон типу І, які секретують високі рівні інтерферону-альфа (IFNα) та інтерферону-бета (IFNβ) у відповідь на вірусні інфекції (Liu Y-J, Annu. Rev. Immunol., 2005: 23, 275-306). Введення низькомолекулярної сполуки, яка могла б стимулювати вроджену імунну відповідь, включаючи активацію інтерферонів типу І та інших цитокінів через толл-подібні рецептори, могло б стати важливою стратегією в лікуванні або попередженні захворювань людини. Низькомолекулярні агоністи TLR7 були описані, як такі, що можуть індукувати інтерферон альфа у тварин та у людини (Takeda K. et al, Annu. Rev. Immunol., 2003: 21, 335-76). TLR7 агоністи включають імідазохінолінові сполуки, такі як іміквімод та резиквімод, оксоаденінові аналоги та також нуклеозидні аналоги, такі як локсорибін та 7-тіа-8-оксогуанозин, які, як вже давно відомоЮ індукують інтерферон альфа (Czarniecki. M., J. Med, Chem., 2008: 51, 6621-6626; Hedayat M. et al, Medicinal Research Reviews, 2012: 32, 294-325). Даний тип імуномодулюючої стратегії має потенціал для виявлення сполук, які можуть бути корисними в лікуванні алергічних захворювань (Moisan J. et al, Am. J. Physiol. Lung Cell Mol. Physiol., 2006: 290, L987-995), вірусних інфекцій (Horcroft N.J. et al, J. Antimicrob. Chemther, 2012: 67, 789-801), раку (Krieg A., Curr. Oncol. Rep., 2004: 6(2), 88-95), інших запальних станів, таких як синдром 1 UA 114109 C2 5 10 15 20 25 30 35 40 45 50 подразненої товстої кишки (Rakoff-Nahoum S., Cell., 2004, 23, 118(2): 229-41), та як допоміжні засоби вакцини (Persing et al. Trends Microbiol. 2002: 10(10 Suppl), S32-7). Більш конкретно, алергічні захворювання є асоційованими з Th2-тенденційною імунною відповіддю на алергени. Th2 відповіді є пов'язаними з підвищеними рівнями IgE, які, через свої впливи на тучні клітини, сприяють гіперчутливості до алергенів, яку в результаті одержують в проялених симптомах, наприклад, у вигляді астми та алергічного реніту. У здорових людей імунна відповідь на алергени є більш збалансованою змішаним Th2/Th1 та регуляторною T клітинною відповіддю. Показано, що TLR7 ліганди зменшують вивільнення Th2 цитокінів та посилюють вивільнення Th1 цитокінів in vitro та підвищують запальні відповіді Th2-типу в алергічних легеневих моделях in vivo (Duechs M.J., Pulmonary Pharmacology & Therapeutics, 2011: 24, 203-214; Fili L. et al, J. All. Clin. Immunol., 2006: 118, 511-517; Tao et al, Chin. Med. J., 2006: 119, 640-648; Van L.P. Eur. J. Immunol., 2011: 41, 1992-1999). Таким чином TLR7 ліганди мають потенціал, щоб відновити баланс імуної відповіді, яка проявляється у алергічних осіб, та призводить до модифікації захворювання. Останні клінічні дослідження з агоністом TLR7 показали повторну інтраназальну стимуляцію TLR7 для того, щоб отримати стійке зниження реактивності до алергену у пацієнтів, як з алергічним ренітом так і з алергічною астмою (Greiff L. Respiratory Research, 2012: 13, 53; Leaker B.R. et al, Am. J. Respir. Crit. Care Med., 2012: 185, A4184). У пошуку нових низькомолекулярних стимуляторів інтерферону людини IFNα була розроблена стратегія аналізу, щоб характеризувати малу молекулу (не приймаючи до уваги механізм), яка ґрунтується на стимуляції первиннихлюдських донорських клітин або цільної крові сполуками, що є розкритими в даному документі. Суть винаходу В першому аспекті, представлений винахід стосується сполук формули (I) та її солей: (I) в якій: R1 є н-C1-6алкілом або C1-2алкоксиC1-2алкілом-; R2 є галогеном, гідрокси або C1-3алкілом; m є цілим числом, що має значення від 4 до 7; n є цілим числом, що має значення від 0 до 3; p є цілим числом, що має значення від 0 до 2. Показано, що певні сполуки за винаходом є стимуляторами інтерферону людини та може мати бажаний профіль здатності до розвитку в порівнянні з відомими стимуляторами інтерферону людини. До того ж, певні сполуки за винаходом можуть також показувати селективність до IFNα по відношенню до TNFα. Сполуки, які індукують інтерферон людини, можуть бути прийнятними в лікуванні різних розладів, наприклад, в лікуванні алергічних захворювань та інших запальних станів, наприклад, алергічного реніту та астми, в лікуванні інфекційних захворювань та раку. Відповідно, винахід, крім того, стосується фармацевтичних композицій, що містять сполуку формули (I), або її фармацевтично прийнятну сіль. Представлений винахід, крім того, стосується способів лікування розладів, пов'язаних разом з тим із застосуванням сполуки формули (I) або її фармацевтично прийнятної солі, або фармацевтичної композиції, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль. Сполуки винаходом, крім того, можуть мати застосування як допоміжний засіб вакцини. Тому, представлений винахід, крім того, стосується вакцинної композиції, що містить сполуку формули (I), або її фармацевтично прийнятну сіль, та антиген або антигенну композицію. Певні сполуки за винаходом є потенційними імуномодуляторами, та, відповідно, слід проявляти обережність у поводженні з ними. Детальний опис винаходу В першому аспекті, представлений винахід стосується сполук формули (I) та її солей: 2 UA 114109 C2 5 10 15 20 25 (I) в якій: R1 є н-C1-6алкілом або C1-2алкоксиC1-2алкілом-; R2 є галогеном, гідрокси або C1-3алкілом; m є цілим числом, що має значення від 4 до 7; n є цілим числом, що має значення від 0 до 3; p є цілим числом, що має значення від 0 до 2.В іншому аспекті, представлений винахід стосується сполук формули (I) та її солей: (I) в якій: R1 є н-C3-6алкілом або C1-2алкоксиC1-2алкілом-; кожен R2 незалежно представляє собою галоген, OH або C1-3алкіл; m є цілим числом, що має значення 4, 5, 6 або 7; n є цілим числом, що має значення 0, 1, 2 або 3; p є цілим числом, що має значення 0, 1 або 2. В іншому аспекті, представлений винахід стосується сполук формули (I) та її солей: (I) в якій: R1 є н-C4-6алкілом; R2 є галогеном або OH; m є цілим числом, що має значення від 5, 6 або 7; n є цілим числом, що має значення від 1, 2 або 3; p є цілим числом, що має значення від 0 або 1. В іншому аспекті, представлений винахід стосується сполук формули (I) та її солей: (I) в якій: R1 є н-бутилом або 2-метоксіетилом; R2 є галогеном або OH; 3 UA 114109 C2 m є цілим числом, що має значення 5, 6 або 7; n є цілим числом, що має значення 1, 2 або 3; p є цілим числом, що має значення 0 або 1. В іншому аспекті, представлений винахід стосується сполук формули (I) та її солей: 5 10 15 20 25 30 35 40 (I) в якій: R1 є н-бутилом або 2-метоксіетилом; R2 є F або OH; m є цілим числом, що має значення 5, 6 або 7; n є цілим числом, що має значення 1, 2 або 3; p є цілим числом, що має значення 0 або 1. В іншому аспекті, представлений винахід стосується сполук формули (I) та її солей: (I) в якій: R1 є н-бутилом або 2-метоксіетилом; m є цілим числом, що має значення 5, 6 або 7; n є цілим числом, що має значення 1, 2 або 3; p є 0. В іншому аспекті, R1 є н-C4-6алкілом, наприклад н-бутилом. В іншому аспекті, R1 є 2-метоксіетилом. В іншому аспекті, m є цілим числом, що має значення 5 або 6. В іншому аспекті, n є 1 або 2. В іншому аспекті, p є 0 або 1. В іншому аспекті, R2 є галогеном або OH. В іншому аспекті, R2 є F або OH. Приклади сполук формули (I) є представленими в наступній групі та формують наступний аспект винаходу: 5-Бутил-3-(6-(піперидин-1-іл)гексил)-1H-піразоло[4,3-d]піримідин-7-амін; 5-(2-Метоксіетил)-3-(6-(піперидин-1-іл)гексил)-1H-піразоло[4,3-d]піримідин-7-амін; 5-Бутил-3-(6-(піролідин-1-іл)гексил)-1H-піразоло[4,3-d]піримідин-7-амін; 5-(2-Метоксіетил)-3-(6-(піролідин-1-іл)гексил)-1H-піразоло[4,3-d]піримідин-7-амін; 5-Бутил-3-(5-(піперидин-1-іл)пентил)-1H-піразоло[4,3-d]піримідин-7-амін; 5-Бутил-3-(5-(піролідин-1-іл)пентил)-1H-піразоло[4,3-d]піримідин-7-амін; 5-Бутил-3-(7-(піперидин-1-іл)гептил)-1H-піразоло[4,3-d]піримідин-7-амін; 5-Бутил-3-(7-(піролідин-1-іл)гептил)-1H-піразоло[4,3-d]піримідин-7-амін; 3-(6-(Азепан-1-іл)гексил)-5-бутил-1H-піразоло[4,3-d]піримідин-7-амін; 3-(5-(Азепан-1-іл)пентил)-5-бутил-1H-піразоло[4,3-d]піримідин-7-амін; (S)-5-Бутил-3-(6-(3-флуорпіролідин-1-іл)гексил)-1H-піразоло[4,3-d]піримідин-7-амін; (S)-5-Бутил-3-(5-(3-флуорпіролідин-1-іл)пентил)-1H-піразоло[4,3-d]піримідин-7-амін; (R)-5-Бутил-3-(6-(3-флуорпіролідин-1-іл)гексил)-1H-піразоло[4,3-d]піримідин-7-амін; (R)-5-Бутил-3-(5-(3-флуорпіролідин-1-іл)пентил)-1H-піразоло[4,3-d]піримідин-7-амін; 1-(6-(7-Аміно-5-бутил-1H-піразоло[4,3-d]піримідин-3-іл)гексил)піперидин-4-ол; 1-(5-(7-Аміно-5-бутил-1H-піразоло[4,3-d]піримідин-3-іл)пентил)піперидин-4-ол; 5-Бутил-3-(6-(4-флуорпіперидин-1-іл)гексил)-1H-піразоло[4,3-d]піримідин-7-амін; 4 UA 114109 C2 5 10 15 20 25 30 35 40 45 50 55 60 5-Бутил-3-(5-(4-флуорпіперидин-1-іл)пентил)-1H-піразоло[4,3-d]піримідин-7-амін, та їх солі. В іншому аспекті, представлений винахід стосується 5-бутил-3-(6-(піролідин-1-іл)гексил)-1Hпіразоло[4,3-d]піримідин-7-аміну або його солі. Як використовується в даному документі, термін "алкіл" стосується насиченого, вуглеводневого ланцюга, який має конкретне число атомів членів. Якщо не зазначене інше, термін "алкіл" влючає лінійну та розгалужену алкільні групи. Наприклад, C 1-6алкіл стосується насиченого, лінійного або розгалуженого вуглеводневого ланцюга, що має від 1 до 6 атомів карбону, такого як етил та ізопропіл, та н-C1-6алкіл стосується насиченого, лінійного вуглеводневого ланцюга, що має від 1 до 6 атомів карбону, такого як н-пропіл та н-бутил. Слід розуміти, що посилання в даному документі на сполуки за винаходом має на увазі сполуку формули (I) у вигляді вільної основи або у вигляді солі, наприклад, фармацевтично прийнятної солі. В одному аспекті винаходу, сполука формули (I) існує у вигляді вільної основи. Солі сполук формули (I) включають фармацевтично прийнятні солі та солі, які можуть не бути фармацевтично прийнятними, але можуть бути корисними в одержанні сполук формули (I) та їх фармацевтично прийнятних солей. В одному аспекті винаходу, сполука формули (I) існує у вигляді фармацевтично прийнятної солі. Солі можуть бути похідними певних неорганічних або органічних кислот. Як використовується в даному документі, термін "фармацевтично-прийнятні солі" стосується солей, що зберігають бажану біологічну активність предметної сполуки та демонструють мінімальні небажані токсичні ефекти. Дані фармацевтично прийнятні солі можуть одержувати in situ під час кінцевого виділення та очистки сполуки, або шляхом додаткової взаємодії очищеної сполуки у вигляді вільної кислоти кислота або вільної основи з прийнятною основою або кислотою, відповідно. Більш того, фармацевтично прийнятні солі сполуки формули (I) можуть одержувати під час наступного процесу з її форми вільної кислоти або основи, наприклад in situ під час виробництва фармацевтичного препарату. Прикладами солей є фармацевтично прийнятні солі. Фармацевтично прийнятні солі включають кислотні адитивні солі. Для огляду прийнятних солей дивись Berge et al., J. Pharm. Sci., 66:1-19 (1977). Приклади фармацевтично прийнятних кислотних адитивних солей сполуки формули (I) включають солі з неорганічними кислотами, такими як, наприклад, гідрохлоридна кислота, гідробромідна кислота, ортофосфорна кислота, нітратна кислота, фосфорна кислота або сульфатна кислота, або з органічними кислотами, такими як, наприклад, метансульфонова кислота, етансульфонова кислота, п-толуолсульфонова кислота, оцтова кислота, пропіонова кислота, молочна кислота, лимонна кислота, фумарова кислота, яблучна кислота, бурштинова кислота, саліцилова кислота, малеїнова кислота, гліцерофосфатна кислота, винна, бензойна, глутамінова, аспарагінова, бензолсульфонова, нафталінсульфонова, така як 2нафталінсульфонова, гексанова кислота або ацетилсаліцилова кислота. Винахід включає в межі свого обсягу всі можливі стехіометричні та нестехіометричні форми солей сполук формули (I). Наприклад, дималеатну або гемісукцинатну сіль сполуки формули (I). Солі можуть одержувати, застосовуючи методики, добое відомі в даній галузі з рівня техніки, наприклад, шляхом осадження з розчину, з наступною фільтрацією, або випаровуванням розчинника. Як правило, фармацевтично прийнятну кислотну адитивну сіль можуть одержувати за реакцією сполуки формули (I) з прийнятною кислотою (такою як гідробромідна, гідрохлоридна, сульфатна, малеїнова, п-толуолсульфонова, метансульфонова, нафталінсульфонова або бурштинова кислот), необов'язково в прийнятному розчиннику, такому як органічний розчинник, одержуючи сіль, яку, як правило, виділяють, наприклад, шляхом кристалізації та фільтрації. Прикладами фармацевтично прийнятних солей 5-бутил-3-(6-(піролідин-1-іл)гексил)-1Hпіразоло[4,3-d]піримідин-7-аміну є малеатна, дималеатна та гемісукцинатна солі. Слід мати на увазі, що багато органічних сполук можуть утворювати комплекси з розчинниками, в яких вони взаємодіють або з яких їх осаджують або кристалізують. Дані комплекси є відомими як "сольвати". Наприклад, комплекс з водою є відомим як "гідрат". Розчинники з високими температурами кипіння та/або розчинники з високою схильністю до утворення водневих зв'язків, такі як вода, етанол, ізопропіловий спирт та N-метилпіролідинон, можуть використовувати, щоб утворити сольвати. Способи ідентифікації сольватів включають, але не обмежуються цим, ЯМР та мікроаналіз. Сольвати сполук формули (I) знаходяться в межах обсягу винаходу. Як використовується в даному документі, термін сольват охоплює 5 UA 114109 C2 5 10 15 20 25 30 35 40 45 сольвати як у вигляді вільної основи сполуки, а також будь-якої їх солі. Певні сполуки за винаходом можуть існувати в таутомерних формах. Слід розуміти, що представлений винахід охоплює всі таутомери сполук за винаходом або як індивідуальні таутомери, або як їх суміші. Сполуки за винаходом можуть знаходитись в кристалічній або аморфній формі. Більш того, деякі з кристалічних форм сполук за винаходом можуть існувати як поліморфи, всі з яких є включеними в межу обсягу представленого винаходу. Найбільш термодинамічно стабільною поліморфною формою або формами сполук за винаходом є особливо цікавими. В іншому аспекті, представлений винахід стосується кристалічної форми в твердому стані 5бутил-3-(6-(піролідин-1-іл)гексил)-1H-піразоло[4,3-d]піримідин-7-аміну дималеату, охарактеризованої даними рентгенівської порошкової дифрактометрії, яка має дифракційні піки при 2θ зі значеннями 5,3, 5,8, 6,4, 9,0, 10,1, 10,9, 11,6, 12,7, 16,0 та 19,1. В іншому аспекті, представлений винахід стосується кристалічної форми в твердому стані 5бутил-3-(6-(піролідин-1-іл)гексил)-1H-піразоло[4,3-d]піримідин-7-аміну гемісукцинатну, охарактеризованої даними рентгенівської порошкової дифрактометрії, яка має дифракційні піки при 2θ зі значеннями 8,1, 9,8, 11,6, 16,0, 17,5, 19,5, 20,2, 23,0 та 23,7. Поліморфні форми сполук за винаходом можуть охарактеризовувати та розрізняти, застосовуючи ряд традиційних аналітичних методик, включаючи, але не обмежуючись цим, рентгенівську порошкову дифрактометрію (XRPD), інфрачервону спектроскопію (ІЧ), спектроскопію комбінаційного розсіювання, диференціальну скануючу калориметрію (ДСК), термогравіметричний аналіз (ТГА) та твердо-фазний ядерно-магнітний резонанс (тфЯМР). Представлений винахід також включає всі прийнятні ізотопні варіанти сполуки формули (I) або її фармацевтично прийнятної солі. Ізотопний варіант сполуки формули (I), або її фармацевтично прийнятної солі, визначають як один з тих, в якому, щонайменше один атом є заміненим на атом, що має той самий атомний номер, але атомна маса відрізняється від атомної маси, яка, як правило, зустрічається в природу. Приклади ізотопів, що можуть бути введені в сполуки за винаходом, включають ізотопи гідрогену, карбону, нітрогену, оксигену, 2 3 13 14 15 17 18 18 36 флуору та хлору, такі як H, H, C, C, N, O, O, F та Cl, відповідно. Певні ізотопні варіанти сполуки формули (I) або її солі, або сольвату, наприклад, ті, в яких радіоактивний 3 14 ізотоп, такий як H або C є включеним, є корисними в лікарському засобі та/або у вивченні 3 14 розподілення субстрату в тканині. Ізотопи тритію, тобто, H, та карбону-14, тобто, C, є особливо переважними через їх легкість одержання та здатність до детектування. Більш того, 2 заміщення ізотопами, такими як дейтерій, тобто, H, може давати певні терапевтичні переваги в результаті більш високої метаболічної стабільності, наприклад, збільшений in vivo період напіввиведення або знижені норми дозування і, отже, може бути переважним в деяких випадках. Ізотопні варіанти сполуки формули (I), або її фармацевтично прийнятна сіль, як правило, можуть отримувати за загальноприйнятими методиками, такими як ілюстративні способи або одержання, описані в прикладах, які наводяться в даному документі далі, застосовуючи відповідні ізотопні варіанти прийнятних реагентів. З викладеного вище повинно бути зрозумілим, що включеними в межі обсягу винаходу є сольвати, гідрати, ізомери, ізотопні варіанти та поліморфні форми сполук формули (I) та їх солей, та сольватів. Одержання сполуки Сполуки формули (I) та їх солі можуть одержувати за методологією, описаною в даному документі нижче, яка встановлює додаткові аспекти даного винаходу. Відповідно, передбаченим є спосіб одержання сполуки формули (I), де спосіб включає взаємне перетворення функціональної групи або зняття захисту в сполуці формули (II): 6 UA 114109 C2 5 10 15 20 25 30 35 в якій R1, R2, m, n та p є такими як визначено в даному документі раніше для сполуки формули (I) та Z є OH або аміно, заміщений прийнятною захисною групою, такою як 3, 4диметоксибензил або 2,4-диметоксибензил та потім, якщо потрібно, одержання солі таким чином утвореної сполуки. Наприклад, коли Z є OH, сполука формули (II) розчиняють в оксихлориді фосфору та нагрівають, при прийнятній температурі, наприклад, 120 °C протягом прийнятного періоду, наприклад, 45-120 хвилин. Реакційну суміш випаровують та азеотропно дистилюють з прийнятним розчинником, наприклад, толуолом. Потім додають розчин водного аміаку (0,88) до розчину речовини в прийнятному розчиннику, наприклад, ізопропіловому спирті. Одержану в результаті суміш потім нагрівають в мікрохвильовому нагрівачі при прийнятній температурі, наприклад 120 – 150 °C протягом прийнятного періоду часу, наприклад 1 – 2 годин. Продукт (I) виділяють шляхом видалення розчинника та чистять, якщо потрібно. Наприклад, коли Z є (3,4-диметоксифеніл)метанамінною групою, сполуку формули (II) обробляють прийнятною кислотою, такою як трифлуороцтова кислота, та нагрівають при прийнятній температурі, наприклад, 120 °C, в мікрохвильовому нагрівачі протягом прийнятного періоду часу, наприклад, 4 години. Продукт (I) виділяють шляхом видалення розчинника, обробки водою та очистки, якщо потрібно. Наприклад, коли Z є (2,4-диметоксифеніл)метанамінною групою, сполуку формули (II) обробляють прийнятною кислотою, такою як трифлуороцтова кислота, та нагрівають при прийнятній температурі, наприклад, 60 °C протягом прийнятного періоду часу, наприклад, 2,5 – 4 години. Продукт (I) виділяють шляхом видалення розчинника, обробки водою та очистки, якщо потрібно. Сполука формули (II) можуть одержувати за реакцією сполуки формули (III): в якій R1, R2, m, n та p є такими, як визначено в даному документі раніше для сполуки формули (I) та Z є таким, як визначено в даному документі раніше для сполуки формули (II), з гідрогеном в присутності каталізатору. Наприклад, сполуку формули (III) розчиняють в прийнятному розчиннику, наприклад, етиловому спирті, та пропускають над прийнятним каталізатором, наприклад, 10 % паладій на вугіллі, в присутності водню при прийнятній температурі,наприклад, 20-60 °C, в прийнятному проточному апараті для гідрогенізації, такому як Thales H-Cube™. Альтернативно, сполуку формули (III) розчиняють в прийнятному розчиннику, наприклад, етиловому спирті, та перемішують в атмосфері водню в присутності прийнятного каталізатора, наприклад, 10 % паладію на вугіллі, при прийнятній температурі, наприклад, 20 °C, протягом прийнятного періоду часу 2-18 годин. Продукт (II) виділяють шляхом видалення розчинника, обробки водою та очистки, якщо потрібно. Сполуку формули (III) можуть одержувати за реакцією сполуки формули (IV): 7 UA 114109 C2 в якій R1 є таким, як визначено в даному документі раніше для сполуки формули (I), Z є таким, як визначено в даному документі раніше для сполуки формули (II) та X є галогеном, такий як йод або бром, зі сполукою формули (V): 5 10 15 20 25 30 35 , в якій R2, m, n та p є такими, як визначено для сполуки формули (I). Наприклад, сполуку формули (IV), розчиняють в прийнятному розчиннику, наприклад, N, Nдиметилформаміді, в присутності купруму(I) йодиду, прийнятного каталізатору, наприклад, біс(трифенілфосфін)паладію(II) дихлориду та прийнятної основи, наприклад, триетиламін. Додають розчин сполуки формули (V) в прийнятному розчиннику, такому як N, Nдиметилформамід, та суміш перемішують при прийнятній температурі, наприклад 20 – 55 °C протягом прийнятного періоду часу, наприклад 0,5 – 17 годин. Продукт (III) виділяють після обробки водою та очистки. Сполуку формули (V) можуть одержувати за реакцією сполуки формули (VI): в якій m є таким, як визначено для сполуки формули (I) та Y є групою, що відщеплюється, такою як галоген, наприклад, хлор, бром або йод, або алкілсульфонат, наприклад птолуолсульфонат, зі сполукою формули (VII): в якій R2, n та p є такими, як визначено для сполуки формули (I). Наприклад, сполуку формули (VI), сполуку формули (VII) та прийнятну основу, наприклад, гідрокарбонат натрію, розчиняють в прийнятному розчиннику, наприклад, N, Nдиметилформаміді, та нагрівають при прийнятній температурі, наприклад, 80 – 100 °C, протягом прийнятного періоду часу, наприклад, 16 – 18 годин. Продукт (V) виділяють після обробки водою та очистки, наприклад шляхом виділення прийнятної кристалічної солі, наприклад, оксалатної солі. Альтернативно, сполуку формули (III) можуть одержувати за реакцією сполуки формули (VIII): , в якій R1 та m є такими, як визначено в даному документі раніше для сполуки формули (I), Z є таким, як визначено в даному документі раніше для сполуки формули (II) та Y є групою, що відщеплюється, як визначено для сполук формули (VI), зі сполукою формули (VII), в якій R 2, n та p є такими як визначено для сполуки формули (I). Наприклад, сполуку формули (VIII), сполуку формули (VII) та прийнятну основу, наприклад, триетиламін, розчиняють в прийнятному розчиннику, наприклад, ацетонітрил, та нагрівають при прийнятній температурі, наприклад, 60 – 80 °C, протягом прийнятного періоду часу, наприклад, 16 – 26 годин. Продукт (III) виділяють після обробки водою та очистки. 8 UA 114109 C2 5 10 15 20 25 30 35 40 Сполуки формули (VIII) можуть одержувати за реакцією сполук формули (IV) зі сполуками формули (VI). Наприклад, сполуку формули (IV) розчиняють в прийнятному розчиннику, наприклад, N, N-диметилформаміді, в присутності купруму(I) йодиду, прийнятного каталізатора, наприклад, біс(трифенілфосфін)паладію(II) дихлориду, та прийнятної основи, наприклад, триетиламіну. Додають розчин сполуки формули (VI) в прийнятному розчиннику, такому як N, Nдиметилформамід, та суміш перемішують при прийнятній температурі, наприклад, 20-60 °C, протягом прийнятного періоду часу, наприклад, 2-18 годин. Продукт (VIII) виділяють після обробки водою та очистки. Альтернативно, сполуку формули (II) можуть одержувати за реакцією сполук формули (IX): в якій R1 та m є такими, як визначено в даному документі раніше для сполуки формули (I), Z є таким, як визначено в даному документі раніше для сполуки формули (II) та X є групою, що відщеплюється, такою як галоген, наприклад, хлор, бром або йод, зі сполукою формули (VII), в якій R2, n та p є такими, як визначено для сполуки формули (I). Наприклад, суміш сполуки формули (IX), сполуки формули (VII) та прийнятної основи, наприклад, триетиламіну, в прийнятному розчиннику, наприклад, ацетонітрилі, перемішують при прийнятній температурі, наприклад, 20 °C, протягом прийнятного періоду часу, наприклад, 17-19 годин. Продукт (IX) виділяють після обробки водою та очистки. Сполуки формули (IX) можуть одержувати за реакцією сполук формули (X): в якій R1 та m є такими, як визначено в даному документі раніше для сполуки формули (I), Z є таким, як визначено в даному документі раніше для сполуки формули (II) з прийнятним галогенуючим реагентом. Наприклад, розчин трифенілфосфіну в розчиннику, наприклад, дихлорметані, додають до суміші сполуки формули (X) та тетрабромметану в прийнятному розчиннику, наприклад, дихлорметані. Реакційну суміш перемішують при прийнятній температурі, наприклад, 20 ºC, протягом прийнятного періоду часу, 18 – 20 годин. Продукт (X) виділяють після обробки водою та очистки. Сполуки формули (X) можуть одержувати за реакцією сполук формули (XI): в якій R1 та m є такими, як визначено в даному документі раніше для сполуки формули (I), Z є таким, як визначено в даному документі раніше для сполуки формули (II) з воднем в присутності каталізатору. Наприклад, сполуку формули (XI) розчиняють в прийнятному розчиннику, наприклад, етанолі, та перемішують в атмосфері водню в присутності прийнятного каталізатора, наприклад, 10 % паладію на вугіллі, протягом прийнятного періоду часу, наприклад, 22 годин. Продукт (XIV) виділяють шляхом видалення розчинника та очистки, якщо потрібно. Сполуки формули (XI) можуть одержувати за реакцією сполук формули (IV) з відповідними алкін-1-олами. Наприклад, сполуку формули (IV) розчиняють в прийнятному розчиннику, наприклад, N, N-диметилформаміді, в присутності купруму(I) йодид, прийнятного каталізатора, наприклад, біс(трифенілфосфін)паладію(II) дихлориду та прийнятної основи, наприклад, триетиламіну. Додають розчин алкін-1-олу в прийнятному розчиннику, такому як N, Nдиметилформамід, та суміш перемішують при прийнятній температурі, наприклад, 60 °C 9 UA 114109 C2 5 10 15 20 25 30 35 протягом прийнятного періоду часу, наприклад, 2-4 години. Продукт (XI) виділяють після обробки водою та очистки. Сполуки формули (IV), в якій Z є аміно, заміщеним прийнятною захисною групою, можуть одержувати зі сполук формули (IV), в якій Z є OH групою. Наприклад, сполуку формули (IV) Z=OH розчиняють в прийнятному розчиннику, наприклад, N, N-диметилформаміді, в присутності прийнятного конденсуючого агента, наприклад, (бензотриазол-1ілокси)три(диметиламіно)фосфонію гексафлуорфосфату, та основи, наприклад, 1,8діазабіцикло[5,4,0]ундек-7-ену, обробляють прийнятним аміном, наприклад, (3,4диметоксифеніл)метанаміном. Реакційну суміш перемішують при прийнятній температурі, наприклад, 40 °C, протягом прийнятного періоду часу, наприклад, 3 годин. Продукт (IV), в якому Z є (3,4-диметоксифеніл)метанаміном виділяють після обробки водою та очистки. Альтернативно, сполуку формули (IV) Z=OH розчиняють в прийнятному розчиннику, наприклад, ацетонітрилі, в присутності прийнятного конденсуючого агента, наприклад, ((1Hбензо[d][1,2,3]триазол-1-іл)окси)три(піролідин-1-іл)фосфонію гексафлу-орфосфату (V), та основи, наприклад, 1,8-діазабіцикло[5,4,0]ундек-7-ена, обробляють прийнятним аміном, наприклад, (2,4-диметоксифеніл)метанаміном. Реакційну суміш перемішують при прийнятній температурі, наприклад, 20 °C, протягом прийнятного періоду часу, наприклад, 6 годин. Продукт (IV), в якому Z є (3,4-диметоксифеніл)метанаміном виділяють після відокремлення від побічних продуктів шляхом фільтрації та очистки. Сполуки формули (IV), в яких Z є OH групою, можуть одержувати за реакцією сполук формули (XII): в якій R1 є таким, як визначено в даному документі раніше для сполуки формули (I), з галогенуючим реагентом, наприклад, N-йодсукцинімідом. Наприклад, сполуку формули (XII) розчиняють в прийнятному розчиннику, наприклад, N, Nдиметилформаміді, та піддають взаємодії з N-йодсукцинімідом при прийнятній температурі, наприклад, 60 °C протягом прийнятного періоду часу, наприклад, 1 – 2 години. Продукт (XII) виділяють після обробки водою та очистки. Сполуки формули (XII) можуть одержувати за реакцією сполук формули (XIII): в яких R1 є таким, як визначено в даному документі раніше для сполуки формули (I), з прийнятною основою, наприклад, гідроксидом натрію. Розчин сполук формули (XIII) в прийнятному розчиннику, наприклад, етиловому спирті, обробляють водним розчином гідроксиду натрію та реакційну суміш перемішують при прийнятній температурі, наприклад 80– 100 °C протягом прийнятного періоду часу, наприклад, 1 – 4 години. Продукт (XII) виділяють після обробки водою та очистки. Сполуки формули (XIII) можуть одержувати за реакцією сполук формули (XIV): зі сполуками формули (XII): 40 45 , в яких R1 є таким, як визначено в даному документі раніше для сполуки формули (I). Наприклад, суміш зі сполуки формули (XIV) та сполуки формули (XV) обробляють розчином гідрогенхлориду в прийнятному розчиннику, наприклад, розчином гідрогенхлориду в 1,4-діоксані та нагрівають при прийнятній температурі, 60 – 80 °C протягом прийнятного періоду часу, наприклад, 16 – 24 годин. Продукт (XIII) виділяють після випаровування розчинника. Сполуки формул (VI), (VII), (XIV) та (XV) є або відомими з літератури або є комерційно доступними, наприклад, від Sigma-Aldrich, UK, або можуть одержувати за аналогією з відомими 10 UA 114109 C2 5 10 15 20 25 30 35 40 45 50 55 60 процедурами, наприклад, такими, що розкриті в загальноприйнятих референтних джерелах синтетичної методології, таких як J. March, Advanced Organic Chemistry, 6th Edition (2007), WileyBlackwell, або Comprehensive Organic Synthesis (Trost B.M. та Fleming I., (Eds.), Pergamon Press, 1991), кожне включене в даний документ у вигляді посилання, як такі, що стосуються такої методики. Приклади інших захисних груп, які можуть застосовувати в синтетичних способах, що описані в даному документі, та способи їх видалення можуть бути знайдені в T. W. Greene "Protective Groups in Organic Synthesis", 4th Edition, J. Wiley та Sons, 2006, включеному в даний документ у вигляді посилання, як такий, що стосується таких методик. Для будь-яких описаних в даному документі раніше реакцій або процесів, можуть застосовувати загальноприйняті способи нагрівання та охолодження, наприклад, олійні бані з регулюванням температури або блоки-нагрівання з регулюванням температури, та крижано/сольові бані або бані з сухою кригою/ацетоном, відповідно. Загальноприйняті способи виділення, наприклад, екстракцію з або в водні або неводні розчинники, можуть застосовувати. Загальноприйняті способи осушування органічних розчинників, розчинів або екстрактів, такі як струшування з безводним сульфатом магнію, або безводним сульфатом натрію, або пропускання через гідрофобну фрітту, можуть застосовувати. Загальноприйняті способи очистки, наприклад, кристалізацію та хроматографію, наприклад, силікагелеву хроматографію або хроматографію з оберненою фазою, можуть застосовувати, якщо необхідно. Кристалізацію можуть виконувати, застосовуючи загальноприйняті розчинники, такі як етилацетат або метанол, етанол або бутанол, та їх водні суміші. Слід мати на увазі, що конкретний час реакції, температури зазвичай можуть визначата з використанням методик відслідковування перебігу реакції, наприклад, тонкошаровою хроматографією та РХ-МС. У разі необхідності індивідуальні ізомерні форми сполук винаходом можуть одержувати як індивідуальні ізомери, застосовуючи загальноприйняті методики, такі як фракційна кристалізація діастереоізомерних похідних або хіральна високоефективна рідинна хроматографія (хіральна ВЕРХ). Абсолютну стереохімію сполук можуть визначати, застосовуючи загальноприйняті способи, такі як рентгенівська кристалографія. Способи застосування Приклади хворобливих станів, при яких сполуки формули (I) та їх фармацевтично прийнятні солі мають потенційно сприятливий вплив, включають алергічні захворювання та інші запальні стани, наприклад, алергічний реніт та астма, інфекційні захворювання та рак. Сполуки формули (I) та їх фармацевтично прийнятні солі, крім того, мають потенційне застосування як допоміжного засобу вакцини. Як модулятори імуної відповіді, сполуки формули (I) та їх фармацевтично прийнятні солі також можуть бути корисними в лікуванні та/або попередженні іммуноопосредованних розладів, включаючи, але не обмежуючись цим, запальні або алергічні захворювання, такі як астма, алергічний реніт та ринокон'юнктивіт, харчова алергія, захворювання, пов'язані з гіперчутливістю легень, еозинофільна пневмонія, розлади, пов'язані з гіперчутливістю уповільненого типу, атеросклероз, панкреатит, гастрит, коліт, остеоартрит, псоріаз, саркоїдоз, фіброз легенів, респіраторний дистрес-синдром, бронхіт, хронічне обструктивне захворювання легень, синусит, кістозний фіброз, актинічний кератоз, дисплазія шкіри, хронічна кропив'янка, екзема та всі типи дерматиту. Сполуки формули (I) та їх фармацевтично прийнятні солі також можуть бути корисними в лікуванні та/або попередженнї реакцій на респіраторні інфекції, включаючи, але не обмежуючись цим, вірусні подразнення дихальних шляхів та тонзиліт. Сполуки також можуть бути корисними в лікуванні та/або попередженні аутоімунних захворювань, включаючи, але не обмежуючись цим, ревматоїдний артрит, псоріатичний артрит, системний червоний вовчак, захворювання Шегрена, анкилозуючий спондилоартрит, склеродермія, дерматоміозит, цукровий діабет, відторгнення трансплантата, включаючи захворювання трансплантат проти господаря, запальні захворювання кишечника, включаючи, але не обмежуючись цим, хворобу Крона та неспецифічний виразковий коліт. Сполуки формули (I) та їх фармацевтично прийнятні солі також можуть бути корисними в лікуванні інфекційних захворювань, включаючи, але не обмежуючись цим, ті, що викликані вірусами гепатиту (наприклад, вірус гепатиту В, вірус гепатиту С), вірусом імунодефіциту людини, папіломавірусами, герпесвірусами, респіраторними вірусами (наприклад, вірусами грипу, респіраторно-синцитіальним вірусом, риновірусом, метапневмовірусом, вірусом парагрипу, SARS), та вірусом Західного Нілу. Сполуки формули (I) та їх фармацевтично прийнятні солі також можуть бути корисними в лікуванні мікробних інфекцій, викликаних, 11 UA 114109 C2 5 10 15 20 25 30 35 40 45 50 55 60 наприклад, бактеріями, грибами, найпростішими. До них належать, але не обмежуються цим, туберкульоз, бактеріальна пневмонія, аспергільоз, гістоплазмоз, кандидоз, пневмоцистоз, проказа, хламідіоз, криптококове захворювання, криптоспоридіоз, токсоплазмоз, лейшманія, малярія та трипаносомоз. Сполуки формули (I) та їх фармацевтично прийнятні солі також можуть бути корисними в лікуванні різних видів раку, зокрема, в лікуванні різних видів раку, які, як відомо, є реактивним до імунотерапії та, включаючи, але не обмежуючись цим, нирково-клітинну карциному, рак легенів, рак молочної молочної залози, колоректальний рак, рак сечового міхура, меланому, лейкоз, лімфому та рак яєчників. Кваліфікованому фахівцю в даній галузі буде зрозуміло, що посилання в даному документі на лікування або терапію можуть, в залежності від стану, поширюється на профілактику, а також на лікування встановлених станів.Таким чином, передбачається, як наступний аспект винаходу, сполука формули (I), або її фармацевтично прийнятна сіль, для застосування в терапії. Слід мати на увазі, що, коли сполуку формули (I) або її фармацевтично прийнятну сіль застосовують в терапії, її застосовують як активний терапевтичний агент. Крім того, таким чином, передбачається сполука формули (I), або її фармацевтично прийнятну сіль, для застосування в лікуванні алергічних захворювань та інших запальних станів, інфекційних захворювань або раку. Крім того, таким чином, передбачається сполука формули (I), або її фармацевтично прийнятну сіль, для застосування в лікуванні алергічного реніту. Крім того, таким чином, передбачається сполука формули (I), або її фармацевтично прийнятну сіль, для застосування в лікуванні астми. Крім того, передбачається застосування сполуки формули (I), або її фармацевтично прийнятної солі, у виробництві лікарського засобу для лікування алергічних захворювань та інших запальних станів, інфекційних захворювань або раку. Крім того, передбачається застосування сполуки формули (I), або її фармацевтично прийнятної солі, у виробництві лікарського засобу для лікування алергічного реніту. Крім того, передбачається застосування сполуки формули (I), або її фармацевтично прийнятної солі, у виробництві лікарського засобу для лікування астми. Крім того, передбачається спосіб лікування алергічних захворювань та інших запальних станів, інфекційних захворювань або раку, де спосіб включає введення суб'єкту людині, яка потребує цього, терапевтично ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі. Крім того, передбачається спосіб лікування алергічного реніту, де спосіб включає введення суб'єкту людині, яка потребує цього, терапевтично ефективної кількості сполуки формули (I), або її фармацевтично прийнятної солі. Крім того, передбачається спосіб лікування астми, де спосіб включає введення суб'єкту людині, яка потребує цього, терапевтично ефективної кількості сполуки формули (I), або її фармацевтично прийнятної солі. Сполуки формули (I) або її фармацевтично прийнятні солі також є потенційними в застосуванні, як допоміжного засобу вакцини. Таким чином, передбачається, як наступний аспект винаходу, вакцинна композиція, яка містить сполуку формули (I), або її фармацевтично прийнятну сіль, та антиген або антигенну композицію для застосування в терапії. Таким чином, передбачається, як наступний аспект винаходу, застосування сполуки формули (I), або її фармацевтично прийнятної солі, та антигену або антигенної композиції у виробництві лікарського засобу для застосування в терапії. Крім того, передбачається спосіб лікування або попередження захворювання, який включає введення суб'єкту людині, що страждає від або є схильним до захворювання, вакцинної композиції, що містить сполуку формули (I), або її фармацевтично прийнятну сіль, та антиген або антигенну композицію. Крім того, передбачається застосування вакцинної композиції у виробництві лікарського засобу для терапії. Композиції Сполуки формули (I) та їх фармацевтично прийнятні солі будуть, як правило, але не обов'язково, сформульованими в фармацевтичні композиції до введення пацієнту. Відповідно, в іншому аспекті винаходу передбачається фармацевтична композиція, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль, та один або більше фармацевтично прийнятних ексципієнтів. Сполуки формули (I) та їх фармацевтично прийнятні солі можуть бути сформульованими 12 UA 114109 C2 5 10 15 20 25 30 35 40 45 50 55 60 для введення будь-яким загальноприйнятим шляхом. Сполуки формули (I) та їх фармацевтично прийнятні солі, наприклад, можуть бути сформульованими для перорального, місцевого, інгаляційного, інтраназального, букального, парентерального (наприклад, внутрішньовенного, підшкірного, внутрішньошкірного або внутрішньом'язового) або ректального введення. В одному аспекті, сполуки формули (I) та їх фармацевтично прийнятні солі формулюють для перорального введення. В іншому аспекті, сполуки формули (I) та їх фармацевтично прийнятні солі формулюють для місцевого введення, наприклад, інтраназального або інгаляційного введення. Таблетки та капсули для перорального введення можуть містити загальноприйняті ексципієнти, такі як в'яжучі агенти, наприклад, сироп, камедь, желатин, сорбіт, трагакант, слиз крохмалю, целюлоза або полівінілпіролідон; наповнювачі, наприклад, лактозу, мікрокристалічну целюлозу, цукор, кукурудзяний крохмаль, фосфат кальцію або сорбітол; змащувальні речовини, наприклад, стеарат магнію, стеаринову кислоту, тальк, поліетиленгліколь або окис силіцію; розпушувачі, наприклад, картопляний крохмаль, кроскармелозу натрію або натрію крохмальгліколят; або змочуючі агенти, такі як натрію лаурилсульфат. Таблетки можуть бути вкритими відповідно до способів, добре відомих в даній галузі з рівня техніки. Пероральні рідкі препарати можуть бути у формі, наприклад, водних або олійних суспензій, розчинів, емульсій, сиропів або еліксирів, або можуть бути представлені у вигляді сухого продукту для розбавлення водою або іншим прийнятним носієм перед застосуванням. Такі рідкі препарати можуть містити загальноприйняті добавки, такі як суспендуючі агенти, наприклад, сироп сорбіту, метилцелюлозу, глюкозний/цукровий сироп, желатин, гідроксиметилцелюлозу, карбоксиметилцелюлозу, гель стеарату алюмінію або гідрогеновані харчові жири; емульгуючи агенти, наприклад, лецитин, моно-олеат сорбітану або гуміарабік; неводні носії (які можуть включати харчові олії), наприклад, мигдальну олію, фракціоновану кокосову олію, олійні естери, пропіленгліколь або етиловий спирт; або консерванти, наприклад, метил або пропіл пгідроксибензоати або сорбінову кислоту. Препарати можуть також містити буферні солі, ароматизатори, барвники та/або підсолоджуючі агенти (наприклад, маніт), якщо необхідно. Композиції для інтраназального введення включае водні композиції, які вводять в ніс у вигляді крапель або з допомогою насоса під тиском. Прийнятні композиції містять воду як розріджувач або носій для даної мети. Композиції для введення в легені або ніс можуть містити один або більше ексципієнтів, наприклад, один або більше суспендуючих агентів, один або більше консервантів, одну або більше поверхнево-активних речовин, один або більше агентів, що регулюють тонічність, один або більше співрозчинників, та можуть включати компоненти щодо контролю pH композиції, наприклад, буферну систему. Крім того, композиції можуть містити інші ексципієнти, такі як антиоксиданти, наприклад, натрію метабісульфіт, та агенти, що маскують смак. Композиції можуть також вводити в ніс або в інші частини дихальних шляхів з допомогою розпилювача. Інтраназальні композиції можуть дати сполуці(кам) формули (I) або їх фармацевтично прийнятній(им) солі(ям) досягати всіх ділянок носової порожнини (мішенні тканини) та, крім того, можуть дати сполуці(кам) формули (I) або їх фармацевтично прийнятній(им) солі(ям) залишатися в контакті з мішенною тканиною протягом довших періодів часу. Прийнятний режим дозування для інтраназальних композицій повинен бути для пацієнта таким, щоб вдихати повільно через ніс з подальшим очищенням носової порожнини. Під час інгаляції композицію повинні вводити в одну ніздрю, тоді як іншу затискають рукою. Дану процедуру потім треба повторити для іншої ніздрі. Як правило, одне або два розпилення на ніздрю треба вводити, застосовуючи описану вище процедуру один, два або три рази кожного дня, в ідеалі, один раз на день. Особливий інтерес викликають інтраназальні композиції, прийнятні для введення один раз на день. Суспендуючий(і) агент(и), якщо включені, якправило, будуть присутніми в кількості від 0,1 до 5 % (мас./мас.), такій як від 1,5 % до 2,4 % (мас./мас.), ґрунтуючись на загальній масі композиції. Приклади фармацевтично прийнятних суспендуючих агентів включають, але не ® обмежуються цим, Avicel (мікрокристалічну целюлозу та карбоксиметилцелюлозу натрію), карбоксиметилцелюлозу натрію, вігум, трагакант, бентоніт, метилцелюлозу, ксантанову камедь, карбопол та поліетиленгліколі. Композиції для введення в легені або ніс можуть містити один або більше ексципієнтів, можуть бути захищеними від мікробного або грибкового зараження та росту шляхом включення одного або більше консервантів. Приклади фармацевтично прийнятних антимікробних агентів або консервантів включають, але не обмежуються цим, кватернізовані амонійні сполуки (наприклад, бензалконію хлорид, бензетонію хлорид, цетримід, цетилпіридинію хлорид, лауралконію хлорид та міристилпіколінію хлорид), ртутні агенти (наприклад, фенілртуті нітрат, 13 UA 114109 C2 5 10 15 20 25 30 35 40 45 50 55 60 фенілртуті ацетат та тимеросал), спиртові агенти (наприклад, хлорбутанол, фенілетиловий спирт та бензиловий спирт), антибактеріальні естери (наприклад, естери парагідроксибензойної кислоти), хелатуючі агенти, такі як динатрію едетат (ЕДТА) та інші антимікробні агенти, такі як хлоргексидин, хлоркрезол, сорбінова кислота та її солі (такі як, сорбат калію) та поліміксин. Приклади фармацевтично прийнятних протигрибкових агентів або консервантів включають, але не обмежуються цим, натрію бензоат, сорбінову кислоту, натрію пропіонат, метилпарабен, етилпарабен, пропілпарабен та бутилпарабен. Консервант(и), якщо включені, можуть бути присутніми в кількості від 0,001 до 1 % (мас./мас.), такій як від 0,015 % до 0,5 % (мас./мас.), ґрунтуючись на загальній масі композиції. Композиції (наприклад, в якій щонайменше одна сполука знаходиться в суспензії) можуть включати одну або більше поверхнево-активних речовин, функції яких полягають в сприянні розчинення частинок медикаменту в водній фазі композиції. Наприклад, кількість поверхневоактивної речовини, яку використовують, представляє собою кількість, яка не буде викликати утворення піни під час змішування. Приклади фармацевтично прийнятних поверхнево-активних речовин включають жирні спирти, естери та етери, такі як поліоксіетилен (20) сорбітану моноолеат (Полісорбат 80), макрогольні етери та полоксамери. Поверхнево-активна речовина може бути присутньою в кількості від приблизно 0,01 до 10 % (мас./мас.), такій як від 0,01 до 0,75 % (мас./мас.), наприклад, приблизно 0,5 % (мас./мас.), ґрунтуючись на загальній масі композиції. Один або більше агент(ів), що регулює(ють) тонічність, можуть бути включеними для досягнення тонічності такої як у рідин організма, наприклад, рідин назальної порожнини, в результаті одержуючи знижені рівні подразнення. Приклади фармацевтично прийнятного агента, що регулює тонічності, включають, але не обмежуються цим, натрію хлорид, декстрозу, ксилітол, кальцію хлорид, глюкозу, гліцерин та сорбіт. Агент, що регулює тонічність, якщо присутній, може бути включеним в кількості від 0,1 до 10 % (мас./мас.), такій як від 4,5 до 5,5 % (мас./мас.), наприклад, приблизно 5,0 % (мас./мас.), ґрунтуючись на загальній масі композиції. Композиції за винаходом можуть бути буферизованими шляхом додавання прийнятних буферних агентів, таких як цитрат натрію, лимонна кислота, трометамол, фосфати, такі як динатрію фосфат (наприклад, додекагідратна, гептагідратна, дигідратна та безводна форми) або натрію фосфат та їх суміші. Буферний агент, якщо присутній, може бути включеним в кількості від 0,1 до 5 % (мас./мас.), наприклад від 1 до 3 % (мас./мас.), ґрунтуючись на загальній масі композиції. Приклади агентів, що маскують смак, включають сукралозу, сахарозу, сахарин або його сіль, фруктозу, декстрозу, гліцерин, кукурудзяний сироп, аспартам, ацесульфам-К, ксиліт, сорбіт, еритрит, гліциррізинат, тауматин, неотам, маніт, ментол, евкаліптову олію, камфару, природній ароматизуючий агент, штучний ароматизуючий агент, а також їх комбінації. Один або більше співрозчинник(и) можуть бути включеними, щоб сприяти розчиненню лікарської(их) сполуки() та/або інших ексципієнтів. Приклади фармацевтично прийнятних співрозчинників включають, але не обмежуються цим, пропіленгліколь, дипропіленгліколь, етиленгліколь, гліцерин, етанол, поліетиленгліколі (наприклад, PEG300 або PEG400) та метанол. В одному варіанті втілення, співрозчинником є пропіленгліколь. Співрозчинник(и), якщо присутній, може бути включеним в кількості від 0,05 до 30 % (мас./мас.), такій як від 1 до 25 % (мас./мас.), наприклад, від 1 до 10 % (мас./мас.), ґрунтуючись на загальній масі композиції. Композиції для інгаляційного введення включають водні, органічні або водно/органічні суміші, сухі порошкові або кристалічні композиції, які вводять в дихальні шляхи з допомогою наноса під тиском або інгалятора, наприклад, балончикових сухих порошкових інгаляторів, одноразових дозованих сухих порошкових інгаляторів, сухих порошкових інгаляторів з попередньо відміряними багаторазовими дозами, назальних інгаляторів або аерозольних інгаляторів під тиском, небулайзерів або інсуфляторів. Прийнятні композиції містять воду як розріджувач або носій для даної мети, та загальноприйняті ексципієнти, такі як буферні агенти, агенти, що модифікують тонічність, тощо, можуть бути передбаченими в них. Водні композиції також можуть вводитись в ніс та інші частини дихальних шляхів з допомогою розпилювання. Такі композиції можуть бути водними розчинами, або суспензіями, або аерозолями, які випускаються з пакування під тиском, таких як інгалятор з відміряними дозами, із застосуванням прийнятного скрапленого пропеллента. Композиції для введення місцево в ніс (наприклад, для лікування риніту) або в легені, включають аерозольні композиції під тиском та водні композиції, які доставляють в носові порожнини з допомогою наноса під тиском. Композиції, які знаходяться не під тиском та є прийнятними для введення місцево в носову порожнину, є особливо цікавими. Прийнятні 14 UA 114109 C2 5 10 15 20 25 30 35 40 45 50 55 60 композиції містять воду як розріджувач або носій для даної мети. Водні композиції для введення в легені або ніс можуть передбачатися з загальноприйнятими ексципієнтами, такими як буферні агенти, агенти, що модифікують тонічність, тощо. Водні композиції також можуть вводитись в ніс з допомогою розпилення. Розпилювач рідини можуть, як правило, використовувати для доставки рідкої композиції в носову порожнину. Рідка композиція може бути водною або неводною, але, як правило, водна. Сполука формули (I) або її фармацевтично прийнятна сіль, може бути сформульованою у вигляді суспензії або розчину. Такий розпилювач рідини може мати дозуючу насадку або дозуючий отвір, через який відміряну дозу рідкої композиції розпилюють при застосуванні користувачем з використанням сили, до механізму насоса розпилювача рідини. Такі дозатори рідини, як правило, є забезпеченими резервуаром для декількох відміряних доз рідкої композиції, де дози є здатними до розпилення при послідовних спрацьовуваннях насоса. Альтернативно, розпилювач рідини для доставки рідкої композиції в носові порожнини може бути створеним з обмеженням дози, наприклад, розпилювач одноразового використання, що містить одну дозу. Дозуючій насадці або отвору може надаватися форма для вставки в ніздрі користувача для розпилення дозування рідкої композиції в порожнину носа. Дозатор рідини вищевказаного типу є описаним та проілюстрованим у міжнародній публікації заявки на патент WO 2005/044354 (Glaxo Group Limited). Розпилювач має корпус, який має пристрій для випускання рідина, що має компресійний насос, встановлений на контейнері, що вміщує рідку композицію. Корпус має щонайменше один палець, що функціонує бічним важелем, який є рухомим в середині по відношенню до корпусу, щоб перемістити контейнер вгору в корпусі з допомогою кулачка, щоб спричинити насосом стиснення та накачати відміряну дозу композиції з основи насоса в носову насадку корпусу. В одному варіанті втілення, розпилювач рідини є загального типу, проілюстрований на фігурах 30-40 WO 2005/044354. Водні композиції, що містять сполуку формули (I) або її фармацевтично прийнятну сіль, можуть бути також доставлені з допомогою насосу, як розкрито в міжнародній публікації заявки на патент за номером WO2007/138084 (Glaxo Group Limited), наприклад, як розкрито в їх посиланнях на фігури 22-46, або як розкрито в заявці на патент Великобританії за номером GB0723418,0 (Glaxo Group Limited), наприклад, як розкрито в їх посиланнях на фігури 7-32. Насос може приводитися в дію приводом, як описано на фігурах 1-6 GB0723418,0. Сухі порошкові композиції для місцевої доставки в легені шляхом інгаляції можуть, наприклад, бути присутніми в капсулах та картриджах, наприклад, желатинових, або блістерах, наприклад, з ламінованої алюмінієвої фольги, для застосування в інгаляторі або інсуфляторі. Порошкові змішані композиції, як правило, містять порошкову суміш для інгаляції зі сполуки формули (I) або її фармацевтично прийнятної солі та прийнятної порошкової основи (носій/розріджувач/допоміжна речовина), такої як моно-, ди- або полісахариди (наприклад, лактоза або крохмаль). Сухі порошкові композиції, крім того, можуть включати, на додаток до лікарської речовини та носія, додатковий ексципієнт (наприклад, трикомпонентний агент, такий як естер цукру, наприклад, целобіозу октаацетат, стеарат кальцію або стеарат магнію). В одному варіанті втілення, композиція прийнятна для інгаляційного введення може бути включеною в більшість герметичних дозованих контейнерів, що забезпечує пакування лікарського засобу, що зберігаються в середині прийнятного пристрою для інгаляції. Контейнери можуть бути розривними, відривними, або такими, що відкриваються іншим чином, по одному, та дози сухої порошкової композиції вводять шляхом інгаляції з допомогою мундштука в пристрої для інгаляції, як відомо в даній галузі з рівня техніки. Пакування лікарського засобу можуть приймати ряд різних форм, наприклад, у формі диску або подовженої смужки. Типовими TM представниками пристроїв для інгаляції є пристрої DISKHALER™ та DISKUS , виведені на ринок компанією GlaxoSmithKline. Сухі порошкові інгаляційні композиції також можуть бути представлені як об'ємна ємність в пристрої для інгаляції, де потім пристрій забезпечується механізмом, який відміряє, для відмірювання дози композиції з ємності в інгаляційний канал, де відміряна доза є здатною для того, щоб бути інгаляційно введеною пацієнту при вдиху з допомогою мундштуку пристрою. Ілюстративними пристроями, представленими на ринку, даного типу є TURBUHALER™ (AstraZeneca), TWISTHALER™ (Schering) та CLICKHALER™ (Innovata.) Наступним способом доставки для сухих порошкових інгаляційних композицій є відмірювання дози композиції, що є представленими в капсулах (одна доза на капсулу), які потім завантажуються в пристрій для інгаляції, як правило, пацієнтом при необхідності. Пристрій має засіб для розриву, проколу та іншого відкриття капсули таким чином, що доза є здатною для захоплення легенями пацієнта, коли вони вдихають через мундштук пристрою. Як представлено на ринку серед прикладів таких пристроїв можуть бути згадані ROTAHALER™ 15 UA 114109 C2 5 10 15 20 25 30 35 40 45 50 55 60 (GlaxoSmithKline) та HANDIHALER™ (Boehringer Ingelheim.) Аерозольні композиції під тиском, прийнятні для інгаляції можуть бути або суспензією або розчином, та можуть містити сполуку формули (I) або її фармацевтично прийнятну сіль та прийнятний пропелент, такий як флуоркарбон або гідроген-вмісний хлорфлуоркарбон, або їх суміші, зокрема гідрофлуоралкани, а саме 1,1,1,2-тетрафлуоретан, 1,1,1,2,3,3,3-гептафлуор-нпропан або їх суміш. Аерозольна композиція необов'язково може містити додаткові ексципієнти композиції, добре відомі в даній галузі з рівня техніки, такі як поверхнево-активні речовини, наприклад, олеїнова кислота, лецитин, або олігомолочна кислота, або її похідна, наприклад, як описано в WO 94/21229 та WO 98/34596 (Minnesota Mining та Manufacturing Company) та спів розчинники, наприклад, етанол. Композиції під тиском, як правило, будуть зберігатися в балончиках (наприклад, алюмінієвому балончику), закритих клапаном (наприклад, дозувальним клапаном) та вбудованим механізмом, оснащених мундштуком. Мазі, креми та гелі, наприклад, можуть бути сформульованими з водною або олійною основою з додаванням прийнятного загущуючого та/або желюючого агента, та/або розчинників. Такі основи, таким чином, можуть, наприклад, включати воду та/або олію, таку як рідкий парафін або рослинна олія, така як арахісова олія або касторова олія, або розчинник, такий як поліетиленгліколь. Загущуючі агенти та желюючі агенти, які можуть застосовувати відповідно до природи основи включають м'який парафін, стеарат алюмінію, цетостеариловий спирт, поліетиленгліколі, ланолін, бджолиний воск, карбоксиполіметилен та похідні целюлози, та/або гліцерилу моностеарат та/або неіонні емульгуючі агенти. Лосьйони можуть бути сформульованими з водною або олійною основою та, як правило, також будуть містити один або більше емульгуючих агентів, стабілізуючих агентів, диспергуючих агентів, суспендуючих агентів або загущуючих агентів. Порошки для зовнішнього застосування можуть бути утворені з допомогою будь-якої прийнятної порошкової основи, наприклад, тальку, лактози або крохмалю. Краплі можуть бути сформульованими з водною або неводною основою, які також містять один або більше диспергуючих агентів, солюбілізуючих агентів, суспендуючих агентів або консервантів. Сполуки формули (I) та їх фармацевтично прийнятні солі, наприклад, можуть бути сформульованими для трансдермальної доставки з допомогою композиції в пластирях або інших пристроях (наприклад, газових пристроях під тиском), які доставляють активний компонент в шкіру. Для букального введення композиції можуть приймати форму таблеток або пастилок для розсмоктування, сформульованих за загальноприйнятим способом. Сполуки формули (I) та їх фармацевтично прийнятні солі також можуть бути сформульованими як супозиторії, наприклад, які містять загальноприйняті основи для супозиторіїв, такі як масло какао або інші гліцериди. Сполуки формули (I) та їх фармацевтично прийнятні солі також можуть бути сформульованими для парентерального введення шляхом болюсної ін'єкції або безперервної інфузії та можуть бути представлені в одиничній дозованій формі, наприклад, у вигляді ампул, флаконів, невеликого об'єму інфузій або попередньо наповнених шприців, або в формі багато дозованих контейнерів з додаванням консерванту. Композиції можуть приймати такі форми, як розчини, суспензії або емульсії в водних або неводних носіях, та можуть містити композиційні агенти, такі як антиоксиданти, буфери, протимікробні агенти та/або агенти, що регулюють тонічність. Альтернативно, активний інгредієнт може бути у формі порошку в складі з прийнятним носієм, наприклад, стерильною, апірогенною водою, перед застосуванням. Форму випуску сухої твердої речовини можуть одержувати шляхом заповнення стерильного порошку асептично в індивідуальні стерильні контейнери або шляхом заповнення стерильного розчину асептично в кожен контейнер висушування його при заморожуванні. Сполуки формули (I) та їх фармацевтично прийнятні солі також можуть бути сформульованими з вакцинами як допоміжні речовини для модулювання їх активності. Такі композиції можуть містити антитіло(а), або фрагмент(и) антитіла, або антигенний компонент, включаючи але не обмежуючись цим, протеїн, ДНК, жіві або мертві бактерії та/або віруси, або вірусоподібні частки, разом з одним або більше компонентами з допоміжною активністю, включаючи, але не обмежуючись цим, солі алюмінію, олійні та водні емульсії, протеїни теплового шоку, препарати та похідні ліпіду А, гліколіпіди, інші TLR агоністик, такі як CpG ДНК або подібні агенти, цитокіни, такі як GM-CSF або IL-12 або подібні агенти. В іншому аспекті за винаходом, передбачається вакцинний ад'ювант, що містить сполуку формули (I) або її фармацевтично прийнятну сіль. Крім того, передбачається вакцинна композиція, що містить сполуку формули (I), або її фармацевтично прийнятну сіль, та антиген або антигенну композицію. 16 UA 114109 C2 5 10 15 20 25 30 35 40 45 50 55 60 Сполуки формули (I) та їх фармацевтично прийнятні солі можуть застосовувати самостійно або в комбінації з іншими терапевтично активними агентами. Винахід в іншому аспекті передбачає, комбінацію, що містить сполуку формули (I), або її фармацевтично прийнятну сіль, разом з щонайменше одним іншимтерапевтично активним агентом. Сполуки формули (I) та їх фармацевтично прийнятні солі, та інший(і) терапевтично активний(і) агент(и) можуть вводити разом або по-окремості та, коли вводять по-окремості, введення можуть здійснювати одночасно або послідовно, в будь-якому порядку. Кількості сполуки() формули (I) або їх фармацевтично прийнятної(их) солі(ей) та іншого(их) терапевтично активного(а) агента(ів) та відносні періоди часу введення будуть вибиратися таким чином, щоб досягти бажаний комбінований терапевтичний ефект. Введення комбінації сполуки формули (I) або її фармацевтично прийнятної солі з іншими лікарськими агентами можуть здійснювати шляхом одночасного введення в одиничній фармацевтичній композиції, що включає обидві сполуки, або в окремих фармацевтичних композиціях, кожна з яких включає одну зі сполук. Альтернативно, комбінацію можуть вводити по-окремості послідовним способом, за яким один лікарський агент вводять першим та інший – другим або навпаки. Таке послідовне введення можуть бути близькими в часі або рознесеними в часі. Сполуки формули (I) та їх фармацевтично прийнятні солі можуть застосовувати в комбінації з одним або більше агентами корисними для попередження або лікування вірусних інфекцій. Приклади таких агентів включають, без обмеження; інгібітори полімерази, такі як ті, що розкриті в WO 2004/037818-A1, а також ті, що розкриті в WO 2004/037818 та WO 2006/045613; JTK-003, JTK-019, NM-283, HCV-796, R-803, R1728, R1626, а також ті, що розкриті в WO 2006/018725, WO 2004/074270, WO 2003/095441, US2005/0176701, WO 2006/020082, WO 2005/080388, WO 2004/064925, WO 2004/065367, WO 2003/007945, WO 02/04425, WO 2005/014543, WO 2003/000254, EP 1065213, WO 01/47883, WO 2002/057287, WO 2002/057245 та подібні агенти; інгібітори реплікації, такі як ацикловір, фамцикловір, ганцикловір, цидофовір, ламівудин та подібні агенти; інгібітори протеази, такі як інгібітори ВІЛ протеази саквінавір, ритонавір, індинавір, нелфінавір, ампренавір, фосампренавір, бреканавір, атазанавір, тіпранавір, палінавір, ласінавір, та інгібітори HCV протеази BILN2061, VX-950, SCH503034; та подібні агенти; інгібітори нуклеозидної та нуклеотидної зворотної транскриптази, такі як зидовудин, диданозин, ламівудин, зальцитабін, абакавір, ставудин, адефовір, адефовіру дипівоксил, фозивудин, тодоксил, емтрицитабін, аловудин, амдоксовір, елвуцитабін та подібні агенти; інгібітори ненуклеозидної зворотної транскриптази (включаючи агент, що має антиоксидантну активність, такий як імунокал, олтипраз, тощо), такі як невірапін, делавірдин, ефавіренц, ловірид, імунокал, олтипраз, каправірин, TMC-278, TMC-125, етравірин, та подібні агенти; інгібітори проникнення в клітину, такі як енфувіртид (T-20), T-1249, PRO-542, PRO-140, TNX-355, BMS-806, 5-Helix та подібні агенти; інгібітори інтегрази, такі як L-870,180 та подібні агенти; інгібітори проростання, такі як PA-344 та PA-457, та подібні агенти; інгібітори хемокінового рецептора, такі як вікрівірок (Sch-C), Sch-D, TAK779, маравірок (UK-427,857), TAK449, а також ті, що розкриті в WO 02/74769, WO 2004/054974, WO 2004/055012, WO 2004/055010, WO 2004/055016, WO 2004/055011 та WO 2004/054581, та подібні агенти; інгібітори нейрамінідази, такі як CS-8958, занамівір, оселтамівір, перамівір та подібні агенти; блокатори іонних каналів, такі як амантадин або римантадин та подібні агенти; та інтерферуючі РНК та антисмислові олігонуклеотиди, та такі як ISIS-14803 та подібні агенти; противірусні агенти невизначеного механізму дії, наприклад, ті, що розкриті в WO 2005/105761, WO 2003/085375, WO 2006/122011, рибавірин та подібні агенти. Сполуки формули (I) та їх фармацевтично прийнятні солі також можуть застосовувати в комбінації з одним або більше іншими агентами, які можуть бути корисними в попередженні або лікуванні вірусних інфекцій, наприклад, імунотерапії (наприклад, інтерферон або інші цитокіни/хемокіни, модулятори цитокінового/хемокінового рецептору, агоністи або антагоністи цитокіну та подібні агенти); та терапевтичні вакцини, антифібротичні агенти, протизапальні агенти, такі як кортикостероїди або НСПЗА (нестероїдні протизапальні агенти) та подібні агенти. Сполуки формули (I) та їх фармацевтично прийнятні солі можуть застосовувати в комбінації з один або більше іншими агентами, які можуть бути корисними для попередження або лікування алергічного захворювання, запального захворювання, аутоімуного захворювання, наприклад; антигенної імунотерапії, антигістаміни, стероїди, НСПЗА, бронходилататор (наприклад, бета 2 агоністи, адренергічні агоністи, антихолінергічні агенти, теофілін), метотрексат, лейкотриєнові модулятори та подібні агенти; терапії моноклональними антитілами, такими як анти-IgE, анти-TNF, анти-IL-5, анти-IL-6, анти-IL-12, анти-IL-1 та подібні агенти; рецепторні терапії, наприклад, етанерцепт та подібні агенти; антиген неспецифічних імунотерапій (наприклад, інтерферон або інші цитокіни/хемокіни, модулятори 17 UA 114109 C2 5 10 15 20 25 30 35 40 45 50 55 цитокінового/хемокінового рецептору, агоністи або антагоністи цитокіну, TLR агоністи та подібні агенти). Сполуки формули (I) та їх фармацевтично прийнятні солі можуть застосовувати в комбінації з одним або більше іншими агентами, які можуть бути корисними для попередження або лікування раку, наприклад, хіміотерапії, такими як алкілуючі агенти, інгібітори топоізомерази, антиметаболіти, антимітотичні агенти, інгібітори кінази та подібні агенти; терапії моноклональними антитілами, такими як трастузумаб, гемтузумаб та інші подібні агенти; та гормональної терапії, такими яктамоксифен, госерелін та подібні агенти. Фармацевтичні композиції відповідно до винаходу, крім того, можуть застосовувати самостійно або в комбінації з щонайменше одним іншим терапевтичним агентом з інших терапевтичних галузей, наприклад, шлунково-кишкове захворювання. Композиції відповідно до винаходу, крім того, можуть застосовувати в комбінації з генною замісною терапією. Винахід включає, в іншому аспекті, комбінацію, що містить сполуку формули (I) або її фармацевтично прийнятну сіль, разом з щонайменше одним іншим терапевтично активним агентом. Комбінації, вказані вище, умовно можуть бути представлені для застосування в формі фармацевтичної композиції та, таким чином, фармацевтичних композицій, які містять комбінацію, як визначено вище, разом з їх щонайменше одним фармацевтично прийнятним розріджувачем або носієм, представляють наступний аспект винаходу. Терапевтично ефективна кількість сполуки формули (I) або її фармацевтично прийнятної солі будуть залежати від ряду чинників. Наприклад, різновидність, вік та вага реципієнта, точний стан, що вимагає лікування, та його важкість, природа композиції, та шлях введення є всіма чинниками, які розглядаються. Терапевтично ефективна кількість безумовно повинна бути на розсуд лікуючого лікаря. Так чи інакше, ефективна кількість сполуки за представленим винаходом для лікування людей, що страждають на хворобливість, як правило, повинна знаходитись в діапазоні від 0,0001 до 100 мг/кг маси тіла реципієнта на день. Точніше ефективна кількість повинна знаходитись в діапазоні від 0,001 до 10 мг/кг маси тіла на день. Таким чином, для дорослого вагою 70 кг один приклад фактичної кількості на день повинен, як правило, становити від 7 до 700 мг. Для інтраназальних та інгаляційних шляхів введення, місцеві дози для дорослого вагою 70 кг повинні знаходитись в діапазоні від 0,1 мікрограм до 1 мг на день, наприклад 1 мкг, 10 мкг або 100 мкг. Дана кількість може надаватись одноразо на день або у вигляді декількох (такий як дві, три, чотири, п'ять або більше) піддоз на день, таким чином, щоб загальна денна доза була б такою самою. Ефективну кількість фармацевтично прийнятної солі сполуки формули (I) можуть визначати за пропорцією ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі в чистому вигляді. Подібні дозування повинні бути відповідними для лікування інших станів, вказаних в даному документі. Сполуки формули (I) та їх фармацевтично прийнятні солі можуть також вводити з будь-якою відповідною частотою, наприклад, 1-7 разів на тиждень. Точний режим дозування, звичайно, буде залежати від чинників, таких як терапевтичне призначення, вік та стан пацієнта, та вибраний конкретний шлях введення. В одному аспекті винаходу, сполуку формули (I), або її фармацевтично прийнятну сіль, можуть вводити один раз на тиждень протягом періоду від 4 до 8 тижнів, наприклад, 4, 5, 6, 7 або 8 тижнів. Потрібними можуть бути повторні цикли лікування. Фармацевтичних композицій можуть бути представлені в одноразових дозованих формах, що містять попередньо визначену кількість активного інгредієнта на одиницю дози. Така одиниця може містити, як необмежуючий приклад, від 0,5 мг до 1 г сполуки формули (I) або її фармацевтично прийнятної солі, в залежності від стану, який лікують, шляху введення, та віку, ваги, та стану пацієнта. Переважні одноразові дозовані композиції є такими, що містять денну дозу або піддозу, як в даному документі процитовано вище, або відповідну їх частину, активного інгредієнта. Такі фармацевтичні композиції можуть одержувати за будь-яким зі способів, добре відомих в фармацевтичній галузі. Крім того, передбаченим є спосіб одержання такої фармацевтичної композиції, яка містить змішану сполуку формули (I), або її фармацевтично прийнятну сіль, з одним або більше фармацевтично прийнятними ексципієнтами. Скорочення Наступний перелік представляє визначення певних скорочень, як використовується в даному документі. Слід мати на увазі, що перелік не є вичерпним, але значення цих скорочень, не визначені в даному документі нижче, будуть очевидними кваліфікованому фахівцю у даній галузі з рівня техніки. 18 UA 114109 C2 ДХМ ДМФ ДМСО ДМЕ ТГФ EtOAc MeOH EtOH MeCN HCl ВЕРХ ІПС МСАХ ТФЕ MeOH ТФО ДІПЕА 5 10 15 20 25 30 Дихлорметан N, N-Диметилформамід Диметилсульфоксид 1,2-Диметоксіетан Тетрагідрофуран Етилацетат Метанол Етанол Ацетонітрил Гідрохлоридна кислота Високоефективна рідинна хроматографію Ізопропанол Мас-спрямована авто-препаративна ВЕРХ Твердофазна екстракція Метанол Трифлуороцтова кислота N, N-Діізопропілетиламін Особливості експерименту ЯМР 1 H ЯМР Спектри записували в або CDCl3 або ДМСО-d6 на або Bruker DPX 400, або Bruker Avance DRX, Varian Unity 400 спектрометрі або JEOL Delta, всі з яких працюють на 400 МГц. Внутрішній стандарт, який застосовують, був або тетраметилсиланом або залишковий протонований розчинник при 7,25 м.ч. для CDCl3 або 2,50 м.ч. для ДМСО-d6. РХ-МС Система A Колонка: 50 мм x 2,1 мм ID, 1,7 мкм Acquity UPLC BEH C18 Швидкість потоку: 1 мл/хв. Темп: 40 °C УФ діапазон детектування: від 210 до 350 нм Мас-спектр: Записували на мас-спектрометрі, застосовуючи електроспрей іонізацію в альтернативному скануючому позитивному та негативному режимі Розчинники: A: 0,1 % об./об. мурашиної кислоти у воді B: 0,1 % об./об. мурашиної кислоти в ацетонітрилі Градієнт: Час (хв.) A% B% 0 97 3 1,5 0 100 1,9 0 100 2,0 97 3 Система B Колонка: 50 мм x 2,1 мм ID, 1,7 мкм Acquity UPLC BEH C18 Швидкість потоку: 1мл/хв. Темп: 40 °C УФ діапазон детектування: від 210 до 350 нм Мас-спектр: Записували на мас-спектрометрі, застосовуючи електроспрей іонізацію в альтернативному скануючому позитивному та негативному режимі Розчинники: A: 10 мМ бікарбонату амонію у воді, регулюючи до pH 10 розчином аміаку B: ацетонітрил Градієнт: Час (хв.) A% B% 0 99 1 1,5 3 97 1,9 3 97 2,0 0 100 Мас-спрямована авто-препаративна ВЕРХ (МСАХ) Мас-спрямовану авто-препаративну ВЕРХ виконували в умовах наданих нижче. Уф детектування представляло собою усереднений сигнал на довжині хвилі від 210 нм до 350 нм, та мас-спектр реєстрували на мас-спектрометрі, застосовуючи електроспрей іонізацію в 19 UA 114109 C2 5 10 15 20 25 30 35 40 45 50 55 60 альтернативному скануючому позитивному та негативному режимі. Спосіб A Спосіб A здійснювали на колонці Sunfire C18 (як правило, 150 мм x 30 мм в.д. 5 мкм діаметр упакування) при температурі навколишнього середовища. Розчинниками, які застосовували, були: A=0,1 % об./об. розчин мурашиної кислоти у воді B=0,1 % об./об. розчин мурашиної кислоти в ацетонітрилі. Спосіб B Спосіб B здійснювали на колонці XBridge C18 (як правило, 100 мм x 30 мм в.д. 5 мкм діаметр упакування) при температурі навколишнього середовища. Розчинниками, які застосовували, були: A=10 мМ водний розчин бікарбонату амонію, регулюючи до pH 10 розчином аміаку. B = ацетонітрил. Одержання промпкних сполук Проміжна сполука 1: 5-Бутил-3-йод-1H-піразоло[4,3-d]піримідин-7(6H)-он 4M розчин гідрогенхлориду в 1,4-діоксані (19,4 мл, 78 ммоль) додавали до суспензії етил 4аміно-1H-піразол-5-карбоксилату гідрохлориду (2 г, 10,44 ммоль) в валеронітрилі (94 мл) при кімнатній температурі. Одержану в результаті суміш перемішували при 80 °C протягом 22 годин. Охолоджену реакційну суміш випаровували в вакуумі, одержуючи коричневу тверду речовину, яку розчиняли в етанолі (29 мл), додавали до розчину гідроксиду натрію (1,67 г, 41,7 ммоль) у воді (7,1 мл) та перемішували при 100 °C протягом 1 години. Реакційну суміш охолоджували до кімнатної температури, розбавляли водою (65 мл) та pH регулювали до 10, використовуючи 2M водний розчин лимонної кислоти. Реакційну суміш екстрагували етилацетатом (220 мл). Органічну фазу відокремлювали, пропускали через гідрофобну фриту та випаровували в вакуумі, одержуючи коричневу тверду речовину. Збережену водну фазу регулювали до pH 7, застосовуючи 2M водний розчин лимонної кислоти та екстрагували етилацетатом (220 мл). Органічну фазу відокремлювали, пропускали через гідрофобну фриту та випаровували в вакуумі, одержуючи коричневу тверду речовину. Дві партії коричневої твердої речовини об'єднували, одержуючи тверду речовину (3,3 г). N-Йодсукцинімід (3,52 г, 15,66 ммоль) додавали порціями до розчину твердої речовини (3,3 г) в безводному N, N-диметилформаміді (43 мл) при кімнатній температурі. Суміш перемішували при 60 ºC протягом 2 годин. Охолоджену реакційну суміш випаровували в вакуумі та розподіляли між етилацетатом та сумішшю вода/насичений сольовий розчин (1:1). Органічний шар відокремлювали, пропускали через гідрофобну фриту та випаровували в вакуумі, одержуючи коричневу тверду речовину (6,3 г). Тверду речовину розчиняли в етилацетаті, завантажували в 2 × 50 г ISOLUTE NH 2 картриджі, та очищали, застосовуючи етилацетат (2 × 400 мл), 5 % метанол в дихлорметані (2 × 200 мл), 10 % метанол в дихлорметані (2 × 100 мл), 15 % метанол в дихлорметані (2 × 100 мл) та на завершення 20 % метанол в дихлорметані (2 × 700мл) як елюєнт. Відповідні фракції об'єднували та випаровували в вакуумі, одержуючи названу сполуку у вигляді білої твердої речовини (2,12 г). + РХ-МС (Система A): tУТР. = 0,79 хв.; MH 319 Проміжна сполука 2: 1-(Гекс-5-ин-1-іл)піперидинe Розчин 6-хлоргекс-1-ину (5 мл, 41,3 ммоль), піперидину (4,08 мл, 41,3 ммоль) та гідрокарбонату натрію (4,16 г, 49,5 ммоль) в ДМФ (50 мл) кип'ятили зі зворотним холодильником протягом 16 годин. Реакційну суміш концентрували в вакуумі, та залишок розподіляли між етером (150 мл) та водою (150 мл). Органічну фазу відокремлювали та водну знову екстрагували діетиловим етером (50 мл). Об'єднані органічні фази промивали насиченим сольовим розчином (150 мл), сушили (MgSO 4), фільтрували та концентрували в вакуумі, одержуючи сирий зразок названої сполуки (3,74 г). До сирого продукту додавали щавелеву кислоту (2,161 г, 24 ммоль). Одержану в результаті тверду речовину перекристалізовували з етанолу, збирали шляхом фільтрації та сушили в вакуумі, одержуючи 1-(гекс-5-ин-1іл)піперидинові сіль щавелевої кислоти (4,66 г). Тверду речовину розподіляли між діетиловим етером (150 мл) та насиченим водним розчином бікарбонaту натрію (150 мл). Органічну фазу відокремлювали та сушили (MgSO4), фільтрували та концентрували в вакуумі, одержуючи названу сполуку у вигляді жовтої олії (1,93 г). 1 H ЯМР (400 МГц, хлороформ-d) δ м.ч. 2,31-2,52 (м, 6 H) 2,18-2,26 (м, 2 H) 1,92-1,96 (м, 1 H) 1,40-1,72 (м, 10 H) Проміжна сполука 3: 5-Бутил-3-(6-(піперидин-1-іл)гексил)-1H-піразоло[4,3-d]піримідин -7(6H)он До дегазованого розчину 5-бутил-3-йод-1H-піразоло[4,3-d]піримідин-7(6H)-ону (300 мг, 0,943 20 UA 114109 C2 5 10 15 20 25 30 35 40 45 50 55 60 ммоль) в безводному N, N-диметилформаміді (7 мл) в атмосфері азоту при кімнатній температурі додавали купруму(I) йодид (36 мг, 0,189 ммоль), тетра(трифенілфосфін)-паладію(0) (120 мг, 0,104 ммоль) та на завершення триетиламін (0,289 мл, 2,075 ммоль). Суміш перемішували при кімнатній температурі в атмосфері азоту протягом 10 хвилин, та потім додавали розчин 1-(5-гексин-1-іл)піперидину (343 мг, 2,075 ммоль) в безводному N, Nдиметилформаміді (1 мл). Реакційну суміш перемішували при кімнатній температурі протягом 23 годин. Реакційну суміш випаровували в вакуумі, одержуючи коричневу олію, олію розбавляли дихлорметаном (15 мл), завантажували в 70 г ISOLUTE NH2 картридж та очищали хроматографією, застосовуючи градієнт 0-25 % метанол в дихлорметані протягом 80 хвилин (УФ збір проводили на довжині хвилі 233 нм). Відповідні фракції об'єднували та випаровували в вакуумі, одержуючи світло-жовту олію (330 мг). Розчин олії (330 мг) в етанолі (50 мл) пропускали через H-cube (характеристики: 45 °C, повністю водень, швидкість потоку 1 мл/хв та 10 % паладій на вугіллі CatCart30 як каталізатор). Розчин випаровували в вакуумі, одержуючи безбарвну олію. Олію розчиняли в MeOH:ДМСО (1:1) (4 × 1 мл) та очищали, застосовуючи МСАХ (Спосіб B). Відповідні фракції об'єднували та випаровували в вакуумі, одержуючи білу тверду речовину (205 мг). Розчин твердої речовини (205 мг) в етанолі (40 мл) пропускали через H-cube (характеристики: 45 °C, повністю водень, швидкість потоку 1 мл/хв та 10 % паладій на вугіллі CatCart30 як каталізатор). Розчин випаровували в вакуумі, одержуючи названу сполуку білу тверду речовину (201 мг). + РХ-МС (Система B): tУТР. = 0,93 хв.; MH 360. Проміжна сполука 4: 3-Йод-5-(2-метоксіетил)-1H-піразоло[4,3-d]піримідин-7(6H)-он 4M розчин гідрогенхлориду в 1,4-діоксані (5,19 мл, 20,74 ммоль) додавали до суспензії етил 4-аміно-1H-піразол-5-карбоксилату гідрохлориду (535 мг, 2,79 ммоль) в 3-метоксипропаннітрилі (25,7 мл, 240 ммоль) при кімнатній температурі. Одержану в результаті суміш перемішували при 80 °C протягом 2,5 годин. Охолоджену реакційну суміш випаровували в вакуумі, одержуючи світло-жовту тверду речовину, яку розчиняли в етанолі (7,7 мл), додавали до розчину гідроксиду натрію (447 мг, 11,17 ммоль) у воді (1,9 мл) та перемішували при кімнатній температурі протягом 20 хвилин. Реакційну суміш випаровували в вакуумі, одержуючи коричневу тверду речовину. N-Йодсукцинімід (942 мг, 4,19 ммоль) додавали порціями до розчину зазначеної вище сполуки в безводному N, N-диметилформаміді (ДМФ) (11,3 мл) при кімнатній температурі. Суміш перемішували при 60 ºC протягом 45 хвилин. Охолоджену реакційну суміш випаровували в вакуумі. Залишок розчиняли в мінімальному об'ємі дихлорметану, завантажували в 2 × 50 г ISOLUTE NH2 картриджі та очищали хроматографією, застосовуючи градієнт 0-50 % MeOH/ДХМ протягом 60 хвилин. Відповідні фракції об'єднували та випаровували в вакуумі, одержуючи кремову тверду речовину (203 мг). Фракції з домішками з колонки, що містять бажаний продукт об'єднували, концентрували в вакуумі, потім знову очищали хроматографією, застосовуючи той самий спосіб, як зазначено вище. Продукти з обох колонок об'єднували, одержуючи названу сполуку у вигляді жовтої твердої речовини (309 мг). + РХ-МС (Система A): tУТР. = 0,54 хв.; MH 321. Проміжна сполука 5: 5-(2-Метоксіетил)-3-(6-(піперидин-1-іл)гексил)-1H-піразоло[4,3d]піримідин-7(6H)-он До дегазованого розчину 3-йод-5-(2-метоксіетил)-1H-піразоло[4,3-d]піримідин-7(6H)-ону (232 мг, 0,724 ммоль) в безводному N, N-диметилформаміді (5 мл) в атмосфері азоту при кімнатній температурі додавали купруму(I) йодид (27,6 мг, 0,145 ммоль), тетра(трифенілфосфін)паладію(0) (92 мг, 0,080 ммоль) та на завершення триетиламін (0,222 мл, 1,592 ммоль). Суміш перемішували при кімнатній температурі в атмосфері азоту протягом 10 хвилин, та потім додавали розчин 1-(5-гексин-1-іл)піперидину (263 мг, 1,592 ммоль) в безводному N, Nдиметилформаміді (1 мл). Реакційну суміш перемішували при кімнатній температурі протягом 20 годин потім нагрівали до 55 ºC та залишали перемішуватись протягом 5 годин. Реакційну суміш випаровували в вакуумі, одержуючи коричневу олію. Олію розбавляли дихлорметаном, завантажували в 50 г ISOLUTE NH2 картридж та очищали хроматографією, застосовуючи градієнт 0-50 % метанол в дихлорметані протягом 60 хвилин (УФ збір проводили на довжині хвилі 230 нм). Відповідні фракції об'єднували та випаровували в вакуумі, одержуючи світложовту олію (188 мг). Розчин олії (188 мг) в етанолі (30 мл) пропускали через H-cube (характеристики: 45 °C, повністю водень, швидкість потоку 1 мл/хв та 10 % паладій на вугіллі CatCart30 як каталізатор). Розчин випаровували в вакуумі, одержуючи світло-жовту олію, та сирий продукт очищали, застосовуючи МСАХ (Спосіб B). Відповідні фракції об'єднували та випаровували в вакуумі, одержуючи названу сполуку у вигляді безбарвної олії (117 мг). + РХ-МС (Система B): tУТР. = 0,76 хв.; MH 362 21 UA 114109 C2 5 10 15 20 25 30 35 40 45 50 55 60 Проміжна сполука 6: 5-Бутил-3-(6-хлоргекс-1-ин-1-іл)-1H-піразоло[4,3-d]піримідин-7(6H)-он До розчину 5-бутил-3-йод-1H-піразоло[4,3-d]піримідин-7(6H)-ону (4,97 г, 15,62 ммоль) в N, Nдиметилформаміді (100 мл) додавали біс(трифенілфосфін)паладію(II) дихлорид (1,228 г, 1,750 ммоль) та купруму(I) йодид (0,595 г, 3,12 ммоль). Розчин перемішували та дегазували азотом протягом 5 хвилин, потім реакційна суміш знаходилась в атмосфері азоту. Розчин 6-хлор-1гексину (3,64 г, 31,2 ммоль) та триетиламіну (4,36 мл, 31,2 ммоль) в N, N-диметилформаміді (30 мл) додавали по краплям протягом 10 хвилин. Реакційну суміш перемішували при температурі навколишнього середовища протягом додаткових 10 хвилин, потім нагрівали до 60 ºC протягом 2,5 годин. Реакційну суміш концентрували в вакуумі при 60 ºC та одержаний в результаті залишок розподіляли між етилацетатом (250 мл) та 1:1 сумішшювода:насичений сольовий розчин (500 мл). Органічний шар відокремлювали та водний шар знову екстрагували етилацетатом (250 мл). Об'єднані органічні фази сушили з допомогою гідрофобної фрити та концентрували в вакуумі, одержуючи коричневу тверду речовину (8,0 г). Залишок розчиняли в 1:1 суміші MeOH:ДХМ та абсорбували на Флорисил. Тверду речовину завантажували та очищали хроматографією на силікагелі (330 г), застосовуючи градієнт 0-100 % етилацетатциклогексан понад 10 об'ємів колонки, з наступним промиванням етилацетатом понад 9 об'ємів колонки. Відповідні фракції об'єднували та випаровували в вакуумі, одержуючи жовту тверду речовину (3,55 г). Тверду речовину розтирали з діізопропіловим етером, фільтрували та сушили в вакуумі при 50 ºC, одержуючи названу сполуку у вигляді світло-жовтої твердої речовини (3,14 г). + РХ-МС (Система B): tУТР. = 0,98 хв.; MH 307, 309 Проміжна сполука 7: 5-Бутил-3-(6-(піролідин-1-іл)гексил)-1H-піразоло[4,3-d]піримідин-7(6H)он До суспензії 5-бутил-3-(6-хлоргекс-1-ин-1-іл)-1H-піразоло[4,3-d]піримідин-7(6H)-ону (2,59 г, 8,44 ммоль) в безводному ацетонітрилі (115 мл) додавали піролідин (2,11 мл, 25,3 ммоль) та триетиламін (3,53 мл, 25,3 ммоль). Реакційну суміш перемішували при 80 ºC протягом 3,5 годин. До реакційної суміші додавали додаткові 2,11 мл (25,3 ммоль) піролідину та 3,53 мл (25,3 ммоль) триетиламіну. Реакційну суміш перемішували при 80 ºC протягом додаткових 18 годин. Охолоджену реакційну суміш розподіляли між етилацетатом і водою. Органічний шар відокремлювали, пропускали через гідрофобну фриту та випаровували в вакуумі, одержуючи жовту олію (1,9 г). Збережену водну фазу знову екстрагували 20 % метанолом в дихлорметані. Органічний шар пропускали через гідрофобну фриту та випаровували в вакуумі, одержуючи жовту олію (1,02 г). Дві жовті олії об'єднували, одержуючи жовту олію (2,92 г). Суміш олій та 10 мас. % паладію на вугіллі (350 мг) в етанолі (120 мл) перемішували в атмосфері водню при кімнатній температурі протягом 90 хвилин. Додаткові 350 мг 10 мас. % паладію на вугіллі додавали до реакційної суміші в атмосфері азоту, та реакційну суміш перемішували в атмосфері водню при кімнатній температурі протягом 60 хвилин. Додаткові 350 мг 10 мас. % паладію на вугіллі додавали до реакційної суміші в атмосфері азоту, та реакційну суміш перемішували в атмосфері водню при кімнатній температурі протягом 60 хвилин. Реакційну суміш фільтрували через 10 г картридж з целітом, фільтрат випаровували в вакуумі, одержуючи жовту олію (2,8 г). Олію розчиняли в мінімальному об'ємі дихлорметану, завантажували в 375 г Biotage KP-NH картридж та очищали, застосовуючи градієнт 0-10 % метанол в дихлорметані понад 12 об'ємів колонки, з наступним 10 % метанолом в дихлорметані понад 3 об'єми колонки. Відповідні фракції об'єднували та випаровували в вакуумі, одержуючи названу сполуку у вигляді світло-жовтої твердої речовини (1,845 г). + РХ-МС (Система B): tУТР. = 0,85 хв.; MH 346 Фракції з домішками після хроматографії об'єднували та випаровували в вакуумі, одержуючи жовту олію (380 мг). Олію розчиняли в MeOH:ДМСО (1:1) (4 × 1мл) та очищали, застосовуючи МСАХ (Спосіб B). Відповідні фракції об'єднували та випаровували в вакуумі, одержуючи додаткову порцію названої сполуки у вигляді світло-жовтої олії (198 мг). Проміжна сполука 8: 5-Бутил-N-(3,4-диметоксибензил)-3-йод-1H-піразоло[4,3-d] піримідин-7амін До розчину 5-бутил-3-йод-1H-піразоло[4,3-d]піримідин-7(6H)-ону (5 г, 15,72 ммоль) та (бензотриазол-1-ілокси)три(диметиламіно)фосфонію гексафлуорфосфату (10,43 г, 23,58 ммоль) в безводному ДМФ (250 мл) при кімнатній температурі в атмосфері азоту додавали 1,8діазабіцикло[5,4,0]ундек-7-ен (4,23 мл, 28,3 ммоль), та реакційну суміш перемішували протягом 2,5 годин. (3,4-Диметоксифеніл)метанамін (20 мл, 94 ммоль) додавали та суміш нагрівали до 40 ºC протягом 3 годин. Реакційну суміш випаровували в вакуумі, та одержану в результаті олію розподіляли між етилацетатом та водою. Органічний шар відокремлювали, промивали насиченим сольовим розчином, сушили над MgSO 4, фільтрували та випаровували в вакуумі, 22 UA 114109 C2 5 10 15 20 25 30 35 40 45 50 55 60 одержуючи як напів-кристалічну жовту олію (23,7 г). Залишок абсорбували на Флорисилі, завантажували в 330 г силікагелевий попередньо модифікований картридж, та очищали хроматографією, застосовуючи циклогексан понад 1 об'єм колонки, з наступним градієнтом 0100 % етилацетату в циклогексані понад 14 ів колонки, з наступним етилацетатом понад об'єми 4 колонки. Відповідні фракції, що містять тільки бажану речовину за РХ-МС аналізом, об'єднували та випаровували в вакуумі, одержуючи названу сполуку у вигляді світло-жовтої піни (4,58 г). + РХ-МС (Система B): tУТР. = 1,08-1,09 хв.; MH 468 1 H ЯМР (400МГц, ДМСО-d6) включає δ = 7,90-7,65 (м, 1 H), 7,05 (с, 1 H), 6,93 (с, 2 H), 4,70 – 4,61 (м, 2 H), 3,73 (с, 6 H), 2,75-2,67 (м, 2 H), 1,78-1,67 (м, 2 H), 1,40-1,28 (м, 2 H), 0,90 (т, 3 H) Проміжна сполука 9: 5-Бутил-3-(6-хлоргекс-1-ин-1-іл)-N-(3,4-диметоксибензил)-1Hпіразоло[4,3-d]піримідин-7-амін Дегазовану азотом суміш, яку перемішують, з 5-бутил-N-(3,4-диметоксибензил)-3-йод-1Hпіразоло[4,3-d]піримідин-7-аміну (4,58 г, 9,7 ммоль), купруму(I) йодиду (278 мг, 1,46 ммоль) та біс(трифенілфосфін)паладію(II) дихлориду (515 мг, 0,734 ммоль) в безводному N, Nдиметилформамід (105 мл) нагрівали до 60 ºC в атмосфері азоту перед додаванням розчину 6хлор-1-гексину (1,712 г, 14,69 ммоль) та триетиламіну (2,047 мл, 14,69 ммоль) в безводному дегазованому азотом N, N-диметилформаміді (15 мл), по краплям протягом 5 хвилин. Реакційну суміш перемішували при 60 ºC протягом 6 годин. Охолоджену реакційну суміш випаровували в вакуумі, та одержану в результаті олію розподіляли між сумішшю 1:1 вода/насичений сольовий розчин та етилацетатом. Органічний шар відокремлювали, пропускали через гідрофобну фриту та випаровували в вакуумі, одержуючи оранжеву олію. Олію розчиняли в мінімальному об'ємі дихлорметану, завантажували в 330 г силікагелевий попередньо модифікований картридж та очищали хроматографією, застосовуючи циклогексан понад об'єм 1 колонки, потім градієнт 0100 % етилацетат в циклогексані понад 14 об'ємів колонки, етилацетат понад 2 об'єми колонки. Відповідні фракції об'єднували та випаровували в вакуумі, одержуючи названу сполуку у вигляді жовтої піни (3,334 г) + РХ-МС (Система B): tУТР. = 1,26, 1,28 хв.; MH 456 1 H ЯМР (400МГц, хлороформ-d) δ = 6,90 (ш с, 2 H), 6,81-6,70 (м, 1 H), 4,77 (ш с, 2 H), 3,943,72 (м, 6 H), 3,49 (т, J=6,5 Гц, 2 H), 2,88 (т, J=7,8 Гц, 2 H), 2,25 (ш с, 2 H), 1,90-1,71 (м, 4 H), 1,621,52 (м, 2 H), 1,48-1,31 (м, 2 H), 0,93 (т, J=7,3 Гц, 3 H) Проміжна сполука 10: 5-Бутил-N-(3,4-диметоксибензил)-3-(6-(піролідин-1-іл)гекс-1-ин-1-іл)1H-піразоло[4,3-d]піримідин-7-амін До розчину 5-бутил-3-(6-хлоргекс-1-ин-1-іл)-N-(3,4-диметоксибензил)-1H-піразоло[4,3d]піримідин-7-аміну (3,334 г, 7,31 ммоль) в безводному ацетонітрилі (4 мл) додавали триетиламін (3,06 мл, 21,94 ммоль) та піролідин (1,831 мл, 21,94 ммоль). Розчин перемішували при 70 ºC протягом 18 годин. До реакційної суміші додавали додатковий еквівалент піролідину (0,61 мл, 7,31 ммоль) та триетиламіну (1,019 мл, 7,31 ммоль). Розчин перемішували при 70 ºC протягом додаткових 3 годин. Охолоджену реакційну суміш випаровували в вакуумі, та залишок розподіляли між етилацетатом та сумішшю вода/насичений сольовий розчин (1:1). Органічну фазу відокремлювали, пропускали через гідрофобну фриту та випаровували в вакуумі, одержуючи в'язку коричневу смолу (4,226 г). Смолу розчиняли в мінімальному об'ємі дихлорметану, завантажували в 340 г силікагелевий попередньо модифікований картридж та очищали хроматографією, застосовуючи дихлорметан понад 1 об'єм колонки, потім градієнт 030 % метанолу (+1 % триетиламін) в дихлорметані понад 14 об'ємів колонки, потім 30 % метанол (+1 % триетиламін) в дихлорметані понад 3 об'єми колонки. Відповідні фракції об'єднували та випаровували в вакуумі, одержуючи названу сполуку у вигляді в'язкої коричневої смоли (1,838g). + РХ-МС (Система B): tУТР. = 1,11-1,17 хв.; MH 491 1 H ЯМР (400МГц, метанол-d4) включає δ = 7,07-7,04 (м, 1 H), 7,00-6,95 (м, 1 H), 6,92 (с, 1 H), 4,76 (с, 2 H), 3,83-3,78 (м, 6 H), 2,82-2,56 (м, 10 H), 1,90-1,67 (м, 10 H), 1,44-1,32 (м, 2 H), 0,94 (т, J=7,3 Гц, 3 H). Проміжна сполука 11: 3-(6-Хлоргекс-1-ин-1-іл)-5-(2-метоксіетил)-1H-піразоло[4,3-d]піримідин7(6H)-он До дегазованого азотом розчину 3-йод-5-(2-метоксіетил)-1H-піразоло[4,3-d]піримідин-7(6H)ону (307 мг, 0,959 ммоль) в безводному N, N-диметилформаміді (6 мл) в атмосфері азоту при кімнатній температурі додавали купруму(I) йодид (36,5 мг, 0,192 ммоль), біс(трифенілфосфін)паладію(II) дихлорид (75 мг, 0,107 ммоль) та на завершення триетиламін (0,267 мл, 1,918 ммоль). Суміш перемішували при кімнатній температурі в атмосфері азоту протягом 10 хвилин, та потім додавали розчин 6-хлоргекс-1-ину (224 мг, 1,918 ммоль) в 23 UA 114109 C2 5 10 15 20 25 30 35 40 45 50 55 60 безводному N, N-диметилформаміді (1,5 мл). Реакційну суміш перемішували при 60ºC протягом 2 годин. Додавали інші 2 еквіваленти 6-хлоргекс-1-ину (224 мг, 1,918 ммоль), та реакційну суміш залишали перемішуватись при 60 °C протягом 1 години. Реакційну суміш випаровували в вакуумі, одержуючи темно-червону олію. Олію розподіляли між сумішшю вода/насичений сольовий розчин (1:1) та етилацетатом. Органічний шар відокремлювали, пропускали через гідрофобну фриту та випаровували в вакуумі, одержуючи оранжеву олію (621 мг). Сиру речовину розчиняли в мінімальній кількості ДХМ, завантажували в 50 г силікагелевий картридж та очищали хроматографією, застосовуючи градієнт 0-100 % етилацетату в циклогексані протягом 60 хвилин. Відповідні фракції, що містили бажаний продукт, об'єднували та випаровували в вакуумі, одержуючи названу сполуку у вигляді світло-жовтої твердої речовини (163,5мг). + РХ-МС (Система A): tУТР. = 0,80 хв.; MH 309, 311. Проміжна сполука 12: 5-(2-Метоксіетил)-3-(6-(піролідин-1-іл)гексил)-1H-піразоло[4,3d]піримідин-7(6H)-он До розчину 3-(6-хлоргекс-1-ин-1-іл)-5-(2-метоксіетил)-1H-піразоло[4,3-d]піримідин-7(6H)-ону (84 мг, 0,230 ммоль) в безводному N, N-диметилформаміді (4 мл) додавали піролідин (0,132 мл, 1,579 ммоль) та триетиламін (0,293 мл, 2,105 ммоль). Реакційну суміш перемішували при 80 ºC протягом 2 годин. Додаткові 66 мкл (1,5 екв.) піролідину та 147 мкл (2 екв.) триетиламіну додавали до реакційної суміші, та реакційну суміш перемішували при 80 ºC протягом 2 годин. Додаткові 66 мкл (1,5 екв.) піролідину та 147 мкл (2 екв.) триетиламіну додавали до реакційної суміші. Реакційну суміш перемішували при 80 ºC протягом 1 годин. Реакційну суміш випаровували в вакуумі, одержуючи темно-жовту олію. Розчин олії в етанолі (35 мл) пропускали через H-cube (характеристики: 55 °C, повністю водень, швидкість потоку 1 мл/хв та 10 % паладій на вугіллі CatCart30 як каталізатор). Новий картридж 10 % паладію на вугіллі CatCart30 вводили в H-cube, та розчин знову пропускали через H-cube (характеристики: 55 °C, повністю водень, 1 мл/хв швидкість потоку). Розчин випаровували в вакуумі, одержуючи світло-жовту олію, та сирий продукт очищали, застосовуючи МСАХ (Спосіб B). Відповідні фракції об'єднували та випаровували в вакуумі, одержуючи названу сполуку у вигляді безбарвної олії (84 мг). + РХ-МС (Система A): tУТР. = 0,46 хв.; MH 348 Проміжна сполука 13: 5-Бутил-3-(5-хлорпент-1-ин-1-іл)-1H-піразоло[4,3-d]піримідин-7(6H)-он До дегазованого азотом розчину 5-бутил-3-йод-1H-піразоло[4,3-d]піримідин-7(6H)-ону (250 мг, 0,786 ммоль) в безводному N, N-диметилформаміді (6 мл) в атмосфері азоту при кімнатній температурі додавали купруму(I) йодид (30 мг, 0,158 ммоль), біс(трифенілфосфін)паладію(II) дихлорид (62 мг, 0,088 ммоль) та на завершення триетиламін (0,219 мл, 1,572 ммоль). Суміш перемішували при кімнатній температурі в атмосфері азоту протягом 10 хвилин, та потім додавали розчин 5-хлор-1-пентину (161 мг, 1,572 ммоль) в безводному N, N-диметилформаміді (1,5 мл). Реакційну суміш перемішували при 60 ºC протягом 80 хвилин. Реакційну суміш випаровували в вакуумі, одержуючи коричневу олію. Олію розподіляли між сумішшю вода/насичений сольовий розчин (1:1) та етилацетатом. Органічний шар відокремлювали, пропускали через гідрофобну фриту та випаровували в вакуумі, одержуючи коричневу тверду речовину. Тверду речовину абсорбували на Флорисилі, завантажували в 50 г силікагелевий картридж та очищали хроматографією, застосовуючи градієнт 0-100 % етилацетату в циклогексані протягом 60 хвилин. Відповідні фракції об'єднували та випаровували в вакуумі, одержуючи названу сполуку у вигляді світло-жовтої твердої речовини (172 мг). + РХ-МС (Система A): tУТР. = 0,91 хв.; MH 293, 295 Проміжна сполука 14: 5-Бутил-3-(5-(піперидин-1-іл)пентил)-1H-піразоло[4,3-d] піримідин7(6H)-он До розчину 5-бутил-3-(5-хлорпент-1-ин-1-іл)-1H-піразоло[4,3-d]піримідин-7(6H)-ону (168 мг, 0,574 ммоль) в безводному N, N-диметилформаміді (3,5 мл) додавали розчин піперидину (147 мг, 1,722 ммоль) в безводному N, N-диметилформаміді (0,5 мл) та триетиламіні (0,32 мл, 2,295 ммоль). Реакційну суміш перемішували при 80 ºC протягом 190 хвилин. Додаткові 73 мг (0,857 ммоль) піперидину та 160 мкл (1,148 ммоль) триетиламіну додавали до реакційної суміші. Реакційну суміш перемішували при 80 ºC протягом додаткових 2,5 годин та потім при кімнатній температурі протягом 15,5 годин. Додаткові 73 мг (0,857 ммоль) піперидину та 160 мкл (1,148 ммоль) триетиламіну додавали до реакційної суміші. Реакційну суміш перемішували при 80 ºC протягом 2,5 годин. Реакційну суміш випаровували в вакуумі, одержуючи темно-жовту олію. Розчин олії в етанолі (50 мл) пропускали через H-cube (характеристики: 30 °C, повністю водень, швидкість потоку 1мл/хв та 10 % паладій на вугіллі CatCart30 як каталізатор). Новий картридж 10 % паладію на вугіллі CatCart30 вводили в H-cube та розчин знову пропускали через H-cube (характеристики: 30 °C, повністю водень, швидкість потоку 1 мл/хв). Розчин випаровували в 24 UA 114109 C2 5 10 15 20 25 30 35 40 45 50 55 60 вакуумі, одержуючи світло-жовту олію. Олію розчиняли в MeOH:ДМСО (1:1) (3 × 1 мл) та очищали, застосовуючи МСАХ (Спосіб B). Відповідні фракції об'єднували та випаровували в вакуумі, одержуючи названу сполуку у вигляді світло-жовтої твердої речовини (91мг). + РХ-МС (Система B): tУТР. = 0,83 хв.; MH 346. Проміжна сполука 15: 5-Бутил-3-(5-(піролідин-1-іл)пентил)-1H-піразоло[4,3-d] піримідин7(6H)-он До дегазованого розчин 5-бутил-3-йод-1H-піразоло[4,3-d]піримідин-7(6H)-ону (79 мг, 0,248 ммоль) в безводному N, N-диметилформаміді (2,0 мл) в атмосфері азоту при кімнатній температурі додавали купруму(I) йодид (10 мг, 0,053 ммоль), тетра(трифенілфосфін)-паладію(0) (32 мг, 0,028 ммоль) та на завершення триетиламін (0,076 мл, 0,546 ммоль). Суміш перемішували при кімнатній температурі в атмосфері азоту протягом 10 хвилин, та потім додавали розчин 1-(4-пентин-1-іл)піролідину (75 мг, 0,546 ммоль) (Chemical Communications 46(19), 3351-3353; 2010) в безводному N, N-диметилформаміді (0,5 мл). Реакційну суміш перемішували при 55 ºC протягом 1 години. Розчин 1-(4-пентин-1-іл)піролідину (75 мг, 0,546 ммоль) в безводному N, N-диметилформаміді (0,5 мл) додавали до реакційної суміші. Реакційну суміш перемішували при 55 ºC протягом 40 хвилин. Реакційну суміш випаровували в вакуумі, одержуючи темно-жовту олію. Відфільтрований розчин олії в етанолі (15 мл) пропускали через H-cube (характеристики: 45 °C, повністю водень, швидкість потоку 1 мл/хв та 10 % паладій на вугіллі CatCart30 як каталізатор). Розчин пропускали через H-cube додаткові два рази, застосовуючи новий CatCart 30 картридж на кожен випадок. Розчин випаровували в вакуумі, одержуючи безбарвну олію. Олію розчиняли в MeOH:ДМСО (1:1) (1мл) та очищали, застосовуючи МСАХ (Спосіб B). Відповідні фракції об'єднували та випаровували в вакуумі, одержуючи названу сполуку у вигляді білої твердої речовини (20 мг). + РХ-МС (Система B): tУТР. = 0,79 хв.; MH 332. Проміжна сполука 16: 5-Бутил-N-(2,4-диметоксибензил)-3-йод-1H-піразоло[4,3-d] піримідин7-амін Розчин 5-бутил-3-йод-1H-піразоло[4,3-d]піримідин-7(6H)-ону (50 г, 157 ммоль), (2,4диметоксифеніл)метанаміну (60 г, 359 ммоль) та 2,3,4,6,7,8,9,10-октагідропіримідо[1,2-a]азепіну (47,9 г, 314 ммоль) в ацетонітрилі (500 мл) обробляли ((1H-бензо[d][1,2,3]триазол-1іл)окси)три(піролідин-1-іл)фосфонію гексафлуорфосфат(V) (100 г, 192 ммоль) та перемішують протягом 6 годин при кімнатній температурі в атмосфері азоту. Одержану в результаті суспензію фільтрували, щоб видалити осад, та фільтрат випаровували. Залишок очищали на силікагелевому картриджі (1500 г) (застосовували в мінімумі ДХМ) елюювали 0-80 % циклогексан-EtOAc (12 об'ємів колонки). Фракції, що містять продукт частково випаровували, одержуючи густу суспензію, яку фільтрували, та тверду речовину сушили на повітрі, одержуючи названу сполуку (37,5 г, 80 ммоль) у вигляді білого порошку. + РХ-МС (Система A): tУТР. = 0,91 хв.; MH 468 1 H ЯМР (400МГц, хлороформ-d) включає δ = 6,43-6,33 (м, 2H), 4,76 (с, 2H), 3,79 (с, 3H), 3,67 (с, 3H), 2,90-2,80 (м, 2H), 1,84 (с, 2H), 1,48-1,35 (м, 2H), 0,94 (т, J=7,3 Гц, 3H). Маточні розчини та фракції з домішками випаровували, одержуючи жовті тверді речовини. Об'єднані нечисті речовини розтирали з етилацетатом, одержуючи кремову тверду речовину (30 г). Додаткове розтирання з діетиловим етером (50 мл), а потім з ДХМ/Et 2O (1;1, 30 мл) давало додаткову порцію названої сполуки у вигляді білої твердої речовини (25,7 г). Проміжна сполука 17: 5-Бутил-3-(6-хлоргекс-1-ин-1-іл)-N-(2,4-диметоксибензил)-1Hпіразоло[4,3-d]піримідин-7-амін Розчин 5-бутил-N-(2,4-диметоксибензил)-3-йод-1H-піразоло[4,3-d]піримідин-7-аміну (50 г, 107 ммоль), 6-хлор-1-гексину (18,71 г, 160 ммоль), триетиламіну (22,37 мл, 160 ммоль), біс(трифенілфосфін)паладію(II) дихлориду (5,63 г, 8,02 ммоль) та купруму(I) йодиду (3,04 г, 15,94 ммоль) в N, N-диметилформаміді (1000 мл) в атмосфері азоту нагрівали до 70 ºC протягом 4 годин. Охолоджений розчин випаровували, та залишок очищали хроматографією на 1,5 кг силікагелевого картриджу, елюювали сумішшю 20-80 % циклогексан - EtOAc понад 12 об'ємів колонки. Відповідні фракції випаровували, одержуючи названу сполуку у вигляді жовтої піни (25,5 г). + РХ-МС (Система A): tУТР. = 1,05 хв.; MH 456, 458 1 H ЯМР (400МГц, хлороформ-d) включає δ = 6,71-6,54 (м, 1H), 6,41-6,31 (м, 2H), 4,75 (ш с, 2H), 3,77 (с, 4H), 3,67 (ш с, 3H), 3,50 – 3,43 (м, 2H), 2,89-2,76 (м, 3H), 2,26-2,15 (м, 2H), 1,30-1,20 (м, 1H), 0,92 (т, J=7,3 Гц, 3H). Проміжна сполука 18: 5-Бутил-N-(2,4-диметоксибензил)-3-(6-(піролідин-1-іл)гекс-1-ин-1-іл)1H-піразоло[4,3-d]піримідин-7-амін Розчин 5-бутил-3-(6-хлоргекс-1-ин-1-іл)-N-(2,4-диметоксибензил)-1H-піразоло[4,3 25 UA 114109 C2 5 10 15 20 25 30 35 40 45 50 55 60 d]піримідин-7-аміну (30 г, 65,8 ммоль), піролідину (16,32 мл, 197 ммоль) та Et 3N (27,5 мл, 197 ммоль) в ацетонітрилі (400 мл) нагрівали при 70 ºC протягом 16 годин. Додавали додатковий піролідин (7 г), та розчин нагрівали при 70 ºC протягом 8 годин. Охолоджений розчин випаровували, та залишок очищали на силікагелевому картриджі (750 г), елюювали EtOAc (2 об'єми колонки), а потім 20-30 % MeOH (+1 % Et3N)/EtOAc (16 об'ємів колонки), одержуючи названу сполуку у вигляді жовтої смоли (23,3 г). + РХ-МС (Система B): tУТР. = 1,15 хв.; MH 491 1 H ЯМР (400МГц, хлороформ-d) включає δ = 7,31 – 7,25 (м, 1H), 6,42 – 6,23 (м, 2H), 4,76 (ш с, 2H), 3,76 (с, 3H), 3,65 (с, 3H), 2,88 – 2,78 (м, 6H), 2,67-2,60 (м, 2H), 2,18 – 2,11 (м, 2H, 1,93 – 1,75 (м, 6H), 1,63 (ш с, 2H), 1,43 – 1,28 (м, 4H), 0,91 (т, J=7,3Гц, 3H). Проміжна сполука 19: 5-Бутил-N-(2,4-диметоксибензил)-3-(6-(піролідин-1-іл)гексил)-1Hпіразоло[4,3-d]піримідин-7-амін Розчин 5-бутил-N-(2,4-диметоксибензил)-3-(6-(піролідин-1-іл)гекс-1-ин-1-іл)-1H-піразоло[4,3d]піримідин-7-аміну (20 г, 40,8 ммоль) в етанолі (500 мл) гідрогенували над Pd-C (5 г, 4,70 ммоль) протягом 4 годин (H2 повне поглинання). Суміш фільтрували через Hyflo та випаровували. Залишок в ДХМ (30 мл) очищали на 120 г силікагелевого картриджу (Redisep Gold), елюювали сумішшю толуол-етанол-NH3 (85/15/1,5) в 7 серіях - знімаючи продукт та нижча проточна домішка та повторне використання картриджу кожного разу (загальний об'єм ~ 3 літри). Випаровування відповідних фракцій давало названу сполуку у вигляді жовтої смоли (16,3 г). + РХ-МС (Система B): tУТР. = 1,15 хв.; MH 495 1 H ЯМР (400МГц, хлороформ-d) включає δ = 6,49 – 6,41 (м, 2H), 6,12 – 6,02 (м, 1H), 4,82 (ш с, 2H), 3,85 – 3,78 (м, 6H), 3,04 – 2,96 (м, 2H), 2,88 – 2,80 (м, 2H), 2,57 (ш с, 4H), 2,50 – 2,43 (м, 2H), 0,97 (т, J=7,3 Гц, 3H). Проміжна сполука 20: 7-(5-Бутил-7-((2,4-диметоксибензил)аміно)-1H-піразоло[4,3d]піримідин-3-іл)гептан-1-ол Біс(трифенілфосфін)паладію(II) дихлорид (68 мг, 0,097 ммоль), триетиламін (0,537 мл, 3,85 ммоль) та купруму йодид (37 мг, 0,194 ммоль) додавали до дегазованого азотом розчину 5бутил-N-(2,4-диметоксибензил)-3-йод-1H-піразоло[4,3-d]піримідин-7-аміну (600 мг, 1,284 ммоль) в безводному N, N-диметилформаміді (15 мл). Суміш перемішували в атмосфері азоту та нагрівали до 60 ºC перед додаванням гепт-6-ин-1-олу (432 мг, 3,85 ммоль) в безводному N, Nдиметилформаміді (2 мл). Реакційну суміш перемішували при 60 ºC протягом 2,5 годин. Додаткові 0,5 еквіваленти гепт-6-ин-1-олу (72 мг, 0,642 ммоль) в безводному N, Nдиметилформаміді (0,5 мл) додавали до реакційної суміші. Суміш перемішували протягом додаткових 2,5 годин в атмосфері азоту при 60 ºC. Додаткові 0,5 еквіваленти гепт-6-ин-1-олу (72 мг, 0,642 ммоль) в безводному N, N-диметилформаміді (0,5 мл) додавали до реакційної суміші. Суміш перемішували протягом додаткових 4 годин в атмосфері азоту при 60 ºC та потім давали охолонути температури навколишнього середовища протягом ночі. Реакційну суміш випаровували в вакуумі, одержуючи коричневу олію. Одержану в результаті олію розподіляли між етилацетатом (25 мл) та сумішшю вода/насичений сольовий розчин (1:1, 15 мл). Органічний шар відокремлювали та водну фазу знову екстрагували етилацетатом (25 мл). Об'єднані органічних екстракти пропускали через гідрофобну фриту та випаровували в вакуумі, одержуючи проміжну сполуку алкін у вигляді оранжевої олії (1,21 г). Суміш олії та 10 % паладію на вугіллі (200 мг) в етанолі (20 мл) перемішували в атмосфері водню протягом 22 годин. Реакційну суміш фільтрували через картридж з целіту (10 г) та випаровували в вакуумі, одержуючи оранжеву олію. Олію розчиняли в мінімальному об'ємі дихлорметану, завантажували в 50 г силікагелевий картридж та очищали, застосовуючи градієнт 0-100 % етилацетату в циклогексані протягом 60 хвилин з наступним елююванням етилацетатом (300 мл), потім 10 % метанолом в дихлорметані (70 мл). Відповідні фракції об'єднували та випаровували в вакуумі, одержуючи оранжеву олію. Олію розчиняли в мінімальному об'ємі дихлорметану, завантажували в 50 г силікагелевий картридж та очищали, застосовуючи градієнт 0-10 % метанолу в дихлорметані протягом 40 хв. (детектування на довжині хвилі = 230 нм). Відповідні фракції об'єднували та випаровували в вакуумі, одержуючи жовту олію (380 мг). Суміш олії та 10 % паладію на вугіллі (200 мг) в етанолі (20 мл) перемішували в атмосфері водню протягом 20 годин. Реакційну суміш фільтрували через целітовий картридж (10 г) та випаровували в вакуумі, одержуючи названу сполуку у вигляді світло-жовтої олії (264 мг). + РХ-МС (Система B): tУТР. = 1,17 хв.; MH 456 Проміжна сполука 21: 3-(7-Бромгептил)-5-бутил-N-(2,4-диметоксибензил)-1H-піразоло[4,3d]піримідин-7-амін 26 UA 114109 C2 5 10 15 20 25 30 35 40 45 50 55 60 Розчин трифенілфосфіну (182 мг, 0,695 ммоль) в дихлорметані (2 мл) додавали по краплям до розчину, що перемішували, з 7-(5-бутил-7-((2,4-диметоксибензил)аміно)-1H-піразоло[4,3d]піримідин-3-іл)гептан-1-олу (264 мг, 0,579 ммоль) та тетрабромметану (231 мг, 0,695 ммоль) в дихлорметані (5 мл). Реакційну суміш перемішували при кімнатній температурі протягом 18 годин. До реакційної суміші додавали додаткову порцію тетрабромметану (231 мг, 0,695 ммоль) та трифенілфосфіну (182 мг, 0,695 ммоль). Перемішування при температурі навколишнього середовища продовжували протягом 2 годин. Розчинник випаровували в вакуумі, одержуючи жовту олію. Олію розчиняли в безводному дихлорметані (ДХМ) (7 мл) та перемішували при кімнатній температурі протягом 1,5 годин. Тетрабромметан (231 мг, 0,695 ммоль) та трифенілфосфін (182 мг, 0,695 ммоль) додавали до реакційної суміші. Перемішування при температурі навколишнього середовища продовжували протягом 17,5 годин. Додатковий тетрабромметан (115 мг, 0,348 ммоль) та трифенілфосфін (91 мг, 0,348 ммоль) додавали до реакційної суміші. Перемішування при температурі навколишнього середовища продовжували протягом 2 годин. Реакційну суміш випаровували в вакуумі, одержуючи прозору олію. Одержану в результаті олію розподіляли між етилацетатом (10 мл) та сумішшю вода/насичений сольовий розчин (1:1, 15 мл). Органічний шар відокремлювали, пропускали через гідрофобну фриту та випаровували в вакуумі, одержуючи світло-жовту тверду речовину (1,40 г). Тверду речовину розчиняли в мінімальному об'ємі дихлорметану, завантажували в 50 г силікагелевий картридж та очищали, застосовуючи градієнт 0-100 % етилацетату в циклогексані протягом 60 хвилин, потім 0-20 % метанол в ДХМ протягом 30 хвилин. Фракції, що містили тільки один компонент об'єднували та випаровували в вакуумі, одержуючи названу сполуку у вигляді світло-жовтої олії (55 мг). + РХ-МС (Система B): tУТР. = 1,47 хв.; MH 518, 520 Фракції, що містили два компонента об'єднували та випаровували в вакуумі, одержуючи додаткову порцію названої сполуки у вигляді 1:1 суміші з трифенілфосфіноксидом у вигляді світло-жовтої олії (270 мг). + + РХ-МС (Система B): tУТР. = 1,47 хв.; MH 518, 520: 0,98 хв.; MH 279. Проміжна сполука 22: 3-(6-(Азепан-1-іл)гексил)-5-бутил-N-(2,4-диметоксибензил)-1Hпіразоло[4,3-d]піримідин-7-амін До суспензії 5-бутил-3-(6-хлоргекс-1-ин-1-іл)-N-(2,4-диметоксибензил)-1H-піразоло [4,3d]піримідин-7-аміну (400 мг, 0,877 ммоль) та гексаметиленіміну (0,297 мл, 2,63 ммоль) в ацетонітрилі (7 мл) додавали триетиламін (0,367 мл, 2,63 ммоль) при температурі навколишнього середовища. Реакційну суміш перемішували при 60 °C в атмосфері азоту протягом 16 годин. Температуру підвищували до 80 °C та реакційну суміш залишали перемішуватись в атмосфері азоту протягом додаткових 7 годин. До реакційної суміші додавали розчин гексаметиленіміну (0,149 мл, 1,32 ммоль) та триетиламіну (0,184 мл, 1,32 ммоль) та залишали перемішуватись в атмосфері азоту 60 °C протягом додаткових 72 годин. Реакційну суміш випаровували в вакуумі, одержуючи коричневу олію, яку розподіляли між етилацетатом (50 мл) та водою (50 мл). Водний шар екстрагували, та органічний шар промивали насиченим сольовим розчином (50 мл), сушили, застосовуючи гідрофобну фриту, та концентрували в вакуумі, одержуючи коричневу олію. Олію розчиняли в мінімальній кількості дихлорметану, яку потім завантажували та очищали на амінопропілсилікагелевому картриджі (50 г), застосовуючи градієнт 0-100 % етилацетат-циклогексан, з наступним градієнтом 0-25 % метанол-дихлорметан протягом 60 хвилин. Відповідні фракції об'єднували та випаровували в вакуумі, одержуючи коричневу олію, який потім азеотропно дистилювали з дихлорметаном та петролейним етером (40-60), одержуючи коричневу тверду речовину (0,185 г). Тверду речовину розчиняли в етанолі (45 мл) та гідрогенували, застосовуючи H-cube (характеристики: 40 °C, Повністю H2, швидкість потоку 1 мл/хв) та 5 % Pd/C CatCart 30 як каталізатор. Розчинник, що одержували, концентрували в вакуумі, одержуючи коричневу олію, яку розчиняли в етанолі (20 мл) та гідрогенували застосовуючи H-cube (характеристики: 40 °C, Повністю H2, 1мл/хв швидкість потоку) та 5 % Pd/C CatCart 30 як каталізатор. Розчинник додатково гідрогенували, застосовуючи H-cube (характеристики: 40 °C, Повністю H2, 1мл/хв швидкість потоку 1мл/хв) та той самий 5 % Pd/C CatCart 30 як каталізатор. Одержаний розчин випаровували в вакуумі, одержуючи коричневу олію. Коричневу олію потім розчиняли в мінімальній кількості дихлорметану, який потім завантажували та очищали, застосовуючи хроматографію на амінопропілсилікагелі (20 г), застосовуючи градієнт 0-10 % метанолдихлорметану протягом 40 хвилин. Відповідні фракції об'єднували та випаровували в вакуумі, одержуючи коричневу олію, яку потім азеотропно дистилювали дихлорметаном та петролейним етером (40-60), одержуючи названу сполуку як коричневу олію (0,100 г). + РХ-МС (Система B): tУТР. = 1,19 хв.; MH 523 27 UA 114109 C2 5 10 15 20 25 30 35 40 45 50 55 60 Проміжна сполука 23: 5-Бутил-3-(5-хлорпент-1-ин-1-іл)-N-(2,4-диметоксибензил)-1Hпіразоло[4,3-d]піримідин-7-амін Біс(трифенілфосфін)паладію(II) дихлорид (101 мг, 0,144 ммоль), триетиламін (0,403 мл, 2,89 ммоль) та купруму йодид (55,0 мг, 0,289 ммоль) додавали до дегазованого азотом розчину 5бутил-N-(2,4-диметоксибензил)-3-йод-1H-піразоло[4,3-d]піримідин-7-аміну (900 мг, 1,926 ммоль) в безводному N, N-диметилформаміді (23 мл). Суміш перемішували в атмосфері азоту та нагрівали до 60 ºC перед додаванням 5-хлорпент-1-ину (296 мг, 2,89 ммоль) в безводному N, Nдиметилформаміді (2 мл). Реакційну суміш перемішували при 60 ºC протягом 3 годин. Додаткові 0,30 еквіваленти 5-хлорпент-1-ину (59 мг, 0,575 ммоль) в безводному N, N-диметилформаміді (1 мл) додавали до реакційної суміші. Суміш перемішували при 60 ºC протягом додаткових 2,5 годин та потім давали охолонути до кімнатної температури протягом ночі. Реакційну суміш випаровували в вакуумі, одержуючи коричневу олію. Одержану в результаті олію розподіляли між етилацетатом (25 мл) та сумішшю вода/насичений сольовий розчин (1:1, 10 мл). Органічний шар відокремлювали, пропускали через гідрофобну фриту та випаровували в вакуумі, одержуючи коричневу олію (1,32 г). Олію розчиняли в мінімальному об'ємі дихлорметану, завантажували в 100 г силікагелевий картридж та очищали хроматографією, застосовуючи градієнт 0-100 % етилацетату в циклогексані протягом 60 хвилин. Відповідні фракції об'єднували та випаровували в вакуумі, одержуючи оранжеву олію. Олію розчиняли в мінімальному об'ємі дихлорметану, завантажували в 100 г силікагелевий картридж та знову очищали хроматографією, застосовуючи градієнт 0-100 % етилацетату в циклогексані протягом 60 хвилин. Відповідні фракції об'єднували та випаровували в вакуумі, одержуючи названу сполуку у вигляді оранжевої олії (720 мг). + РХ-МС (Система B): tУТР. = 1,32 хв.; MH 442, 444. Проміжна сполука 24: (S)-5-Бутил-N-(3,4-диметоксибензил)-3-(6-(3-флуорпіролідин-1іл)гексил)-1H-піразоло[4,3-d]піримідин-7-амін До розчину, що перемішували, з 5-бутил-3-(6-хлоргекс-1-ин-1-іл)-N-(3,4-диметокси бензил)1H-піразоло[4,3-d]піримідин-7-аміну (225 мг, 0,493 ммоль) в ацетонітрилі (4 мл) додавали триетиламін (0,413 мл, 2,96 ммоль) та (S)-3-флуорпіролідину гідрохлорид (186 мг, 1,480 ммоль). Одержану в результаті суміш нагрівали при 60 °C протягом 22 годин. До реакційної суміші додавали додатковий (S)-3-флуорпіролідину гідрохлорид (186 мг, 1,480 ммоль) та додатковий триетиламін (0,413 мл, 2,96 ммоль) та продовжували нагрівання при 75 ºC протягом 20 годин. Реакційну суміш концентрували в вакуумі та залишок розподіляли між ДХМ (20 мл) та водою (20 мл). Органічну фазу відокремлювали та сушили, застосовуючи гідрофобну фриту перед концентруванням в вакуумі, одержуючи темно-червону олію. Сиру речовину розчиняли в MeOH (40мл) та гідрогенували, застосовуючи H-Cube (параметри: 40 ºC, повністю H2). Сиру суміш концентрували в вакуумі, знову розчиняли в мінімальній кількості ДХМ та завантажували в верхню частину амінопропілсилікагелевого картриджа (70 г). Колонку елюювали, застосовуючи градієнт 0-100 % EtOAc/циклогексан протягом 60 хвилин з наступним промиванням 0-25 % MeOH/ДХМ. Відповідні фракції об'єднували та випаровували в вакуумі, одержуючи оранжеву олію. Олію розчиняли в метанолі (40 мл) та проганяли через H-cube (параметри: повністю H2, 40 ºC, 10 % паладій на вугіллі CatCart30 як каталізатор). Розчин концентрували в вакуумі, одержуючи названу сполуку у вигляді світло-жовтої олії (119 мг). + РХ-МС (Система B): tУТР. = 1,19 хв.; MH 513 Проміжна сполука 25: (S)-5-Бутил-N-(2,4-диметоксибензил)-3-(5-(3-флуорпіролідин-1іл)пентил)-1H-піразоло[4,3-d]піримідин-7-амін Триетиламін (0,860 мл, 6,20 ммоль) додавали до суміші (S)-3-флуорпіролідину гідрохлориду (390 мг, 3,10 ммоль) та 5-бутил-3-(5-хлорпент-1-ин-1-іл)-N-(2,4-диметокси бензил)-1Hпіразоло[4,3-d]піримідин-7-аміну (457 мг, 1,034 ммоль) в N, N-диметил формаміді (7 мл). Суміш нагрівали до 80 ºC та перемішували протягом 18 годин. Додаткову порцію (S)-3флуорпіролідину гідрохлориду (195 мг, 1,55 ммоль) та триетиламіну (0,430 мл, 3,10 моль) додавали до реакційної суміші. Реакційну суміш перемішували при 80 ºC протягом додаткових 6 годин. N, N-Диметилформамід (3 мл) додавали та реакційну суміш перемішували при 80 ºC протягом додаткових 18 годин та потім давали охолонути до кімнатної температури. Суміш випаровували в вакуумі, одержуючи коричневу олію. Одержану в результаті олію розподіляли між дихлорметаном (50 мл) та сумішшю вода/насичений сольовий розчин (20 мл). Органічний шар відокремлювали, пропускали через гідрофобну фриту та випаровували в вакуумі, одержуючи коричневу олію. Олію розчиняли в мінімальному об'ємі дихлорметану, завантажували в 50 г функціоналізований амінопропілсилікагелевий картридж та очищали, застосовуючи градієнт 0-10 % метанолу в дихлорметані протягом 40 хвилин. (детектування на довжині хвилі = 230 нм). Відповідні фракції об'єднували та випаровували в вакуумі, одержуючи 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPyrazolopyrimidine compounds
Автори англійськоюCoe, Diane, Mary, Smith, Stephen, Allan
Автори російськоюКоу Даян Мэри, Смит Стивэн Эллан
МПК / Мітки
МПК: C07D 487/04, A61K 31/519
Мітки: сполуки, піразолопіримідинові
Код посилання
<a href="https://ua.patents.su/45-114109-pirazolopirimidinovi-spoluki.html" target="_blank" rel="follow" title="База патентів України">Піразолопіримідинові сполуки</a>
Попередній патент: Моноклональне антитіло для застосування в діагностиці і терапії злоякісних пухлин і аутоімунного захворювання
Наступний патент: Гербіцидні композиції, які містять 4-аміно-3-хлор-5-фтор-6-(4-хлор-2-фтор-3-метоксифеніл)піридин-2-карбонову кислоту
Випадковий патент: Відкривний пристрій для пакувального контейнера та спосіб його виготовлення