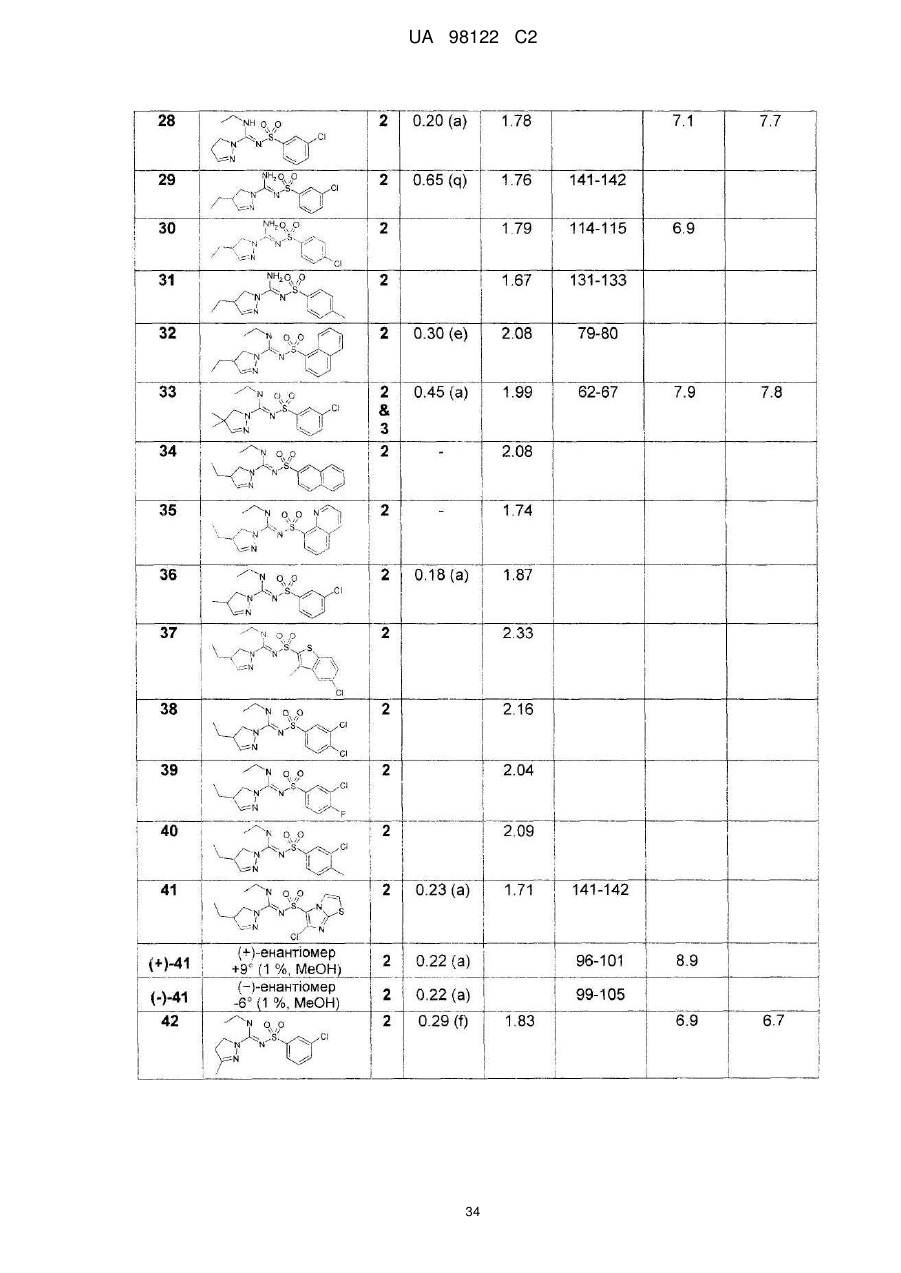
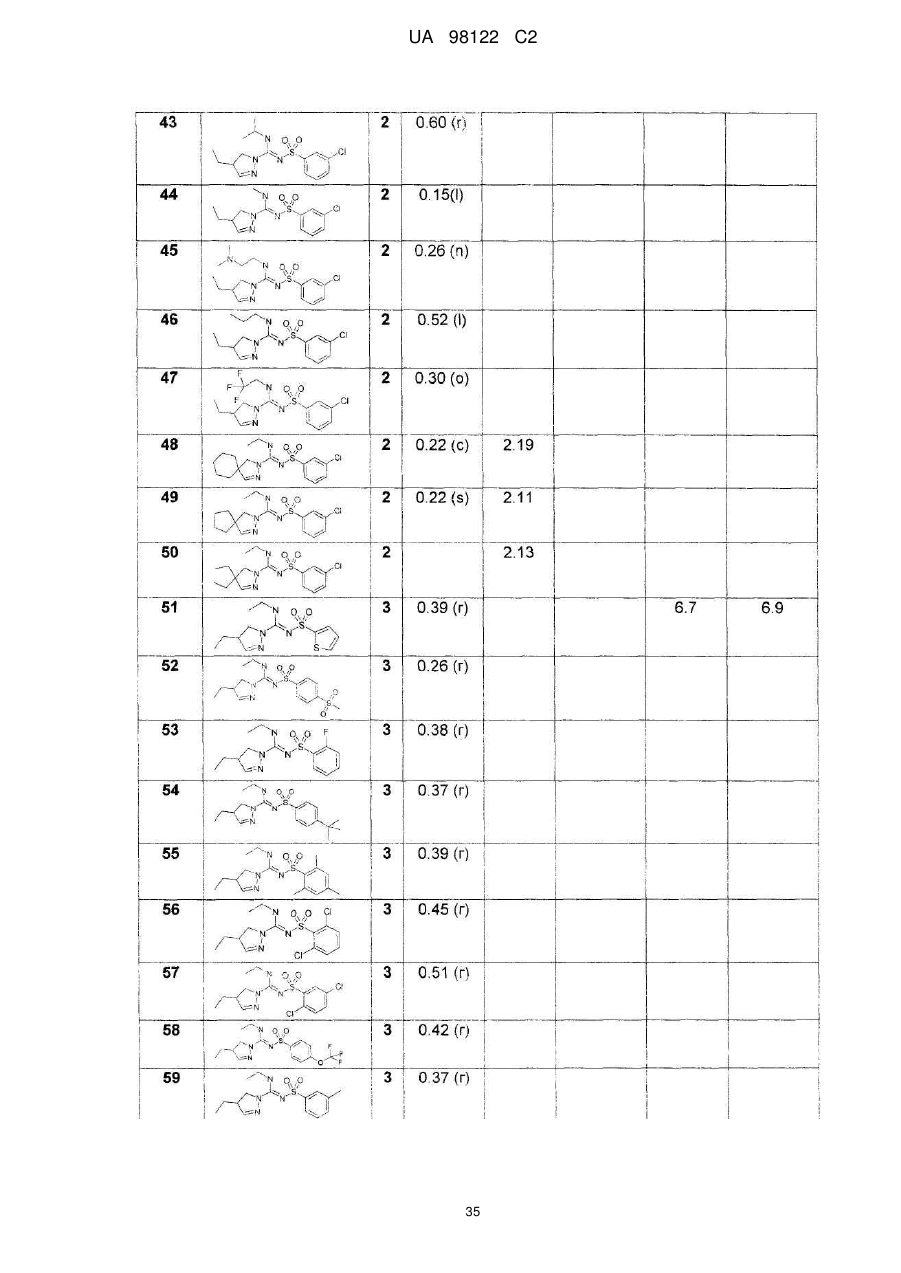
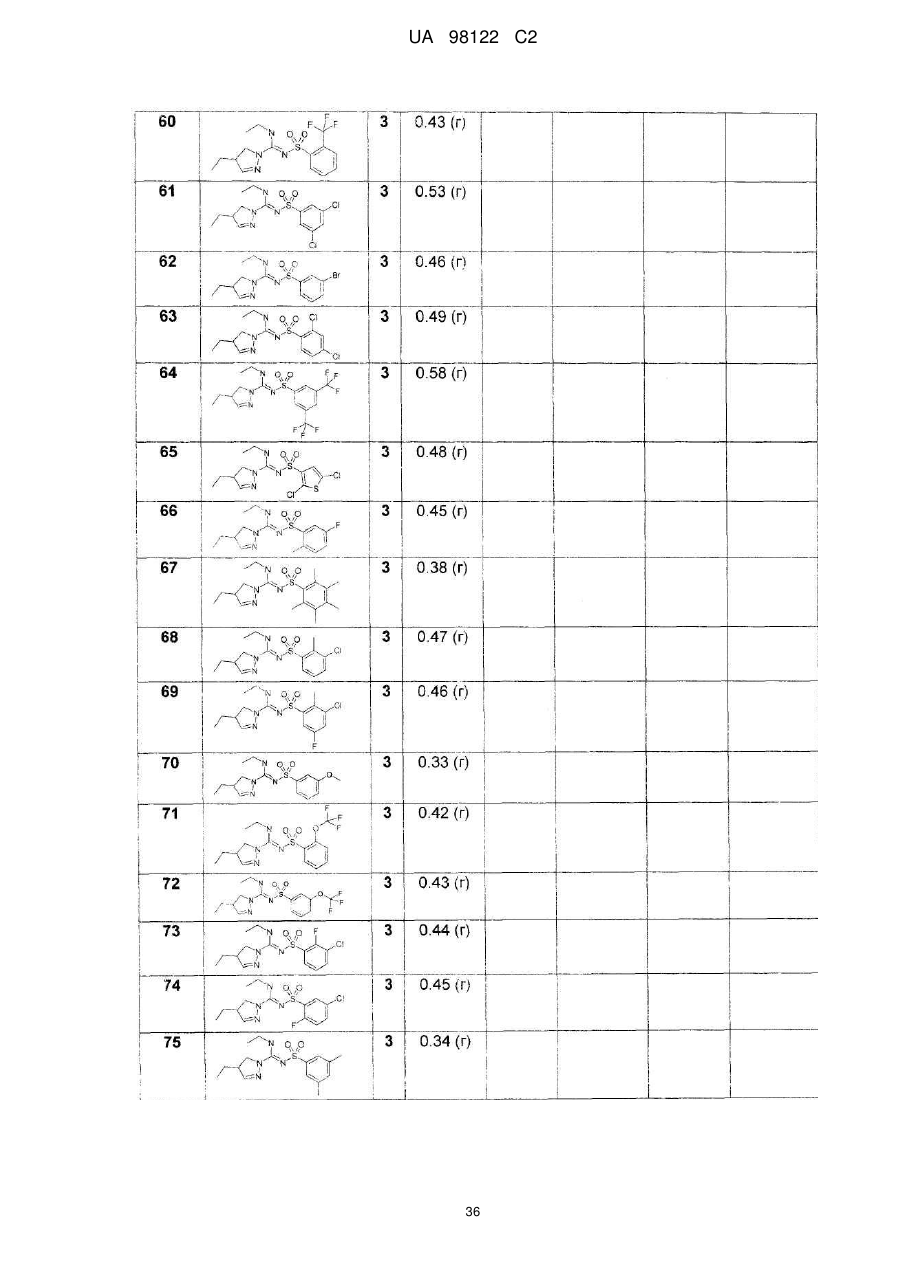
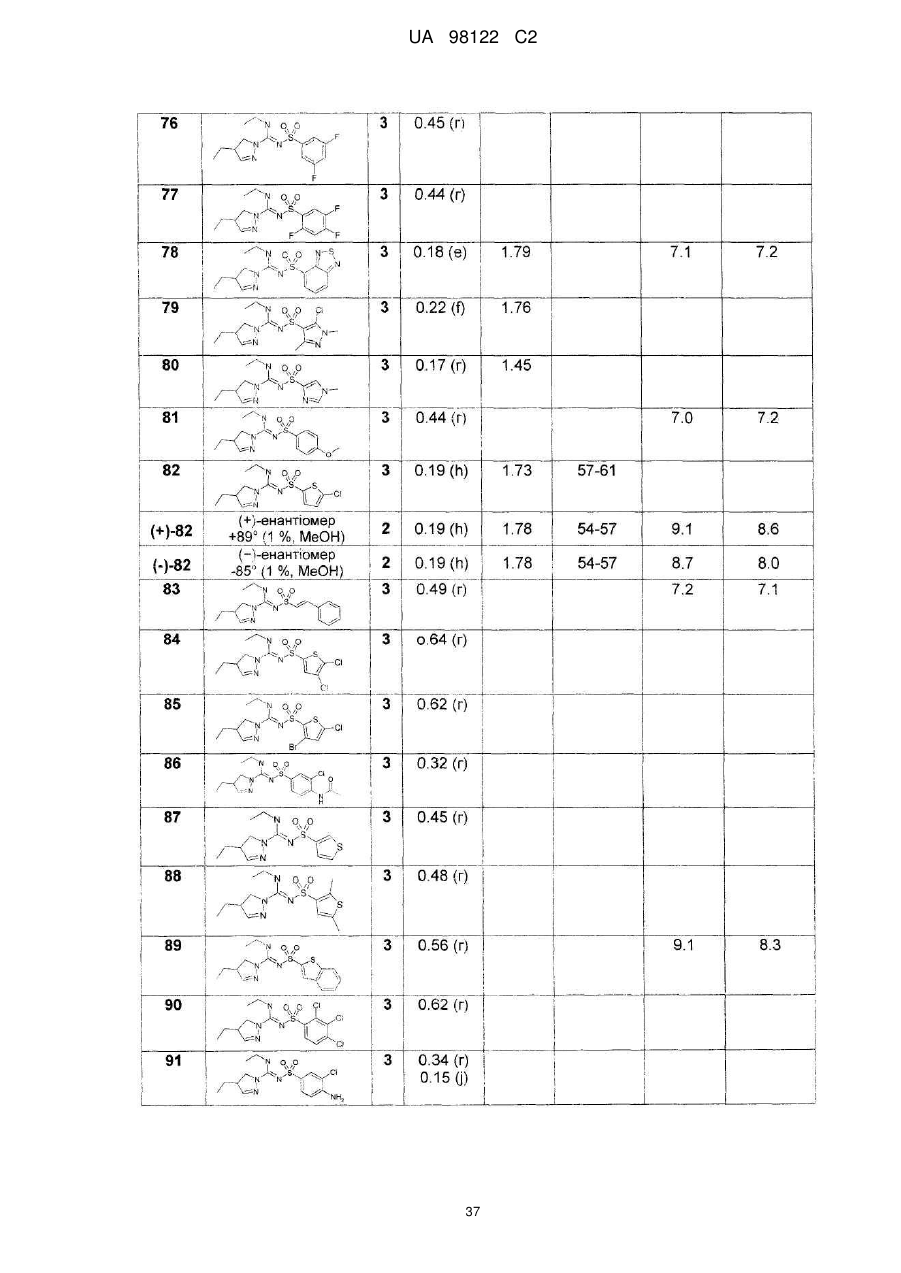
Похідні сульфонілпіразол та сульфонілпіразолон карбоксамідину як антагоністи рецепторів 5-ht6
Номер патенту: 98122
Опубліковано: 25.04.2012
Автори: Івема Баккер Воутер І., Кейзер Гіскіас Г., ван дер Ньот Мартіна А.В., ван Лувезейн Арнольд, Зоргдрагер Ян, Крузе Корнеліс Г.
Формула / Реферат
1. Сполука формули (1)
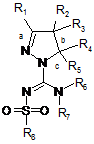
або її таутомер, стереоізомер, N-оксид або фармакологічно прийнятна сіль, гідрат або сольват будь-яких з вищевказаних, де:
R1 представляє водень, незаміщену алкіл(C1-4)групу, алкіл(C1-4)групу, заміщену одним або більше атомами галогену,
R2 та R3 незалежно представляють водень, незаміщену алкіл(C1-4)групу, алкіл(C1-4)групу, заміщену одним або більше атомами галогену, або
R1 та R2, разом з атомами вуглецю, маркованими ‘a’ та ‘b’, утворюють C5-8-циклоалкільне кільце, або
R2 та R3, разом з атомом вуглецю, маркованим ‘b’, утворюють C3-8-циклоалкільне кільце, або
R2 та R3, разом з атомом вуглецю, маркованим ‘b’, утворюють C5-8-гетероциклоалкільне кільце, не заміщене або заміщене одним або більше замісниками Y, вибраними з-поміж (C1-3)алкілу, трифторметилу, фтору, хлору, брому, гідроксилу, (C1-3)алкілокси, трифторметокси та аміну, або
R4 та R5 незалежно представляють водень, незаміщену алкіл(C1-4)групу, алкіл-(C1-4)групу, заміщену одним або більше атомами галогену, моноциклічну або конденсовану біциклічну ароматичну або гетероароматичну групу, які не заміщені або заміщені одним або більше замісниками Y, як визначено вище, де зазначена ароматична або гетероароматична група являє собою 5- або 6-членне кільце, що містить 0, 1 або 2 гетероатоми, вибрані з-поміж азоту, кисню або сірки, або
R3 та R4, разом з атомами вуглецю, маркованими ‘b’ та ‘c’, утворюють C3-8-циклоалкільне кільце, або
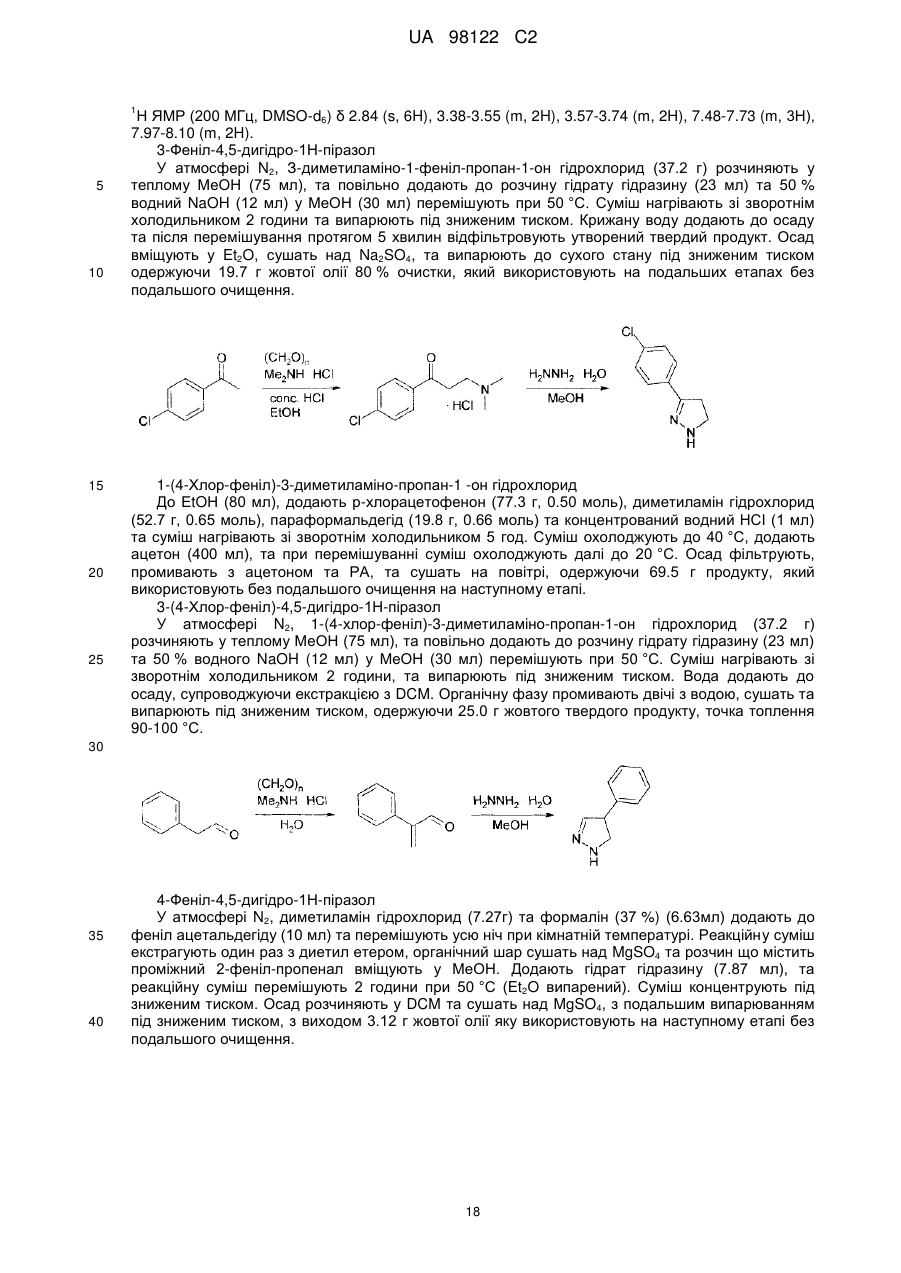
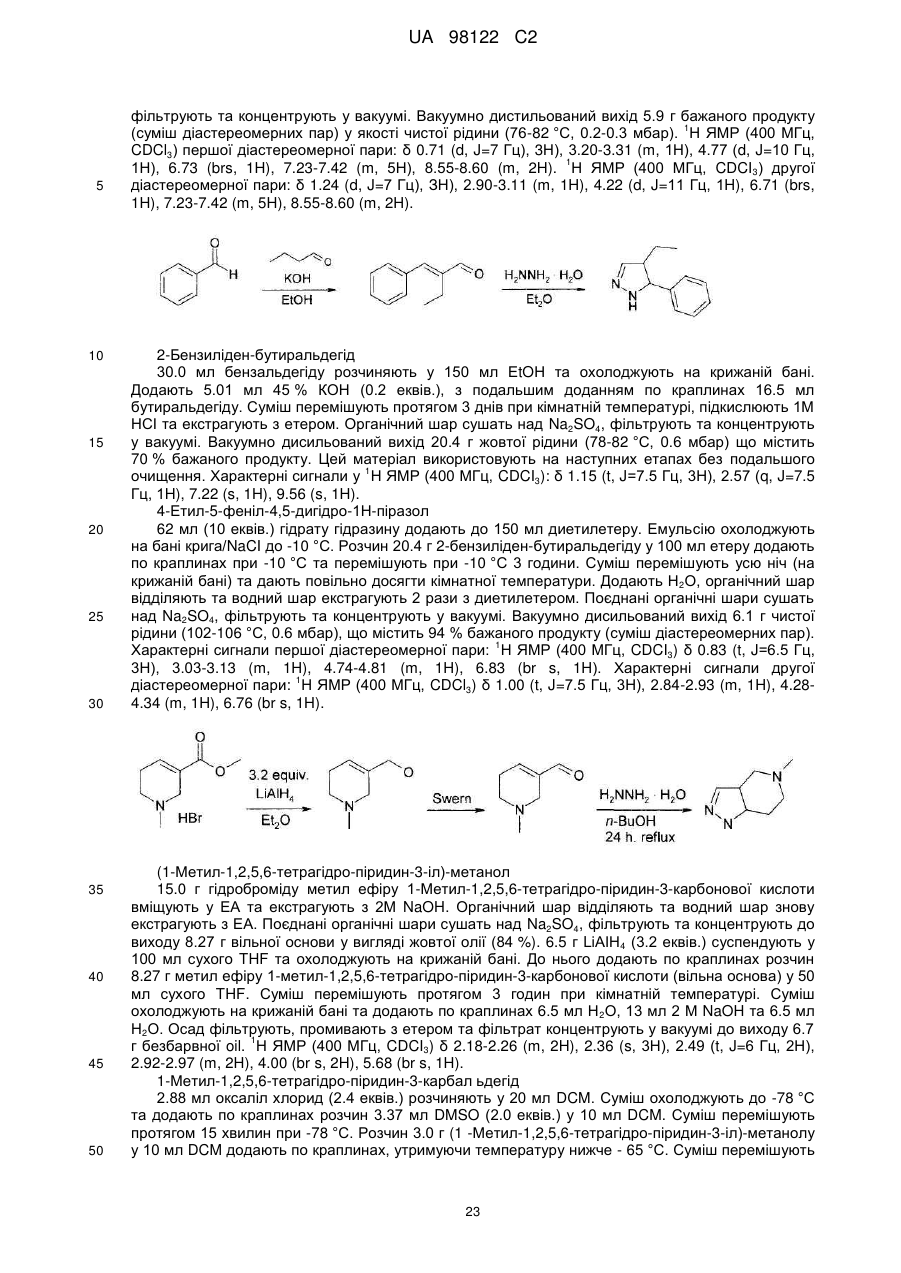
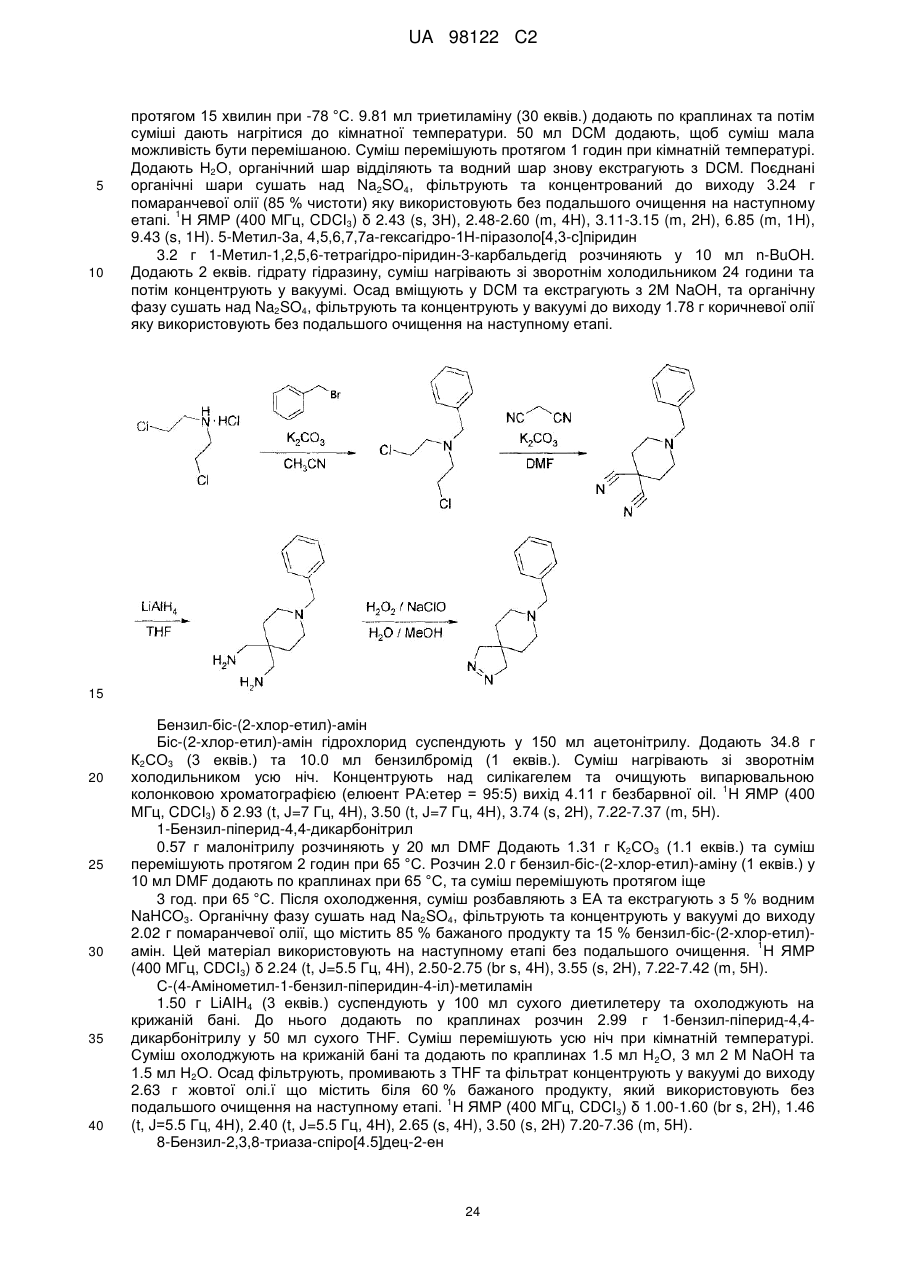
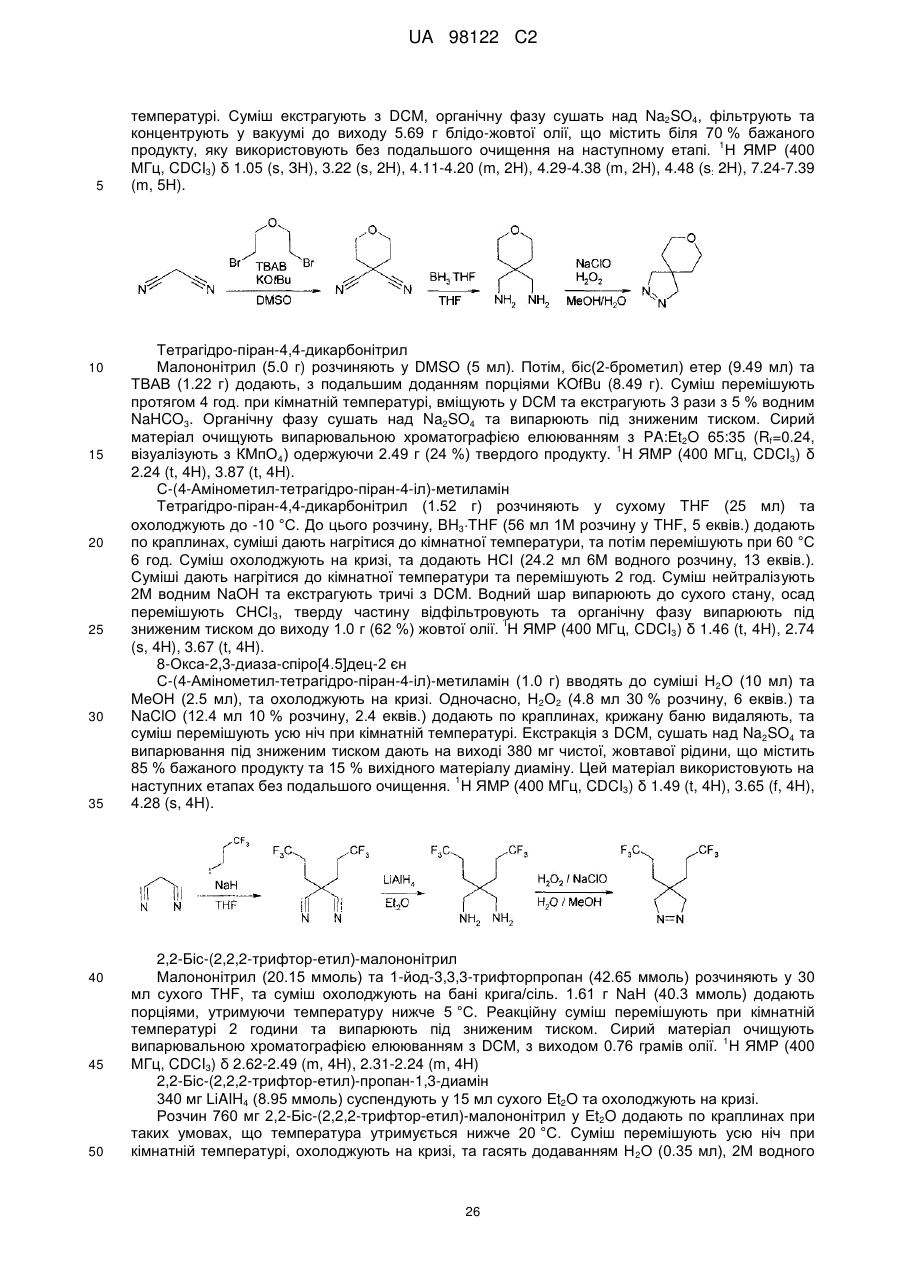
R3 та R4, разом з атомами вуглецю, маркованими ‘b’ та ‘c’, утворюють C5-8-гетероциклоалкільне кільце, причому групи є незаміщеними або заміщеними одним або більше замісниками Y, як визначено вище, або
R6 та R7 незалежно представляють атом водню, або алкіл(C1-4)групу або алкіл(C1-4)групу, заміщену одним або більше атомів галогену; або (C1-3)алкоксигрупу, або діалкіл(C1-3)аміноалкіл(C1-3)групу, або моноциклічну або конденсовану біциклічну ароматичну або гетероароматичну групу, де зазначена ароматична або гетероароматична група являє собою 5- або 6-членне кільце, що містить 0, 1 або 2 гетероатоми, вибрані з-поміж азоту, кисню або сірки, або C5-8-циклоалкільну або C5-8-гетероциклоалкільну групу, причому циклічні групи є не заміщені або заміщені одним або більше замісниками Y, як визначено вище, за умови, що N-(4,6-диметил-2-піримідиніл)-4,5-дигідро-N’-[(4-метилфеніл)сульфоніл]-5-феніл-1H-піразол-1-карбоксімідамід виключений, або
R6 та R7, разом з атомом азоту, до якого вони приєднані, утворюють C5-8-гетероциклоалкільну групу, не заміщену або заміщену одним або більше замісниками Y, як визначено вище,
R8 представляє моноциклічну або конденсовану біциклічну ароматичну або гетероароматичну групу, де зазначена ароматична або гетероароматична група являє собою 5- або 6-членне кільце, що містить 0, 1 або 2 гетероатоми, вибрані з-поміж азоту, кисню або сірки, причому групи є не заміщені або заміщені одним або більше замісниками Y, як визначено вище, або R8 представляє -CR9=CR10-арильну групу, де R9 та R10 незалежно представляють водень або алкіл(C1-3)групу, та де ‘арил’ містить моноциклічну або конденсовану біциклічну ароматичну або гетероароматичну групу, де зазначена ароматична або гетероароматична група являє собою 5- або 6-членне кільце, що містить 0, 1 або 2 гетероатоми, вибрані з-поміж азоту, кисню або сірки, або R8 представляє -C≡C-арильну групу, де ‘арил’ має вищевказані значення, піперидинільну групу, не заміщену або заміщену одним або більше замісниками Y, як визначено вище, або групу -NR11R12, де R11 та R12 незалежно представляють водень, незаміщену алкіл-(C1-3)групу або фенільну або бензильну групу, причому фенільна або бензильна група є не заміщена або заміщена одним або більше замісниками Y, як визначено вище.
2. Сполука, як заявлено у пункті 1 формули (1), або таутомери, стереоізомери, N-оксиди або фармакологічно прийнятна сіль, гідрат або сольват будь-яких з вищевказаних, де:
R1 представляє водень або R1 та R2, разом з атомами вуглецю, маркованими ‘a’ та ‘b’, утворюють циклогексильне кільце,
R2 та R3 незалежно представляють водень або алкіл(C1-3)групу, або R2 та R3, разом з атомом вуглецю, маркованим ‘b’, утворюють циклопентильне або циклогексильне кільце,
R4 та R5 незалежно представляють водень, алкіл(C1-3)групу, або R3 та R4, разом з атомами вуглецю, маркованими ‘b’ та ‘c’, утворюють C3-8-циклоалкільне кільце,
R6 та R7 незалежно представляють атом водню або алкіл(C1-3)групу, або алкіл(C1-4)групу, заміщену одним або більше атомами галогену, або метоксигрупу, або циклогексильну групу, або 4-піперидинільну групу,
R8 має значення, як наведено у п. 1.
3. Сполука, як заявлено у пункті 1, формули (1):
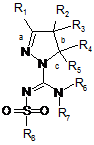 (I)
(I)
або таутомер, стереоізомер, N-оксид або фармакологічно прийнятна сіль, гідрат або сольват будь-яких з вищевказаних, де частина:
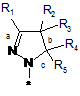
вибрана з-поміж:
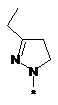 ,
, 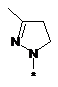 ,
, 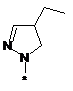 ,
, 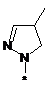 ,
, 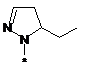 ,
, 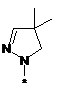 ,
, 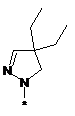 ,
, 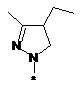 ,
, 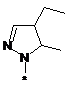 ,
, 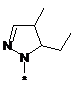 ,
,  ,
, 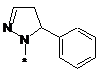 ,
, 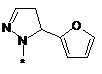 ,
, 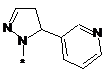 ,
, 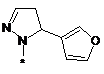 ,
, 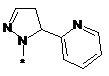 ,
, 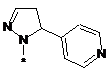 ,
,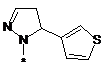 ,
,  ,
,  ,
,  ,
, 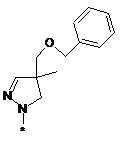 ,
, 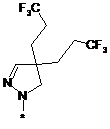
або
R1 та R2, разом з атомами вуглецю, маркованими ‘a’ та ‘b’, утворюють C5-8-циклоалкільне кільце, або
R2 та R3, разом з атомом вуглецю, маркованим ‘b’, утворюють C3-8-циклоалкільне або C5-8-гетероциклоалкільне кільце, не заміщене або заміщене одним або більше замісниками Y, вибраними з-поміж (C1-3)алкілу, трифторметилу, фтору, хлору, брому, гідроксилу, (C1-3)алкілокси, трифторметокси та аміно, або
R3 та R4, разом з атомами вуглецю, маркованими ‘b’ та ‘c’, утворюють C3-8-циклоалкільне або C5-8-гетероциклоалкільне кільце, не заміщене або заміщене одним або більше замісниками Y, як визначено вище,
R6 та R7 незалежно представляють атом водню або алкіл(C1-4)групу, або алкіл(C1-4)групу, заміщену одним або більше атомами галогену; або (C1-3)алкоксигрупу, або діалкіл(C1-3)аміноалкіл(C1-3)групу, або моноциклічну або конденсовану біциклічну ароматичну або гетероароматичну групу, де зазначена ароматична або гетероароматична група являє собою 5- або 6-членне кільце, що містить 0, 1 або 2 гетероатоми, вибрані з-поміж азоту, кисню або сірки, або C5-8-циклоалкільну або C5-8-гетероциклоалкільну групу, причому циклічні групи є не заміщені або заміщені одним або більше замісниками Y, як визначено вище, за умови, що сполука формули (1) не може бути N-(4,6-диметил-2-піримідиніл)-4,5-дигідро-N’-[(4-метилфеніл)сульфоніл]-5-феніл-1H-піразол-1-карбоксімідамідом, або
R6 та R7, разом з атомом азоту, до якого вони приєднані, утворюють C5-8-гетероциклоалкільну групу, не заміщену або заміщену одним або більше замісниками Y, як визначено вище,
R8 представляє моноциклічну або конденсовану біциклічну ароматичну або гетероароматичну групу, де зазначена ароматична або гетероароматична група являє собою 5- або 6-членне кільце, що містить 0, 1 або 2 гетероатоми, вибрані з-поміж азоту, кисню або сірки, причому групи є не заміщені або заміщені одним або більше замісниками Y, як визначено вище, або -CR9=CR10-арильну групу, де R9 та R10 незалежно представляють водень або алкіл(C1-3)групу, та де ‘арил’ містить моноциклічну або конденсовану біциклічну ароматичну або гетероароматичну групу, де зазначена ароматична або гетероароматична група являє собою 5- або 6-членне кільце, що містить 0, 1 або 2 гетероатоми, вибрані з-поміж азоту, кисню або сірки, або R8 представляє -C≡C-арильну групу, де ‘арил’ має вищевказані значення, піперидинільну групу, не заміщену або заміщену одним або більше замісниками Y, як визначено вище, або групу -NR11R12, де R11 та R12 незалежно представляють водень, алкіл(C1-3)групу або фенільну або бензильну групу, причому фенільна або бензильна група є не заміщена або заміщена одним або більше замісниками Y, як визначено вище.
4. Сполука, як заявлено у пункті 1, або таутомер, стереоізомер, N-оксид або фармакологічно прийнятна сіль, гідрат або сольват будь-яких з вищевказаних, де частина:
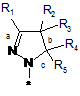
вибрана з-поміж:
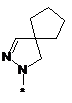 ,
, 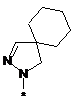 ,
,  ,
, 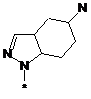 ,
, 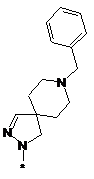 ,
, 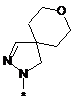
тa де R6, R7 та R8 мають значення, як наведено у п. 1.
5. Сполука, як заявлено у пункті 1 формули (1), або таутомер, стереоізомер, N-оксид або фармакологічно прийнятна сіль, гідрат або сольват будь-яких з вищевказаних, де: R1, R4, R5 та R6 представляють водень, R2 та R3 незалежно представляють алкіл(C1-3)групу, або R2 та R3, разом з атомом вуглецю, маркованим ‘b’, утворюють циклопентильне або циклогексильне кільце, R7 представляє алкіл(C1-3)групу та R8 має значення, як наведено у п. 1.
6. Сполука, як заявлено у пункті 1 формули (1), вибрана з-поміж формул:
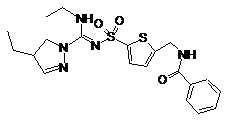 ,
, 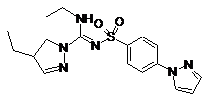 ,
,
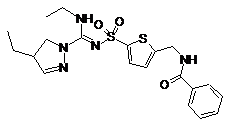 ,
, 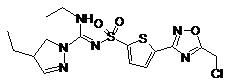 .
.
7. Сполука, як заявлено у будь-якому з пп. 1-6, або або таутомер, стереоізомер, N-оксид або фармакологічно прийнятна сіль, гідрат або сольват будь-яких з вищевказаних, зазначена сполука є оптично активним енантіомером.
8. Лікарський засіб, який містить сполуку згідно з будь-яким з пп. 1-7 або її фармакологічно прийнятну сіль, гідрат або сольват.
9. Лікарський засіб за п. 8 для лікування захворювання Паркінсона, хореї Гантінгтона, шизофренії, бентежності, депресії, маніакальної депресії, психозів, епілепсії, нав'язливих компульсивних розладів, розладів настрою, мігрені, хвороби Альцгеймера, пов'язаного з віком зниження пізнавальних здатностей, легкого погіршення пізнавальних здатностей, розладів сну, розладів харчування, анорексії, булімії, розладів харчування, викликаних пиятикою, нападів паніки, акатизії, розладів дефіциту уваги з гіперактивністю, розладів дефіциту уваги, припинення зловживання кокаїном, етанолом, нікотином або бензодіазепінами, болю, розладів, пов'язаних з травмою спинного мозку або пошкодженням голови, гідроцефалії, функціональних розладів кишечнику, синдрому подразненого кишечнику, ожиріння та діабету типу 2.
10. Лікарський засіб за п. 8, який додатково містить принаймні один додатковий терапевтичний засіб.
11. Комбінований препарат, який містить (і) сполуку, як заявлено у пункті 1 формули (1), або її фармакологічно прийнятну сіль або гідрат, та (іі) інший медикамент, для одночасного, роздільного або послідовного застосування у терапії захворювання Паркінсона, хореї Гантінгтона, шизофренії, бентежності, депресії, маніакальної депресії, психозів, епілепсії, нав'язливих компульсивних розладів, розладів настрою, мігрені, хвороби Альцгеймера, пов'язаного з віком зниження пізнавальних здатностей, легкого погіршення пізнавальних здатностей, розладів сну, розладів харчування, анорексії, булімії, розладів харчування, викликаних пиятикою, нападів паніки, акатизії, розладів дефіциту уваги з гіперактивністю, розладів дефіциту уваги, припинення зловживання кокаїном, етанолом, нікотином або бензодіазепінами, болю, розладів, пов'язаних з травмою спинного мозку або пошкодженням голови, гідроцефалії, функціональних розладів кишечнику, синдрому подразненого кишечнику, ожиріння та діабету типу 2.
12. Сполука загальної формули (1Х):
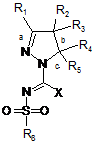 , (1X)
, (1X)
де X представляє або галоген, або 8-алкіл(С1-4), а інші радикали мають значення, як наведено у п. 1, та її таутомер, стереоізомер та N-оксид, а також фармакологічно прийнятна сіль, гідрат та сольват зазначеної сполуки формули (1X), яка придатна для синтезу сполук загальної формули (1).
13. Сполука загальної формули (1Z):
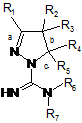 , (1Z)
, (1Z)
де радикали мають значення, як наведено у п. 1, та її таутомер, стереоізомер та N-оксид, яка придатна для синтезу сполуки загальної формули (1), за умови, що коли R1, R2, R3, R5 та R6 є водень та R4 є феніл, R7 не може бути воднем або 4,6-диметилпіримідин-2-ілом; та за умови, що, коли R2, R3, R5, R6 та R7 є водень та R1 є метил, R4 не може бути фенілом, 2-гідроксифенілом або 4-метилфенілом.
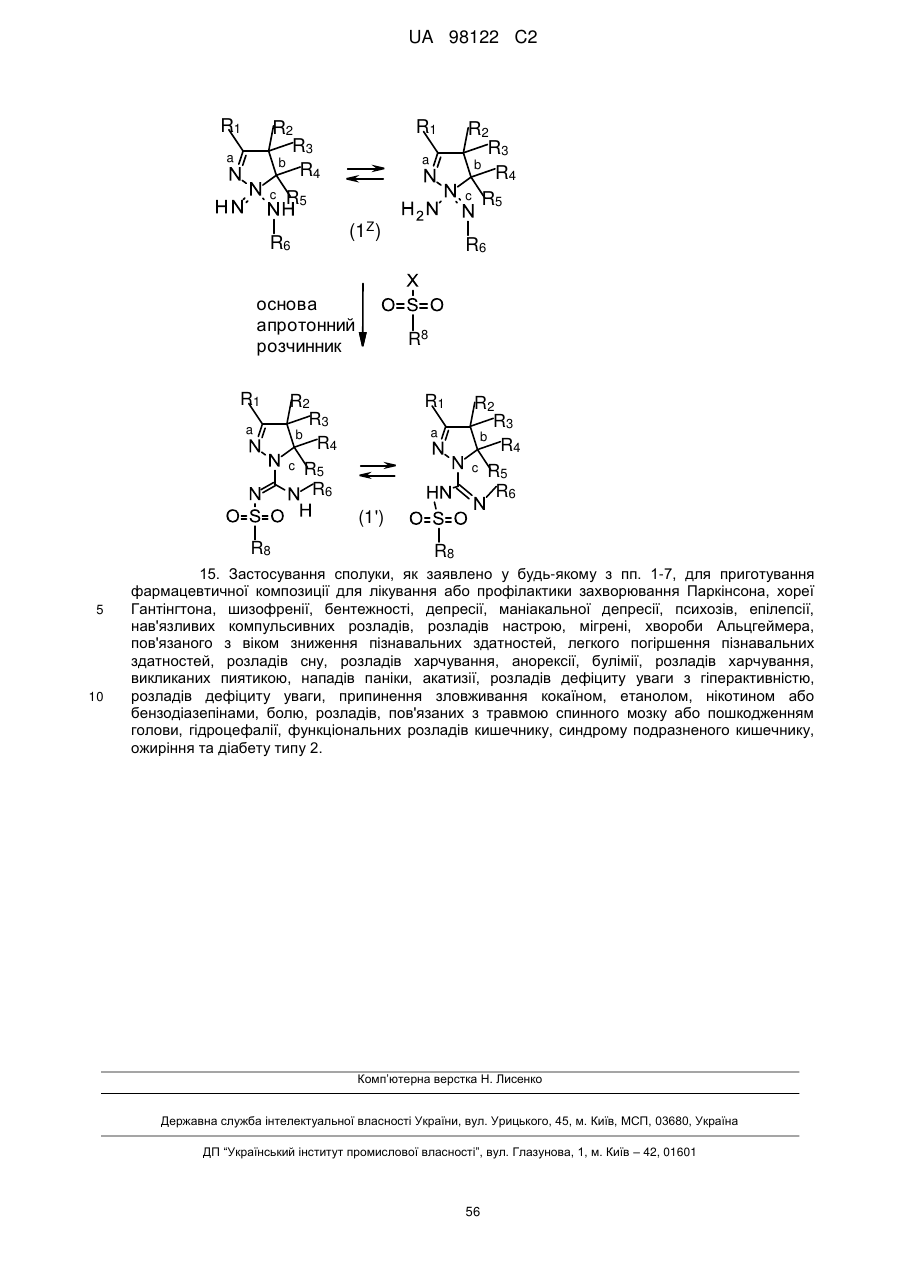
14. Спосіб одержання сполук, як заявлено у пункті 1, формули (1), де R7 є водень, відповідно, маємо формулу (1’), де усі радикали мають значення, як наведено у п. 1, в якому здійснюють:
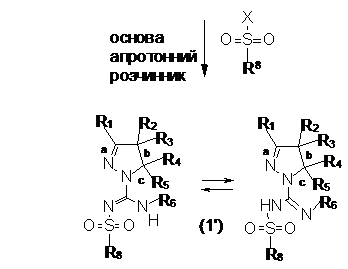
(і) реакцію сполуки формули (X), яку одержують реакцією сполуки формули (IX) з галогеналкілом, наприклад йодметилом, з піразоліном у присутності основи, з одержанням сполуки формули (1Z),
(іі) реакцію сполуки формули (1Z) з сульфонілгалогеном формули R8-SO2-X, де X є Вr, Сl або F, у апротонному розчиннику, як-то дихлорметан, у присутності основи, як-то діізопропілетиламін,
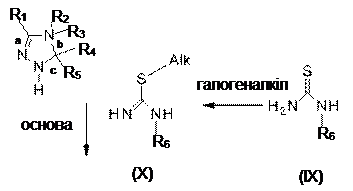
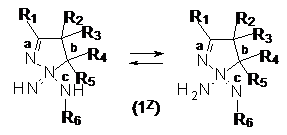
15. Застосування сполуки, як заявлено у будь-якому з пп. 1-7, для приготування фармацевтичної композиції для лікування або профілактики захворювання Паркінсона, хореї Гантінгтона, шизофренії, бентежності, депресії, маніакальної депресії, психозів, епілепсії, нав'язливих компульсивних розладів, розладів настрою, мігрені, хвороби Альцгеймера, пов'язаного з віком зниження пізнавальних здатностей, легкого погіршення пізнавальних здатностей, розладів сну, розладів харчування, анорексії, булімії, розладів харчування, викликаних пиятикою, нападів паніки, акатизії, розладів дефіциту уваги з гіперактивністю, розладів дефіциту уваги, припинення зловживання кокаїном, етанолом, нікотином або бензодіазепінами, болю, розладів, пов'язаних з травмою спинного мозку або пошкодженням голови, гідроцефалії, функціональних розладів кишечнику, синдрому подразненого кишечнику, ожиріння та діабету типу 2.
Текст
Реферат: Даний винахід стосується похідних сульфонілпіразолінкарбоксамідину як антагоністів рецепторів 5-НТ6, методів отримання цих сполук та нових проміжних сполук, придатних для їх синтезу. Винахід також стосується застосування таких сполук та композицій, зокрема їх застосування для введення їх пацієнтам для досягнення терапевтичного ефекту при лікуванні захворювання Паркінсона, хореї Гантінгтона, шизофренії, бентежності, депресії, маніакальної депресії, психозів, епілепсії, нав'язливих компульсивних розладів, розладів настрою, мігрені, хвороби Альцгеймера, пов'язаного з віком зниження пізнавальних здатностей, легкого погіршення пізнавальних здатностей, розладів сну, розладів харчування, анорексії, булімії, розладів харчування, викликаних пиятикою, нападів паніки, акатизії, розладів дефіциту уваги з гіперактивністю, розладів дефіциту уваги, припинення зловживання кокаїном, етанолом, нікотином або бензодіазепінами, болю, розладів, пов'язаних з травмою спинного мозку або пошкодженням голови, гідроцефалії, функціональних розладів кишечнику, синдрому подразненого кишечнику, ожиріння та діабету типу 2. Сполуки мають загальну формулу (1): R1 R2 a b N N N c N R3 R4 R5 R6 O S O R7 R8 , (I) де символи мають значення, як наведено в описі. UA 98122 C2 5 10 15 20 25 30 35 40 45 50 Винахід стосується фармацевтичної та органічної хімії, і охоплює похідні сульфонілпіразолін карбоксамідину, проміжні сполуки, композицїта методи. Серотонін (5-гідрокситриптамін або 5-НТ), ключовий трансміттер периферійної та центральної нервової системи, модулює широкий ряд фізіологічних та патологічних функцій, медійованих за допомогою ряду сімейств рецепторів, названих 5-НТ1, 5-НТ2 5-НТ3 5-НТ4, 5-НТ5 5-НТ6 та 5-НТ7. Хоча функції трьох останніх є менш зрозумілими, чим функції решти, є загальноприйнятим, що сполуки, які вибірково втручаються у 5-НТ-медійовану сигнальну трансдукцію є важливими новими лікарськими об‟єктами. Щурячий 5-НТ6 рецептор був клонований двома різними групами (Ruat, 1993; Sebben, 1994): і незадовго після цього був клонований такий же людський рецептор, поділяючи 89 % спорідненої послідовності, (Kohen, 1996). Значний нещодавній інтерес відносно рецептору 5НТ6 виник тому, що декілька психотропних засобів мають високу антагоністичну спорідненість до людського рецептора 5-НТ6 (Kohen, 1996; Roth, 1994). Ці сполуки містять амітриптилін (Кi=65 nМ) і атиповий антипсихотичний засіб клозапін (Кi=9.5 nМ), оланзапін (Кi=10 nМ), та квайтіапін (Кi=33 nМ). Проте, жодна з цих сполук не є селективною. Перші відомі вибіркові агоністи рецепторів 5-НТ6 - це Ro 04-6790 та Ro 63-0563. їх корисність обмежена їх помірною спорідненістю (Кi=50 nΜ та 12 nМ, відповідно) та слабкими фармакокінетичними властивостями (Sleight, 1998). При нещодавніх дослідженнях селективних антагоністів рецепторів 5-НТ6 Ro-046790 та SB-271046, було декілька доповідей стосовно активності цих сполук у моделях когнітивної дії. SB-271046 покращив активність в завданні "водний лабіринт Моріса" (Rogers, 1999). Ці результати є сумісними з висновком, що постійне інтрацеребровентикулярне введення "анти-сенс" олігонуклеотидів, направлене на послідовність рецептору 5-НТ6 призводитть до покращення у деяких вимірюваннях при виконанні завдання "водний лабіринт Моріса" (Bentiey, b 1999 ). Нещодавно доповідалось про дію антагоністів 5-НТ6 та "анти-сенс" олігонуклеотидів 5а НТ6 на зниження споживання їжі у щурів (Bentiey, 1997; Bentiey, 1999 ; Woolley, 2001). Опасистість - це стан, який характеризується тим, що підвищення вмісту жиру у тілі призводить до надлишкової ваги тіла понад прийнятні норми. Опасистість - це найважливіший харчовий розлад у західному світі і вона являє собою головну проблему зі здоров‟ям у індустріальних країнах. Цей розлад призводить до підвищення смертності завдяки збільшення випадків захворювань, таких як серцево-судинні захворювання, захворювання органів травлення, респіраторні захворювання, рак та діабет типу-2. Селективні ліганди 5-НТ6 визнають як потенціально корисні при лікуванні або профілактиці певних розладів центральної нервової системи, таких як хвороба Паркінсона, хорея Гантінгтона та/або шизофренія, бентежність, депресія, маніакальна депресія, психози, епілепсія, нав‟язливі компульсивні розлади, розлади настрою, мігрень, хвороба Альцгеймера (покращення когнитивної пам‟яті), вікове зниження когнітивних здібностей, м‟яке когнитивне погіршення, нейродегенеративні захворювання, які характеризуються погіршенням росту нейронів, розлади сну, розлади почуттів, такі як анорексія та булімія, розлади харчування, пов‟язані з пиятикою, напади паніки, акатізія, розлади дефіциту уваги з гіперактивністю (ADHD), розлади дефіциту уваги (ADD), відлучення від наркозалежності, як от від кокаїну, етанолу, нікотину та бензодіазепінів, та біль, а також розлади, що асоціюються із спинномозковою травмою та/або пошкодженням голови, як от гідроцефалія. Селективні ліганди 5-НТ6 також вважаються корисними при лікуванні певних шлунково-кишкових розладів, як от функціональні розлади кишківника та синдром подразненого кишківника, та при лікуванні або профілактиці опасистості та діабету типу-2, досягаючи зниження ваги тіла та зниження приросту ваги тіла. Зниження ваги тіла та приросту ваги тіла (наприклад, лікування розладів ваги тіла) досягається між іншим, шляхом зниження прийому їжі. Метою даного винаходу є забезпечення могутніх та селективних агоністів 5-НТ6 які хімічно не відносяться до будь-яких відомих антагоністів 5-НТ6, сполук придатних для лікування певних розладів ЦНС. Несподівано було встановлено, що певні похідні сульфонілпіразолін карбоксамідину є антагоністами рецепторів 5-НТ6. Винахід стосується сполук загальної формули (1): 1 UA 98122 C2 5 10 15 20 25 30 35 40 45 або таутомерів, стереоізомерів, N-оксидів, мічених ізотопами аналогів, або фармакологічно прийнятних солей, гідратів або сольватів будь-яких з вищевказаних, де: - R1 представляє водень, незаміщену алкіл(С1-4) групу, алкіл(С1-4) групу, заміщену одним або більше атомів галогену, або фенільну групу, вибірково заміщену одним або більше атомів галогену, - R2 та R3 незалежно представляють водень, незаміщену алкіл(С 1-4) групу, алкіл(С1-4)групу, заміщену одним або більше атомів галогену, алкіл(С 1-4)-О-алкіл(С1-4)-фенільну групу, вибірково заміщену одним або більше атомів галогену, або фенільну групу, вибірково заміщену одним або більше атомів галогену, або; R1 та R2, разом з атомами вуглецю, маркованими «а» та «b» утворюють С5-8-циклоалкільне кільце, або, R2 та R3, разом з атомом вуглецю, маркованим «b» утворюють С3-8-циклоалкільне кільце, або R2 та R3, разом з атомом вуглецю, маркованим «b» утворюють вибірково заміщене С5-8гетероциклоалкільне кільце, або - R4 та R5 незалежно представляють водень, незаміщену алкіл(С1-4) групу, алкіл(С1-4) групу, заміщену одним або більше атомів галогену, вибірково заміщену моноциклічну ароматичну групу, вибірково заміщену конденсовану-біциклічну ароматичну групу, вибірково заміщену моноциклічну гетеро-ароматичну групу, вибірково заміщену конденсовану-біциклічну гетероароматична групу, або, R3 та R4, разом з атомами вуглецю, маркованими «b» та «с» утворюють С3-8-циклоалкільне кільце, або R3 та R4, разом з атомами вуглецю, маркованими «b» та «с» утворюють вибірково заміщене С5-8-гетероциклоалкільне кільце, або - R6 та R7 незалежно представляють атом водню, або алкіл(С1-4) групу, або алкіл(С1-4) групу, заміщену одним або більше атомів галогену; або (С 1-3)алкокси групу, або диалкіл(С1-3)-аміноалкіл(С1-3) групу, або вибірково заміщену моноциклічну або конденсовану біциклічну ароматичну або гетеро-ароматичну групу, або вибірково заміщену С5-8-циклоалкільну групу або вибірково заміщену С5-8-гетероциклоалкільну групу, або R6 та R7, разом з атомом азоту, до якого вони приєднані, утворюють вибірково заміщену С58-гетероциклоалкільну групу, - R8 представляє вибірково заміщену моноциклічну ароматичну групу, вибірково заміщену конденсовану-біциклічну ароматичну групу, вибірково заміщену моноциклічну гетероароматичну групу, вибірково заміщену конденсовану-біциклічну гетеро-ароматичну групу, - CR9=CR10-арильну групу, де R9 та R10 незалежно представляють водень або алкіл-(С1-3) групу, -СС-арильну групу, вибірково заміщену піперидинільну групу, або група - NR11R12, де R11 та R12 незалежно представляють водень, алкіл-(С1-3) групу або вибірково заміщену фенільну або бензильну групу, Винахід стосується рацематів, сумішей діастереоізомерів, а аткож індивідуальних стереоізомерів сполук формули (1). Винахід також стосується Ε ізомеру, Ζ ізомеру та Ε/Ζ суміші сполуки формули (1). Винахід зокрема стосується сполук загальної формули (1) або таутомеріє, стереоізомерів, N-оксидів, мічені ізотопами аналоги, або фармакологічно прийнятних солей, гідратів або сольватів будь-яких з вищевказаних, де: - R1 представляє водень або R1 та R2, разом з атомами вуглецю, маркованими «а» та «b» утворюють циклогексильне кільце, - R2 та R3 незалежно представляють водень або алкіл(С1-3) групу, або R2 та R3, разом з атомом вуглецю, маркованим «b» утворюють циклопентильне або циклогексильне кільце, 2 UA 98122 C2 5 10 15 20 25 30 35 40 45 50 55 - R4 та R6 незалежно представляють водень, алкіл(С1-3) групу, або R3 та R4, разом з атомами вуглецю, маркованими «b» та «с» утворюють С3-8-циклоалкільне кільце, - R6 та R7 незалежно представляють атом водню, або алкіл(С1-3) групу, або алкіл(С1-4) групу, заміщену одним або більше атомів галогену; або метокси групу, або циклогексильну групу, або бензильну групу, або 4-піперидинільну групу, - R8 має значення, як наведено вище. Точніше, винахід стосується сполук загальної формули (1) або таутомеріє, стереоізомерів, N-оксидів, мічених ізотопами аналогів, або фармакологічно прийнятних солей, гідратів або сольватів будь-яких з вищевказаних, де: R1, R4, R5 та R6 представляють водень, R2 та R3 незалежно представляють алкіл(С1-3) групу, або R2 та R3, разом з атомом вуглецю, маркованим «b» утворюють а циклопентильне, або циклогексильне кільце, R7 представляє алкіл(C1-3) групу, R8 мae значення, як наведено вище. У іншому варіанті винахід стосується сполук формули (1) де один або обидва з двох потенційно асиметричних атомів вуглецю у піразоліновому кільці є лівообертовими або правообертовими енантіомерами. Сполуки за винаходом формули (1), а також їх фармакологічно прийнятні солі, мають антагоністичну активність стосовно рецепторів 5-НТ6. Вони використовуються у лікуванні розладів, по‟вязаних з рецепторами 5-НТ6, або таких розладів, які піддаються лікуванню шляхом дії на ці рецептори. Наприклад: хвороба Паркінсона, хорея Гантінгтона, шизофренія, бентежність, депресія, маніакальна депресія, психози, епілепсія, нав‟язливі компульсивні розлади, розлади настрою, мігрень, хвороба Альцгеймера, пов‟язане з віком зниження пізнавальних здатностей, легке погіршення пізнавальниз здатностей, розлади сну, розлади харчування, анорексія, булімія, розлади харчування, спричинені пиятикою, напади паніки, акатізія, розлади дефіциту уваги з гіперактивністю, розлади дефіциту уваги, припинення зловживання кокаїном, етанолом, нікотином або бензодіазепінами, біль, розлади, пов‟язані з травмою спинного мозку або пошкодженням голови, гідроцефалія, функціональні розхлади кишківника, синдром подразненого кишківника, опасистість та діабет типу-2. Інші варіанти здійснення винаходу включають в себе, але цим не обмежуються: Фармацевтичні композиції для лікування, наприклад, розладів або станів, що лікуються блокуванням рецепторів 5-НТ6, композиції, що містять сполуки формули(1) або їх фармацевтично прийнятні солі, та їх фармацевтично прийнятні носії; методи лікування розладів або станів, які піддіються лікуванню шляхом блокування 5-НТ6 рецепторів, згідно з яким ссавцю, який потребує такого лікування, вводять сполуку загальної формули (І) або її фармацевтично прийнятну сіль; фармацевтична композиція для лікування розладів або станів, обраних з-поміж перелічених розладів; методи лікування розладів або станів, обраних з-поміж перелічених розладів, згідно з яким ссавцю, який потребує такого лікування, вводять сполуку загальної формули (І) або її фармацевтично прийнятну сіль; фармацевтичні композиції для лікування розладів або станів, обраних з-поміж перелічених розладів, які містять сполуки загальної формули (І) або їх фармацевтично прийнятні солі, та а їх фармацевтично прийнятні носії; методи лікування розладів або станів, обраних з-поміж перелічених розладів, згідно з яким пацієнту, який потребує такого лікування, вводять сполуки формули (1) або їх фармацевтично прийнятні солі. методи антагонізації рецепторів канабіноїдів 5-НТ6, згідно з яким особі, що потребує такого лікування, вводять дійову кількість сполуки формули (1); Винахід також стосується використання сполуки формули (1) або її солі для виробництва ліків. Далі, винахід стосується комбінованого способу лікування, згідно з яким сполуку за винаходом, або її фармацевтично прийнятну сіль, або фармацевтичну композицію або композицію, що містить сполуку за винаходом, вводять одночасно, або послідовно, або у складі комбінованого препарату, з іншим лікарським засобом для лікування одного або кількох із перелізених станів. Інший лікарський засіб (засоби) можна вводити до, одночасно або після прийому сполук за винаходом. Винахід також пропонує сполуки, фармацевтичні композиції, набори та методики лікування розладів або станів, обраних з-поміж перелічених розладів, причому методика полягає у введенні особі, яка потребує лікування, сполуки формули (І) або її фармацевтично прийнятної солі. 3 UA 98122 C2 5 10 15 20 25 30 35 40 45 50 55 60 Сполуки за винаходом посідають ант агонізуючу активність щодо рецепторів 5-НТ6. Цю активність сполук за винаходом легко довести, наприклад, одним або кількома аналізами, які описані тут або відомі фахівцям. Далі, винахід пропонує способи одержання сполук за винаходом та проміжних сполук, що застосовуються у цих способах. Виділення та очищення описаних тут сполук та проміжних сполук може бути проведене, якщо бажано, шляхом будь-якої відповідної процедури розділення або очищення як от, наприклад, фільтрація, екстракція, кристалізація, колонкова хроматографія, тонкошарова хроматографія, товстошарова хроматографія, препаративна рідинна хроматографія з низьким або високим тиском, або поєднання цих процедур. Характерні пояснення відповідних процедур розділення та виділення можна отримати з препаратів та прикладів. Але, звичайно, також можуть використовуватись інші еквівалентні процедури розділення або виділення. Сполуки за даним винаходом можуть містити один або більше асиметричних центрів, а відтак виступати у вигляді рацематів та рацемічних сумішей, одиночних енантіомерів, діастереометричних сумішей та окремих діастереомерів. Додаткові асиметричні центри можуть існувати в залежності від виду замісника у молекулі. Кожний такий асиметричний центр незалежно продукує два оптичні ізомери. Всі можливі оптичні ізомери та діастереомери у сумішах та у вигляді повністю або частково очищених сполук охоплюються обсягом винаходу. Цей винахід включає всі ізомерні форми зазначених сполук. Формула (1) показує структуру класу сполук без переважної стереохімії. Окремий синтез таких діастереомерів або їх хроматографічне розділення досягаються відомими способами шляхом модифікації наведених тут прийомів. їх абсолютна стереохімія рентгенокристалографічним аналізом кристалічних кінцевих або проміжних продуктів, які за потребою виводять за допомогою реагенту, що містить асиметричний центр з відомою абсолютною конфігурацією. Можна розділяти рацемічні суміші сполук, виділяючи окремі енантіомери методами, відомими з рівня техніки, наприклад, сполученням рацемічної суміші сполук з енантіомерно чистою сполукою з утворенням суміші діастереомерів, з якої виділяють окремі діастереомери стандартними способами, наприклад, фракційною кристалізацією або хроматографією. При реакції сполучення часто використовують енантіомерно чисті кислоти або основи, наприклад, ()-ді-р-толуоїл-D-винну кислоту та/або (+)-ді-р-толуоїл-L-винну кислоту. Діастереомерні похідні можна далі перетворювати на чисті енантіомери відщепленням доданого хірального залишку. Рацемічну суміш сполук також можна розділяти хроматографічними способами, наприклад, відомим прийомом із застосуванням хіральних нерухомих фаз. Або ж будь-який енантіомер сполуки можна одержати відомими методами стереоселективного синтезу з оптично чистих вихідних матеріалів або реагентів відомої конфігурації. Ціс- та транс-ізомери сполуки формули (І) або її фармацевтично прийнятної солі також охоплюються обсягом винаходу, як і таутомери сполуки формули (І) або її фармацевтично прийнятної солі. Деякі кристалічні форми сполук можуть існувати як поліморфи, і це теж входить до обсягу винаходу. Крім того, деякі сполуки можуть утворювати сольвати з водою (тобто гідрати) або звичайними органічними розчинниками, які теж становлять частину винаходу. Мічені ізотопами сполуки формули (І) або їх фармацевтично прийнятні солі, у томі числі такі, що їх можна виявити методами PET (пентаеритрітол) або SPECT, а також сполуки формули (і), 13 14 3 18 125 мічені [ С]-, [ С]-, [ Н]-, [ F]-, [ I]- або іншими збагаченими ізотопами атомами, придатними для вивчення зв»язування рецепторів або метаболізму, теж входять до обсягу винаходу. Сполуки за винаходом можуть також використовуватись як реагенти або стандарти у біохімічних дослідженнях неврологічних функцій, дисфункцій та захворюваннь. Визначення Загальні терміни, використані в описі розкритих тут сполук мають свої загальні значення. Термін алкіл, як застосовано тут, означає стосується прямий чи розгалужений одновалентний насичений вуглеводневий ланцюг. Якщо не зазначено інше, такий ланцюг може містити від 1 до 18 атомів вуглецю. Представники таких алкільних груп - це метил, етил, пропил, ізопропил, бутил, ізобутил, сек-бутил, трет-бутил, пентил, ізопентил, неопентил, трет-пентил, гексил, ізогексил, гептил, октил, нонил, децил, ундецил, додецил, тридецил, тетрадецил, пентадецил, гексадецил, гептадецил, октадецил, та подібні. Коли вживається термін «нижча, алкільна група містить від 1 до 6 атомів вуглецю. Такий самий вміст вуглецю стосується до спорідненого терміну «алкан», та до термінів похідних, як от «алкокси». Вміст вуглецю різних вуглеводневовмісних частин визначений префіксом, що визначає мінімальну та максимальну кількість атомів вуглецю у частині, тобто, префікс С х-Су визначає кількість атомів вуглецю, присутніх від цілого "х" до цілого "у" включно. «Алкіл(С 1-3)» наприклад, означає метил, етил, n 4 UA 98122 C2 5 10 15 20 25 30 35 40 45 50 55 60 пропил або ізопропил, та «алкіл(С1-4)» означає «метил, етил, n-пропил, ізопропил, n-бутил, 2бутил, ізобутил або 2-метил-n-пропил». Термін «алкеніл» означає прямі або розгалужені вуглеводневі радикали, що мають один або більше подвійних зв‟язків вуглець-вуглець, як от вініл, аліл, бутеніл, тощо, та наприклад представляє (С 2-4)алкеніл. У «алкінільних» групах прямі або розгалужені вуглеводневі радикали мають один або більше потрійних зв»язків вуглецьвуглець, як от етиніл, пропаргіл, 1-бутиніл, 2-бутиніл, тощо, та наприклад представляють (С24)алкініл. Якщо не зазначено інше, «алкенільні» та «алкінільні» ланцюги можуть містити від 1 до 18 атомів вуглецю. Термін «ацил» означає алкіл(С1-3) карбоніл, арилкарбоніл або арил-алкіл(С13)карбоніл. Термін "арил" охоплює моноциклічні або конденсовані біциклічні ароматичні або гетероароматичні групи, які містять але цим не обмежуються: фурил, тієніл, пірроліл, оксазоліл, тіазоліл, імідазоліл, імідазо[2,1-b][1,3]тіазоліл, піразоліл, ізоксазоліл, ізотіазоліл, піридил, піридазиніл, піримідиніл, піразиніл, 1,3,5-триазиніл, феніл, індазоліл, індоліл, індолізиніл, ізоіндоліл, бензо[b]фураніл, 1,2,3,4-тетрагідро-нафтил, 1,2,3,4-тетрагідроізохіноліл, інданіл, інденіл, бензо[b]тієніл, 2,3-дигідро-1,4-бензодиоксин-5-іл, бензімідазоліл, бензотіазоліл, бензо[1,2,5]тіа-діазоліл, пуриніл, хіноліл, ізохіноліл, фталазиніл, хіназолиніл, хіноксалиніл, 1,8нафтиридиніл, нафтил, птеридиніл або азуленіл. «Гало» або «галоген» означає хлор, фтор, бром або йод; «гетеро» як у термінах «гетероалкіл, гетероароматична» тощо, означає, що містить один або більше атомів Ν, Ο або S. «Гетероалкіл» містить алкільні групи з гетероатомами у будь-якому положенні, тобто що містять N-зв»язані, О-зв»язані або S-зв»язані алкільні групи. Термін «заміщений» означає, що визначена група або частина має один або більше замісників. Коли будь-яка група може містити множинні замісники, та забезпечується різноманітність можливих замісників, замісники обрані незалежно, та можуть бути неоднаковими. Термін «незаміщений» означає, що визначена група не має замісників. «Вибірково заміщений» означає, що група може або ні бути в-подальшому заміщена однією або більше групами, обраними з-поміж С1-8 алкілу, С1-8 алкенілу, C1-8 алкінілу, арилу, фтору, хлору, брому, гідроксилу, С1-8 алкілокси, C1-8 алкенілокси, арилокси, ацилокси, аміну, С 1-8 алкіламіну, диалкіл(С1-8)-аміну, ариламіну, тіо, C1-8 алкілтіо, арилтіо, алкілсульфонілу, арилсульфонілу, алкілсульфінілу, арилсульфінілу, ціано, оксо, нітро, ацилу, амідо, С 1-8 алкіламідо, диалкіл(С18)амідо, карбоксилу, або два вибіркові замісники можуть разом з атомами вуглецю, до яких вони приєднані, утворювати 5- або 6-членне ароматичне або не-ароматичне кільце, що містить 0, 1 або 2 гетероатоми, обрані з-поміж азоту, кисню або сірки. Вибіркові замісники можуть самі мати додаткові вибіркові замісники. Переважні вибіркові замісники містять С 1-3 алкіл, як от наприклад, метил, етил, та трифторметил, фтор, хлор, бром, гідроксил, C1-3 алкілокси, як от наприклад, метокси, етокси та трифторметокси, та аміно. Щодо замісників, термін «незалежно» означає, що при наявності кількох замісників вони можуть бути однакові або різні один від одного. «С3-8-циклоалкіл» означає циклопропил, циклобутил, циклопентил, циклогексил, циклоргептил або циклооктил; «С5-8 гетероциклоалкіл» стосується гетеро атомів, які містять кільця, у тому числі, але не обмежуючись: піперидиніл, морфолініл, азепаніл, пірролідиніл, тіоморфолініл, піперазиніл, тетрагідрофурил, тетрагідропіраніл; «С5-10 біциклоалкільна група» відноситься до карбо-біциклічних кільцевих систем, які містять, але не обмежуються: біцикло[2.2.1]гептанільна, біцикло[3.3.0]октанільна або біцикло[3.1.1] гептанільна група; «С 6-10 трициклоалшіьна група» відноситься до карбо-трициклічних кільцевих систем, які містять, але не обмежуються: 1-адамантильну, норадамантильну або 2-адамантильну групу. Скорочення «С8-11 тетрациклоалкільна група» відноситься до карбо-тетрациклічних кільцевих систем, які містять, але не обмежуються: кубільну, гомокубільну або бішомокубільну групу. Терміни "окси", "тіо" та "карбо", як використовується тут, як частина іншої групи відповідно відносяться до атома кисню, сірки та карбонільної (С=О) групи, слугуючи лінкером між двома групами, як от наприклад гідроксил, оксиалкіл, тіоалкіл, карбоксиалкіл, тощо. Термін "аміно", як використовується тут, один, або як частина іншої групи, відноситься до атома азоту, який може бути або закінченням, або лінкером між двома іншими групами, де група може бути первинним, вторинним або третинним (два атом водню зв»язані з атомом азоту, один атом водню зв‟язаний з атомом азоту та жодного атому водню, зв»язаного з атомом азоту, відповідно) аміном. Терміни "сульфініл" та "сульфоніл", як використано тут, як частина іншої групи, відповідно відносяться до групи -SO- або - SO2-. Як використано тут, термін "вихідна група" (L) буде означати заряджений або незаряджений атом або группу, групу, що виходить під час реакції заміщення або переміщення. Термін відноситься до груп, які легко заміщуються нуклеофілом, як от амін, тіол або нуклеофіл спирту. Такі вихідні групи широко відомі з рівня техніки. Прикладами слугують, але ним не 5 UA 98122 C2 5 10 15 20 25 30 35 40 45 50 55 обмежуються, N-гідроксисукцинімід, N-гідроксибензотріазол, галіди (Вr, Сl, І), трифлати, мезилати, тозилати, та подібні. N-оксиди вищевказаних сполук охоплюються обсягом винаходу. Третинні аміни або породжують, або не породжують N-оксидні метаболіти. Ступінь N-окислення сягає від слідів до практично повної конверсії. N-оксиди можуть посідати більшу або меншу активність, ніж відповідні третинні аміни. Хоча N-оксиди легко відновлюються до відповідних третинних амінів хімічними засобами, у людському організмі це відбувається у різному ступені Деякі N-оксиди майже повністю відновлюються до третинних амінів, а в інших випадках така реакція майже або взагалі не відбувається (ВіскеІ, 1969). Будь-яка сполука, здатна перетворюватися in vivo на біоактивний засіб (тобто сполука формули (І)) являє собою проліки у межах обсягу винаходу. Проліки - це лікарські засоби, які самі по собі не є активними, але перетворюються на один або кілька активних метаболітів. Отже, у способах лікування за винаходом термін "введення" поширюється на лікування описаних хвороб сполукою, яка конкретно зазначена в описі або не зазначена, але перетворюється на зазначену сполуку in vivo після введення хворому. Проліки - це біозворотні похідні молекул лікарських речовин, які слугують для подолання певних бар‟єрів на користь вихідної лікарської молекули. До таких бар‟єрів належать, але цим не обмежуються, зокрема, розчинність, проникність, стабільність, пресистемний метаболізм та обмеження прицільності (Bundgaard, 1985; Кіnг, 1994; Stella, 2004; Ettmayer, 2004; Jarvinen, 2005). Проліки, тобто сполуки, які, потрапляючи до людського організму, метаболізуються у сполуки формули (І), охоплюються обсягом винаходу. Зокрема, це стосується сполук, що містять первинні чи вторинні амінні або гідроксігрупи. Такі сполуки можуть реагувати з органічними кислотами з утворенням сполук формули (І), де присутня додаткова група легко видаляється після введення; це, наприклад, амідин, енамін, основа Манніха, похідне гідроксилметилену, похідне О-(ацилоксіметиленкарбамату), карбамат, ефір, амід або енамін. «Кристалічна форма» стосується різних твердих форм тієї ж самої сполуки, наприклад поліморфів, сольватів та аморфних форм. «Поліморфи» - це кристалічні структури, у яких сполука може кристалізуватися у різних розташуваннях кристалічних носіїв, які всі мають однаковий елементарний склад. Поліморфізм - це феномен, який часто виникає під впливом деяких умов кристалізації, як от температура, рівень перенасичення, присутність домішок, полярність розчинника, ступінь охолодження. Звичайно різні поліморфи мають різні рентгенодифракційні картини, ЯМР спектр твердого стану, інфрачервоний спектр або спектр комбінаціонного розсіювання світла, точки топлення густину, твердість, кристалічну форму, оптичні та електричні властивості, стабільність, та розчинність. Розчинник рекристалізації, рівень кристалізації, температура зберігання, та інші фактори можуть спричинювати домінування однієї кристалічної форми. «Сольвати» - це звичайно кристалічна форма, яка містить або стехіометричну, або нестехіометричну кількість розчинника. Часто, під час процесу кристалізації деякі сполуки мають тенденцію утримувати фіксований молярний коефіцієнт молекул розчинника у твердому кристалічному стані, таким чином утворюючи сольват. Коли сольват - це вода, можуть утворюватися «гідрати». Сполука формули (1) та її фармацевтично прийнятні солі можуть існувати у формі гідрату або сольвату, та такий гідрат та сольват також охоплюється обсягом винаходу. Його приклади містять 1/10 гідрат, ¼ гідрат, ½ гідрат, моногідрат, дихлоргідрат ½ гідрат, дихлоргідрат дигідрат, дихлоргідрат 3/2 гідрат, та подібні. «Аморфні» форми - це некристалічні матеріали з недовгим порядком ряду, та звичайно не дають характерної порошкової рентгенодифракційної картини. Кристалічні форми взагалі описані у Вуrn (1995) та Martin (1995). З метою точнішого опису деякі кількісні показники наводяться з виразом "біля". Незалежно від наявності або відсутності цього "біля" усі наведені кількісні значення є фактичні, а ступінь наближення цієї величини цілком зрозумілий для фахівця з урахуванням експериментальних та/або вимірювальних умов для такої величини. Терміни "селективні" та "селективність" стосується сполук, які виявляють реактивність відносно окремого рецептора (наприклад, рецептор 5-НТ6) без проявлення достатньої перехресної реактивності відносно іншого рецептора (наприклад, інших підтипів рецептора 5НТ). Таким чином, наприклад, селективні сполуки за даним винаходом можуть проявляти реактивність відносно рецепторів 5-НТ6 без проявлення достатньої перехресної реактивності відносно інших рецепторів 5-НТ. У одному з варіантів, сполука за даним винаходом має принаймні біля 10складчасту селективність по відношенню до рецептора 5-НТ6, принаймні біля 50 складчасту селективність по відношенню до рецептора 5-НТ6, принаймні біля 100 складчасту селективність по відношенню до рецептора 5-НТ6, принаймні біля 250 складчасту селективність 6 UA 98122 C2 5 10 15 20 25 30 35 40 45 50 55 60 по відношенню до рецептора 5-НТ6, або принаймні біля 500 складчасту селективність по віднеошенню до бажаної цілі. У даному описі та формулі слово "містять" та варіації цього слова, як от "що містить" та "містить" на виключають інших домішок, компонентів, цілих або етапів. Якщо можливо давати сполуки формули (1) як сирий хімічний препарат, переважним буде вживати термін «фармацевтична композиція». У іще одному аспекті даного винаходу проопонується фармацевтична композиція, яка містить сполуку формули (1), або її фармацевтично прийнятна сіль або сольват, разом з одним або більше їх фармацевтично прийнятним носієм, та вибірково один або більше інших терапевтичних інгредієнтів. Носій(ї) повинні бути «прийнятними» у тому сенсі, зщо вони мають бути сумісними з іншими інгредієнтами композиції та не бути небезпечними особі, яка їх приймає. Використаний у цьому описі термін "композиція" означає продукт, який містить певні інгредієнти у обумовлених кількостях або пропорціях, а також будь-який продукт, що є результатом, прямим або побічним, з‟єднання певних інгредієнтів у певній кількості. По відношенню до фармацевтичних композицій, цей термін означає продукт, який містить один або більше діючих інгредієнтів, та факультативний носій, що містить інертні інгредієнти, а також будь-який продукт, що є результатом, прямим або побічним, з‟єднання, комплексоутворення або агрегації будь-яких двох або більше інгредієнтів, або розкладу одного або більше інгредієнтів, інших типів реакцій або взаємодій одного або більше інгредієнтів. Взагалі, фармацевтичні композиції готують шляхом однорідного та глибокого введення діучого інгредієнта у асоціацію з рідким носієм або добре розділеним твердим носієм або обома ними, та потім, у разі необхідності, формування продукту у бажані композиції. Фармацевтична композиція містить достатньо діючої цільової сполуки для отримання бажаного ефекту у перебігу або стані захворювання. Відповідно, фармацевтичні композиції за даним винаходом означають будь-яку композицію, що вироблена змішуванням сполуки за даним винаходом та її фармацевтично прийнятного носія. "Фармацевтично прийнятний" означає, що носій, розбавник або наповнювач повинен бути сумісним з іншими інгредієнтами композиції та не бути небезпечним для особи, що його приймає. У контексті цієї заявки, термін «комбінований препарат» означає усі правильні з‟єднання, meaning сполука формули (1) та один або більше інших медикаментів фізично поєднаних у одну композицію, як от таблетка або рідина для інєкцій, а також «набор з кількох частин», що містить сполуку формули (1) та один або більше інших медикаментів у формах окремих дозувань, разом з інструкцією по використанню, вибірково з додатковим засобом для полегшення прийому компонентів сполуки, наприклад, етикетка або малюнок. У правильних з‟єднаннях фармакотерапія за визначенням є одночасною. Вміст «набору з кількох частин» може прийматися або одночасно, або у різні інтервали часу. Існуюча терапія, або супутня, або послідовна, буде залежати від особливостей інших застосованих медикаментів, таких особливостей, як як початок та тривалість дії, рівень плазми, очистка, тощо, а також від захворювання, його стадії, та особливостей індивідуального пацієнта. Спорідненість сполуки за винаходом до рецепторів 5-НТ6 визначають як описано вище. Зі звязуючої спорідненості виміряної для даної сполуки формули (1) можна оцінити теоретично нижчу дійову дозу. При концентрації сполуки, еквівалентній двом виміряним величинам Кi, близько 100 % рецепторів 5-НТ6 вірогідно будуть зайняті сполукою. Перетворення цієї концентрації у мг сполуки на гк ваги пацієнта дає теоретично нижчу ефективну дозу, за умови ідеальної біологічної доступності. Фармакокінетика, фармако-динаміка, та інші припущення можуть змінювати фактично застосовану дозу на вище або нижчу величину. Типова добова доза діючих інгредієнтів змінюється в рамках широкого ряду та буде залежати від різних факторів, таких як важливі показання, шлях введення, вік, вага та стать пацієнта, та може бути визначена лікарем. Взагалі, загальна добова доза введення пацієнту у одиничних або індивідуальних дозах, може бути у кількості, наприклад, від 0.001 до 10 мг/кг ваги тіла щоденно, та більш звичайно від 0.01 до 1,000 мг у день, загальної кількості діючих інгредієнтів. Такі дози вводяться пацієнту, який потребує такого лікування, від одного до трьох разів кожен день, або так часто, як необхідно для ефективності, та протягом періоду принаймні два місяці, більш звичайно протягом шести місяців, або постійно. Термін "терапевтично ефективна кількість", як використано тут, стосується кількості терапевтичного засобу для лікування стану, що лікується шляхом введення композиції за винаходом. Цією кількістю є кількість, достатня для проявлення помітного терапевтичного або покращувального відгуку тканевої системи, тваринної або людської. Ефект може включати, наприклад, лікування перелічених тут станів. Точна дійова кількість для пацієнта буде залежати від розміру та здоров»я пацієнта, природи та ступеню 7 UA 98122 C2 5 10 15 20 25 30 35 40 45 виліковуємого стану, рекомендацій лікаря (дослідника, ветеринара, медика або іншого клініциста), та терапії, or або поєднання терапій, обраних для введення. Тому, не є корисним заздалегідь визначати точну ефективну кількість. Термін "фармацевтично прийнятна сіль" відноситься до тих солей, які є, з точки зору здорового медичного глузду придатними для застосування у контакті з тканинами людини та нижчих тварин без надмірної токсичності, подразнення, алергічної реакції, та подібного, та є відповідними при обгрунтованому співвідношенні корсить/ризик. Фармацевтично прийнятні солі добре відомі з рівня техніки. Вони можуть бути одержані in situ при кінцевому виділенні та очищенні сполуки за винаходом, або роздільно шляхом їх реакції з фармацевтично прийнятними нетоксичними основами або кислотами, включаючи неорганічні або органічні основи та неорганічні або органічні кислоти (Вегде, 1977). Форми «вільні основи» можуть бути відновлені шляхом контакту солі з основою або кислотою, та виділенні спорідненої сполуки звичайним шляхом. Споріднені форми сполуки відрізняються від різних форм солей певними фізичними властивостями, такими як розчинність у полярних розчинниках, але з іншого боку солі є еквівалентами споріднених форм сполуки для завдань даного винаходу. «Комплекс» відноситься до комплексу сполуки за винаходом, наприклад, формули (1), сполучених з іоном металу, де принаймні один атом металу є хелатним або ізольованим. Комплекси одержують методами, відомими з рівня техніки (Dwyer, 1964). Термін "лікування", як використано тут, відноситься до будь-якого лікування ссавця, наприклад стану або захворювання людини, та містить: (1) пригнічення захворювання або стану, наприклад, затримку його розвитку, (2) полегшення захворювання або стану, наприклад, призведення стану до регресу, або (3) зупинення симптомів захворювання. Термін «пригнічує» включає в себе його загальноприйняте значення, яке включає перешкодження, попередження, обмеження, полегшення, покращення, та уповільнення, зупинку або повернення прогресування, тяжкості, або результуючих симптомів. По суті, даний спосіб містить і медико-терапевтичне, та/або профілактичне введення, за обставинами. Як використано тут, термін "медична терапія" означає профілактичний, діагностичний та терапевтичний режими, які виконуються in vivo або ex vivo у людини або інших ссавців. Термін «ссавці» включає тварин, що є економічно важливими, як от тварини бичих, овечих, та свинячих порід, в особливості ті, що продукують м‟ясо, а також домашні тварини, спортивні тварини, зоо тварини, та люди, останні є більш переважними. Термін "пацієнт", як використано тут, стосується тварини, переважно ссавця, більш переважно людини, яка є об‟єктом лікування, спостереження або експеримента. Як використано тут, термін "розлади ваги тіла" відноситься до розладів, спричинених диспропорцією між споживанням енергії та витратою енергії, що призводить до ненормальної (наприклад, надмірної) ваги тіла. Такі розлади ваги тіла включають опасистість (Roth, 1994; Sibley, 1993; Sleigh, 1995, 1997). «Опасистість» відноситься до стану, коли людина має Індекс 2 Маси Тіла (ІМТ), який рахується як вага на зріст у квадраті (кг/м ), принаймні 25,9. Звичайно, люди з нормальною вагою мають ІМТ 19.9 і менше ніж 25.9. Опасистість може виникати внаслідок будь-яких причин, генетичних, або довкілля. Прикладами розладів, що можуть призвести до опасистості або бути причиною опасистості, є переїдання та булімія, захворювання полікистозу яєчника, краніофарингіома, синдром Прадера-Віллі, синдром Фроліха, діабет II типу, пацієнти з дефіцитом гормону росту, звичайний варіант короткої статури, синдром Турнерса, та інші паталогічні стани, що виявляють зниження метаболічної активності або зменшення витарти енергії у покої як процентне відношення загальної безжзирової маси, наприклад, діти з гострою лімфобластною лейкемією. СКОРОЧЕННЯ АСЕ-хлорид ACN АсОН ADD ADHD АРІ ВМІ n-BuOH t-BuOH (t)-BOC сно 1-хлоретил хлороформат ацетонітрил оцтова кислота розлади дефіциту уваги розлади дефіциту уваги з гіперактивністю іонізація атмосферного тиску індекс маси тіла n-бутанол t-бутанол (третиггий)-бутоксикарбоніл яєчник китайського хом»яка (клітини) 8 UA 98122 C2 CNS CUR DBU (1,2)-DCE DCM DF DIPEA DMAP DMC DMF DMSO EA EP EtOAc EtOH Et2O FCS FP g h 5-HT KOfBu Mel MeOH mg min ml або mL точка топлення MsCI МТВЕ NaHMDS NEB PA p-TsOH Rf Rt RT SCX TBAB TEA ТЕМ TFA THF 5 10 15 центральна нервова система завіса газу 1,8-диазабщикло[5,4,0]ундец-7-ен (1,2)-дихлоретан дихлорметан дефлектор напруги N,N-диізопропилетиламін 4-диметиламінопіридин хлорид 2-хлор-1,3-диметилімідазоліну ‟ Ν,Ν -диметилформамід диметилсульфоксид етилацетат вхідна напруга етилацетат етанол диетил етер сиворотка бичачих ембріонів фокусуюча напруга грам(и) годин(и) 5-гідрокситриптамін, серотонін калій mpem-бутоксид метил йодид метанол міліграм(и) хвилин(и) мілілітр(и) точка топлення c.q. ряд топлення метансульфоніл хлорид (мезил хлорид) метил трет-бутилетер натрій гексаметилдісилазан газ розпилювача нафтовий ефір (40-60) паратолуолсульфокислота фактор затримки (тонкошарова хроиатографія) час затримки (LC/MS) кімнатна температура сильний катіонообмін тетрабутиламоній бромід триетиламін температура трифтороцтова кислота тетрагідрофуран ПРИКЛАД 1: АНАЛІТИЧНІ МЕТОДИ 1 Спектр ядерного магнітного резонансу ( H ЯМР) визначають у визначеному розчиннику 1 1 використовуючи апарат Bruker ARX 400 ( Н: 400 МГц) або Varian VXR200 ( Н: 200 МГц) при 300 К, якщо не зазначено інше. Спектр визначають у дейтерованому хлороформі або DMSO, одержаному від Cambridge Isotope Laboratories Ltd. Хімічні зсуви наводяться у ч. на млн. (шкала δ), починаючи від тетраметилсилану (1Н). Константи взаємодії J наведені у Гц Максимальні рівні ЯМР спектру показані символами «q» (квартет), «dq» (подвійний квартет), Τ (триплет), dt» (подвійний триплет), «d» (дуплет), «dd» (подвійний дуплет), «ddd» (подвійний подвійний дуплет), «s» (синглет), «bs» (широкий синглет) та «m» (мультиплет). Сигнали NH та ОН визначають після змішування зразка з краплиною D2O. Випарювальна хроматографія здійснюється очищенням з використанням зазначеного елюента та силікагелю (силікагель Merck 60: 0.040-0.063 мм). Точки топлення записують на апараті для визначення точки топлення Buchi B-545. Усі реакції за участю сполуки, чутливої до вологи та/або кисню, виконують у атмосфері безводного азоту. Реакції контролюють з 9 UA 98122 C2 5 використанням тонкошарової хроматографії (TLC) на скляних тарілках з кварцевим покриттям (покритий силікагелем Merck 60 F254) із зазначеним елюентом. Плями визначають УФ світлом (254 нм) або І2. Рідинна хроматографія-масс-спектрометрія (LC-MS): Система для LC-MS складається з 2 мікронасосів Perkin Elmer серії 200. Насоси з‟єднані трійниковим змішувачем на 50 мкл, з‟єднаним з автоматичним пробовідбірником Gilson 215. Спосіб виконують, як вказано далі: етап 0 1 2 3 4 10 15 20 25 30 35 загальний час 0 1.8 2.5 2.7 3.0 витрата мкл/хвил) 2000 2000 2000 2000 2000 А(%) 95 0 0 95 95 В(%) 5 100 100 5 5 А= 100 % води з 0.025 % НСООН та 10ммоль NH4HCOO pH= 3 В= 100 % ACN з 0.025 % НСООН Пробовідбірник має впорскувальний контур на 2 мкл. Він підключений до колонки Waters Atlantis C18 30*4.6 мм з частками 3 мкм. Термостатична пічка Perkin-Elmer серії 200 підтримує у колонці температуру 40 °C. Колонка з‟єднана с УФ-метром Perkin Elmer series 200 УФ проточною кюветою 2.7 мкл. Довжина хвилі встановлена 254 нм. УФ-метр підключений до масспектрометра Sciex API 150EX, який має наступні параметри: Діапазон розгортки: 150-900 од.маси; Полярність: позитивна; Режим розгортки: профільний; Перерозчинення Q1: одноразове; Крок: 0.10 од.маси; Час розгортки: 0.500 с; NEB: 10; CUR: 10 IS: 5200; ТЕМ: 325; DF: 30; FP: 225 та ЕР: 10. До приладу Sciex API 150 підключений детектор розсіювання світла Sedere Sedex 55, який працює при 50° С та тиску 3 бар N2. Усі системи управляються комп»ютером G3 powermac. ПРИКЛАД 2: ЗАГАЛЬНІ АСПЕКТИ СИНТЕЗУ Відповідний синтез заявленої сполуки та проміжних сполук, що містять піразолінові частини, проводиться аналогічно тому, що був заявлений у WO 01/70700, з використанням компоновочних блоків 4,5-дигідро-1Н-піразолу або 4,5-дигідро-3Н-піразолу, які є доступні на ринку або можуть бути одержані як описано нижче. У схемі 1 використовують сульфоніл карбамати загальної формули (І), які, наприклад, можуть бути одержані реакцією сульфоніламідів з метилхлороформатом або ди-mpem-бутил бікарбонатом у присутності основи. Продукти їх реакції з піразолінами загальної формули (Іі) можуть потім бути перетворені у проміжні сполуки хлоріміну загальної формули (III) з використанням галогенуючих засобів, як от РСІ3, РОСІ3/DМАР або 2-хлор-1,3-диметилімідазолін хлорид (DMC), з подальшою реакцією з амінами, одержуючи похідні сульфонілпіразолін карбоксамідину загальної формули (IV). 10 UA 98122 C2 5 У схемі 2 використовують структури N-(біс-алкілсульфаніл-метилен)-сульфонаміду загальної формули (V), які можуть бути одержані з сульфоніламідів реакцією з CS2 у присутності КОН, з подальшою реакцією з галідом алкілу, як от метил йодид. Дві S-алкіл функціональності можуть потім бути заміщенні амінами, переважно починаючи з компоновочних блоків піразоліну, одержуючи структури загальної формули (VI), і закінчуючи похідними сульфонілпіразолін карбоксамідину загальної формули (IV). 10 15 20 25 У схемі 3 використовують фрагменти алюл-ізотіосечовини або відповідні форми їх солей загальної формули (IX), які легко одержують реакцією компоновочних блоків тіосечовини with галідами алкілу, як от метил йодид, які можуть реагувати з піразолінами у присутності основи, одержуючи похідні піразолін карбоксамідину загальної формули (X). Останні можуть реагувати з галідами сульфонілу (Х=Вr, СІ, F, переважно СІ) у присутності основи одержуючи похідні сульфонілпіразолін карбоксамідину загальної формули (IV). Вибір специфічної процедури синтезу залежить від факторів, відомих фахівцям, як от сумісність функціональних груп із застосованим реагентами, можливість використання захисних група, каталізаторів, активуючих та зв»язуючих реагентів та первинних структурних характеристик, що присутні у кінцевій сполуці. Фармацевтично прийнятні солі можуть бути одержані з використанням стандартних процедур, добре відомих з рівня техніки, наприклад змішуванням сполуки за даним винаходом з відповідною кислотою, наприклад, неорганічною або органічною. ПРИКЛАД 3: СИНТЕЗ ПРОМПКНИХ СПОЛУК ПІРАЗОЛІНУ 11 UA 98122 C2 5 10 15 20 25 30 35 40 3-Етил-4,5-дигідро-1Н-піразол Гідрат гідразину (24.55 мл) розчиняють у МеОН (50 мл) та охолоджують на кризі. До цього розчину, додають етил вініл кетон (50 мл) при таких умовах, що температура утримується нижче 10 °C. Крижану баню видаляють та суміш перемішують протягом 2 год. при кімнатній температурі, після чого МеОН випарюють під зниженим тиском. Продукт одержують 1 дистиляцією у вакуумі (70 °C, 20 мбар), з виходом 7.22 г безбарвної рідини. Н ЯМР (400 МГц, CDCI3) δ 1.15 (t, J=8 Гц, ЗН), 2.34 (q, J=8 Гц, 2H), 2 59 (t, J=10 Гц, 2Н), 3.10 (brs, 1Н), 3.34 (t, J=10 Гц, 2Н). 3-Метил-4,5-дигідро-1Н-піразол Гідрат гідразину (29.2 мл) розчиняють у МеОН (50 мл). До цього розчину, додають метил вініл кетон (50 мл) при таких умовах, що температура утримується нижче 50 °C. Суміш перемішують протягом 2 год. при 50 °C, після чого МеОН випарюють під зниженим тиском. Продукт одержують дистиляцією у вакуумі (68-82 °C, 20 мбар), з виходом 11.8г безбарвної 1 рідини. Н ЯМР (400 МГц, DMSO-d6) δ 1.88 (s, 3Н), 2.47 (t, J=10 Гц, 2Н), 3.15 (t, J=10 Гц, 2H): 6.10 (br s, 1H). 4-Етил-4,5-дигідро-1Н-піразол Гідрат гідразину (58 мл) розчиняють у МеОН (300 мл) та охолоджують на кризі. До цієї суміші, додають розчин 2-етилакролеїну (100 г) у МеОН (100 мл) при таких умовах, що температура утримується нижче 10 °C. Крижану баню видаляють та суміш перемішують усю ніч при кімнатній температурі, після чого МеОН випарюють під зниженим тиском. Продукт 1 одержують дистиляцією у вакуумі (70-80 °C, 20 мбар), з виходом 54.9 г безбарвної рідини. Н ЯМР (400 МГц, CDCl3) δ 0.98 (t, J=8 Гц, 3Н), 1.42-1.70 (m, 2H), 2.89-3.02 (m, 2H), 3.43-3.54 (m, 1H), 6.78 (brs, 1H), NH невидимий.4-Метил-4,5-дигідро-1Н-піразол Гідрат гідразину (16.65 мл) розчиняють у CH3CN (50 мл) та охолоджують на кризі. До цієї суміші, додають розчин 2-метилакролеїну (24.02 г) у CH3CN (50 мл). Крижану баню видаляють та суміш перемішують усю ніч при кімнатній температурі, після чого CH3CN випарюють під зниженим тиском. Продукт одержують дистиляцією у вакуумі (102-108 °C, 250 мбар), з виходом 1 7.0 г безбарвної рідини. Н ЯМР (400 МГц, CDCI3) δ 1.18 (d, J=7 Гц, 3Н), 2.90 (t, J=9 Гц, 1H), 3.003.12 (m, 1H), 3.51 (t, J=9 Гц, 1H), 5.48 (br s, 1H), 6.73 (br s, 1H). 12 UA 98122 C2 5 10 15 20 25 30 5-Етил-4,5-дигідро-1Н-піразол Гідрат гідразину (12.1 мл) розчиняють у МеОН (50 мл) та охолоджують на кризі. До цієї суміші, додають розчин 2-пентеналу (24.4 мл) у МеОН (50 мл) при таких умовах, що температура утримується нижче 10 °C Крижану баню видаляють та суміш перемішують протягом 2 5 год. при кімнатній температурі, з подальшим випарюванням під зниженим тиском. Продукт одержують дистиляцією у вакуумі (68-72 °C, 25 мбар), з виходом 8.25 г безбарвної 1 рідини. Н ЯМР (400 МГц, CDCI3) δ 0.92 (t, J=7.5 Гц, 3Н), 1.42-1.61 (m, 2H), 2.36 (ddd, J=17, 8 та 2 Гц, 1H), 2.76 (ddd, J=17,10 та 2 Гц, 1Н), 3.51-3.62 (m, 1H), 5.35 (br s, 1H), 6.76 (brs, 1H). 4,4-Диметил-4,5-дигідро-3Н-піразол 2,2-Диметил-1,3-пропандиамін (20.0г) розчиняють у Н2О (80 мл) та МеОН (20 мл) та охолоджують на кризі. Одночасно, Н2О2 (30 %, 120мл) та NaCIO (10 %, 350мл) додають по краплинах. Реакційну суміш перемішують усю ніч при кімнатній температурі, екстрагують з DCM, органічний шар висушують над Na2SO4 та розчинник випарюють під зниженим тиском. Вакуумна 1 дистиляція (102-105 °C, 250 мбар), вихід 11.4 г безбарвної аморфної масляної сполуки. Н ЯМР (200 МГц, CDCI3) δ 1.05 (s, 6H), 4.13 (s, 4H). Альтернативно, ця сполука може бути синтезована наступним шляхом: 4,4-Диметил-4,5-дигідро-3Н-піразол 2,2-Диметил-1,3-пропандиамін (8.97 г) розчиняють у Н2О (45 мл) та охолоджують на кризі Одночасно, Н2О2 (30 %, 54 мл) та NaCIO (10 %, 157 мл) додають по краплинах, утримуючи температуру нижче 25 °C. Потім, реакційну суміш перемішують 1 год. при кімнатній температурі, та екстрагують з DCM (2 45 мл) Поєднані органічні шари екстрагують з водним сульфітом натрію (20 %, 25 мл), промивають водою (2 25 мл) сушать над Na2SO4, та випарюють під зниженим тиском (>200 мбар at 50 °C) одержуючи 8.89 г безбарвної рідини (що містить деякий 1 залишок DCM). Н ЯМР (200 МГц, CDCI3) δ 1.05 (s, 6H), 4.13 (s, 4H). 35 40 2,2-Диетил-малононітрил Малононітрил (15.2 г) перемішують з ТВАВ (3.0 г, 4 mol%) та етил йодидом (36.8 мл, 2 еквів.). Після перемішування протягом 30 хвилин при кімнатній температурі, суміш охолоджують на кризі, KOtBu (51.6 г, 2 еквів.) додають порціями, крижану баню видаляють, та суміш перемішують протягом 30 хвилин при кімнатній температурі. Екстракція з DCM/H2O, сушка над Na2SO4 та випарювання під зниженим тиском дають 40 грамів сирого матеріалу, який очищують випарювальною хроматографією елююванням з DCM. Це дає на виході 20 4 грамів 1 помаранчевої олії, яка з часом затвердіває. Н ЯМР (400 МГц, CDCI3) δ 1,29 (t, J=7.5 Гц, 6H), 2.00 (q, J=7.5 Гц, 4Н). 13 UA 98122 C2 5 10 15 2,2-Диетил-пропан-1,3-диамін Суспензію LiAlH4 (4.66 г) у сухому Et2O (100 мл) охолоджують на кризі, та розчин 2,2-диетилмалононітрилу (5.0 г) у Et2O (50 мл) додають по краплинах при таких умовах, що температура утримується нижче 20 °C. Суміш перемішують усю ніч при кімнатній температурі, охолоджують на кризі, та гасять додаванням Н2О (5 мл), 2М водного NaOH (10 мл) та знову Н2О (5 мл). Суспензію фільтрують, фільтрат промивають з Et2O, та поєднані фільтрати випарюють до 1 сухого стану під зниженим тиском одержуючи 5.0 г чистої, жовтавої рідини. Н ЯМР (400 МГц, CDCI3) δ 0.80 (t, J=8 Гц, 6H), 1.08 (br s, 4H), 1.22 (q, J=8 Гц, 4H), 2.52 (s, 4H). 4.4-Диетил-4,5-дигідро-3Н-піразол 2,2-Диетил-пропан-1,3-диамін (5.0 г) вводять до суміші Н2О (40 мл) та МеОН (10 мл), та охолоджують на кризі. Одночасно, Н2О2 (24.2 мл 30 % розчин, 6 еквів.) та NaCIO (54.9 мл 10 % розчин, 2.4 еквів.) додають по краплинах, крижану баню видаляють, та суміш перемішують 2 год. при кімнатній температурі. Екстракція з DCM, сушать над Na2SO4 та випарювання під зниженим тиском дають на виході 3.51 г чистої жовтої рідини, яка містить 77 % бажаного продукту та 23 % вихідного матеріалу диаміну. Цей матеріал використовують на наступних 1 етапах без подальшого очищення. Н ЯМР (400 МГц, CDCI3) δ 0.78 (t, J=7.5 Гц, 6H), 1.36 (q, J=7.5 Гц, 4H), 4.14 (s, 4H). 20 25 30 35 40 45 50 Циклопентан 1,1-дикарбонітрил Малононітрил (15.0 г) розчиняють у сухому DMF (200 мл) та охолоджують на кризі. Потім, DBU (75 мл, 2.2. еквів.) та 1,4-дибромбутан (29.6 мл, 1.1 еквів.) додають по краплинах. Крижану баню видаляють, додатково додають 100 мл сухого DMF, та суміш перемішують при 80 °C 2 год. Після охолодження до температури довкілля, додають DCM та суміш промивають 5 разів з 5 % водним NaHCO3. Органічну фазу сушать над Na2SO4 та випарюють під зниженим тиском одержуючи 40 г чорної маслянистої речовини. Її очищують випарювальною хроматографією 1 елююванням з РА:ЕА 9:1 (Rf = 0.35, візуалізуючи з І2) одержуючи 23.4 г безбарвної рідини. Н ЯМР (400 МГц, CDCI3) δ 1.94-2.03 (m, 4Н), 2.41 (t, J=7 ГЦ, 4H). С-(1-Амінометил-циклопентил)-метиламін Суспензію LiAIH4 (4.74 г) у сухому Et2O (100 мл) охолоджують на кризі, та розчин циклопентан-1,1-дикарбонітрилу (5.0 г) у Et2O (50 мл) додають по краплинах при таких умовах, що температура утримується нижче 20 °C. Суміш перемішують усю ніч при кімнатній температурі, охолоджують на кризі, та гасять додаванням Н2О (5 мл), 2М водний NaOH (10 мл) та знову Н2О (5 мл). Суспензію фільтрують, фільтрат промивають з Et2O, та поєднані фільтрати 1 випарюють до сухого стану під зниженим тиском одержуючи 4.95 г чистої, безбарвної рідини. Н ЯМР (400 МГц, CDCI3) δ 1.24 (br s, 4H), 1.22-1.40 (m, 4H), 1.55-1.64 (m, 4H), 2.62 (s, 4H). 2,3-Диаза-спіро[4.4]нон-2-ен С-(1-Амінометил-циклопентил)-метиламін (4.87 г) вводять до суміші Н2О (40 мл) та МеОН (10 мл), та охолоджують на кризі. Одночасно, Н 2О2 (23.9 мл 30 % розчин, 6 еквів.) та NaCIO (54.3 мл 10 % розчин, 2.4 еквів.) додають по краплинах, крижану баню видаляють, та суміш перемішують 2 год. при кімнатній температурі. Екстракція з DCM, сушка над Na2SO4 та випарювання під зниженим тиском дають на виході 3.74 г чистої, жовтавої рідини що містить 90 % бажаного продукту та 10 % вихідного матеріалу диаміну. Цей матеріал використовують на 1 наступних етапах без подальшого очищення. Н ЯМР (400 МГц, CDCI3) δ 1.48-1.57 (m, 4H), 1.621.69 (m, 4H), 4.26 (s, 4H). Циклогексан-1,1 -дикарбонітрил 14 UA 98122 C2 5 10 15 20 Малононітрил (15.0 г) розчиняють у сухому DMF (200мл). Потім, DBU (75 мл) та 1,5дибромпентан (34 мл) додають при 0 °C (крижана баня). Крижану баню видаляють та реакційну суміш перемішують 2h при 80 °C. Після охолодження, реакційну суміш наливають у DCM. Органічний шар промивають декілька разів з 5 % NaHCO3, органічний шар висушують над Na2SO4 та розчинник випарюють під зниженим тиском. Сирий продукт очищують випарювальною хроматографією елююванням з РА:ЕtOАс (9:1) одержуючи 25.7д білих 1 кристалів. Н ЯМР (400 МГц, CDCI3) δ 1.48-1.61 (m, 2H), 1.68-1.84 (m, 4H), 2.13 (t, J = 6Гц, 4Н). С-(1-Амінометил-циклогексил)-метиламін Циклогексан-1,1-дикарбонітрил (20.0 г) додають у сухий Et2O (70 мл). Цю суміш додають по краплинах до суспензії UAIH4 (17.0 г) у сухому Et2O (250 мл) охолоджують на кризі. Суміш перемішують усю ніч при кімнатній температурі, охолоджують на кризі, та гасять додаванням Н2О (17.0 мл), 2М водний NaOH (34,0 мл) та знову Н2О (17 мл). Суспензію фільтрують, фільтрат промивають з Et2O, та поєднані фільтрати випарюють до сухого стану з 1 виходом 20.8 г чистої, безбарвної рідини. Н ЯМР (400 МГц, CDCI3) δ 1.05-1.55 (m, 14Н), 2.61 (s, 4H). 2,3-Диаза-спіро[4.5]дец-2-ен С-(1-Амінометил-циклогексил)-метиламін (10.0 г) вводять до суміші Н2О (40 мл) та МеОН (10 мл), та охолоджують на кризі. Одночасно, Н2О2 (44.3 мл 30 % розчин, 6 еквів.) та NaCIO (125.5 мл 10 % розчин, 2.4 еквів.) додають по краплинах, крижану баню видаляють, та суміш перемішують протягом 45 хвил. при кімнатній температурі. Екстракція з DCM, сушка над Na2SO4 1 та випарювання під зниженим тиском, вихід 8.7 г чистої, жовтавої рідини.. Н ЯМР (400 МГц, CDCI3) δ 1.24-1.53 (m, 10Н), 4,17 (s, 4H). 25 30 35 40 45 Етил ефір 2-(2-Метил-[1,3]диоксолан-2-іл)-масляної кислоти Метил-2-етилацетоацетат (100 мл) вміщують у толуол (250 мл). Етилен гліколь (46.9 мл, 1.35 еквів.) та каталітичну кількість p-TsOHH2O додають, та суміш нагрівають зі зворотнім холодильником усю ніч за допомогою апарату Діна-Старка. Після охолодження до температури довкілля, суміш промивають з 5 % водним NaHCO3 та насиченим водним NaCI, органічну фазу сушать над Na2SO4 та випарюють під зниженим тиском. Осад очищують повтроною вакуумною 1 дистиляцією (118-128 °C, 15 мбар), з виходом 85.5 г продукту. Н ЯМР (400 МГц, CDCI3) δ 0.90 (t, J=7 Гц, 3Н), 1.28 (t, J=7 Гц, 3Н), 1.40 (s, 3Н), 1.59-183 (m, 2H), 2,56 (dd, J=11,5 та 4 Гц; 1Н), 3.90-4.06 (m, 4H), 4.18 (m, 2H). 2-(2-Метил-[1,3]диоксолан-2-іл)-бутан-1-ол Етил ефір 2-(2-Метил-[1,3]диоксолан-2-іл)-масляної кислоти (85.5 г) додають у сухий Et2O (50 мл). Цю суміш додають по краплинах до суспензії LiAIH4 (16.1 г) у сухому Et2O (200 мл), охолоджують на кризі. Суміш нагрівають зі зворотнім холодильником 4 год., охолоджують на кризі, та гасять додаванням Н2О (16.1 мл), 2М водний NaOH (32.2 мл) та знову Н2О (16,1 мл). Суспензію фільтрують., фільтрат промивають з Et2O. та поєднані фільтрати випарюють до сухого стану. Осад (49 г) очищують дистиляцією у вакуумі (112-125 °C, 15 мбар), з виходом 43.5 1 г чистої, безбарвної рідини. Н ЯМР (400 МГц, CDCI3) δ 0.98 (t, J=7.5 Гц5 3Н), 1.10-1.24 (m, 1H), 1.31 (s, 3Н), 1.50-1.75 (m, 2H), 3.12, (br s, 1H), 3.59-3.76 (m, 2H), 3.94-4.02 (m, 4H). З-Гідроксиметил-пентан-2-он 2-(2-Метил-[1,3]диоксолан-2-іл)-бутан-1-ол (43.5 г) вводять до суміші Н2О (100 мл) та ЕtOН (10 мл), та додають концентрований водний НСI (1 мл). Суміш нагрівають зі зворотнім холодильником 2 год., охолоджують до температури довкілля, нейтралізують 2М водним NaOH, насиченим with сульфат амонію та екстрагують двічі з Et2O. Поєднані органічні шари сушать над 15 UA 98122 C2 5 10 15 Na2SO4 та випарюють до сухого стану, жовтавий осад (25.7 г) очищують дистиляцією у вакуумі 1 одержуючи 20.7 г чистої, безбарвної олії. Н ЯМР (400 МГц, CDCI3) δ 0.95 (t, J=7.5 Гц, 3Н), 1.491.76 (m, 2H), 2.21 (s, 3Н), 2.64 (m, 1 Η), 3.68-3.84 (m, 3Н). Оцтова кислота 2-етил-З-оксо-бутил ester З-Гідроксиметил-пентан-2-он (20.7 г) розчиняють у СНСІ3 (150 мл) та охолоджують на кризі. Додають оцтовий ангідрид (80 мл), потім DMAP (2.18 г), та суміш перемішують усю ніч при кімнатній температурі. Після охолодження на крижаній бані, МеОН (120 мл) додають по краплинах, та суміш наливають у насичений водний розчин NaHCO3. Після екстракції з DCM двічі, поєднані органічні фази сушать над Na2SO4 та випарюють під зниженим тиском 1 одержуючи 28.0 г жовтавої рідини. Н ЯМР (400 МГц, CDCI3) δ 0.93 (t, J=8 Гц, 3Н), 1.46-1.75 (m, 2H), 2.03 (s, 3Н), 2.20 (s, 3Н), 2.77 (quint., J=6.5 Гц, 1Н), 4.20(d, J=7 Гц, 3Н). 4-Етил-3-метил-4,5-дигідро-1Н-піразол 2-етил-3-оксо-бутил ефір оцтової кислоти (23.0 г) додають у сухий THF (75 мл) та додають DBU (23.9 мл). Суміш перемішують при кімнатній температурі 15 хвил. з утворенням проміжний 3-метилен-пентан-2-он. Додають МеОН (75 мл), потім по краплинах додають гідрат гідразину (7.75 мл). Одержану суміш перемішують усю ніч при кімнатній температурі та випарюють під зниженим тиском. Осад очищують дистиляцією у вакуумі (94-106 °C, 15 мбар), з виходом 7.9 г 1 чистої, безбарвної рідини. Н ЯМР (400 МГц, CDCI3) δ 0.95 (t, J=7.5 Гц, 3Н), 1.33-1.83 (m, 2H), 1.92 (s, 3Н), 2.78 (m, 1H), 3.01 (t, J=9.5 Гц, 1Н), 3.51 (t, J=9.5 Гц, 1H). 20 25 30 35 2-Диметиламінометил-циклогексанон До циклогексанону (259 мл) додають формальдегід (37.2 мл 37 % водний розчин) та диметиламін гідрохлорид (40.8 г). Перемішану суміш повільно нагрівають та нагрівають зі зворотнім холодильником 1 год. Після охолодження до температури довкілля додають Н 2О, та суміш екстрагують двічі з Et2O. Водний шар перетворюють на основний додаванням 50 % водного NaOH (27.5 мл), та потім екстрагують двічі з DCM. Поєднані органічні фази сушать над 1 Na2SO4 та випарюють під зниженим тиском одержуючи 66.6 г жовтавої рідини. Н ЯМР (400 МГц, CDCI3) δ 1.34-1.47 (m, 1H), 1.60-1.78 (m, 2H), 1.81-1.92 (m, 1H), 1.98-2.09 (m, 1H), 2.16-2.55 (m, 5H), 2.21 (s, 6H), 2.69 (dd, J=13 та 6 Гц, 1Н). 3.3а4б.6,7-Гексагідро-2Н-індазол Гідрат гідразину (28.0 мл) розчиняють у n-BuOH (200 мл) та охолоджують на кризі. Розчин 2диметиламінометил-циклогексанону (64.0 г) у n-BuOH (50 мл) додають по краплинах, суміш повільно нагрівають та нагрівають зі зворотнім холодильником 20 годин. Het-розчинник випарюють під зниженим тиском. Осад очищують дистиляцією у вакуумі (64-67 °C, 28 Ра), з виходом 24.2 г чистої, безбарвної рідини. Цей матеріал використовують на наступних етапах без подальшого очищення. 40 45 4-Етил-5-метил-4,5-дигідро-1Н-піразол Гідрат гідразину (12.4 мл) розчиняють у МеОН (100 мл) та охолоджують на кризі. До цієї суміші додають розчин 2-етил-буг-2-еналу (25 г) у МеОН (50 мл) при таких умовах, що температура утримується нижче 10 °C. Крижану баню видаляють та суміш перемішують при кімнатній температурі 2 дні. Розчинник випарюють під зниженим тиском. Вакуумна дистиляція (90-100 °C, 20 мбар) вихід 16.9 г жовтавої рідини, що містить бажаний продукт як суміш діастереомерів та гідразону у співвідношенні приблизно 1:2. Цей матеріал використовують на наступних етапах без подальшого очищення. 50 16 UA 98122 C2 5 10 15 20 25 30 35 40 5-Етил-4-метил-4,5-дигідро-1Н-піразол У атмосфері N2 гідрат гідразину (63.9 мл, 10 eq) розчиняють у МеОН (100 мл) та охолоджують на кризі. До цієї суміші додають розчин 2-метил-пент-2-енал (15,0 мл) у МеОН (50 мл) при таких умовах, що температура утримується нижче 10 °C. Крижану баню видаляють та суміш перемішують при кімнатній температурі усю ніч. Розчинник випарюють під зниженим тиском. Вакуумна дистиляція (40-45 °C, 15 мбар) вихід 9.5 г жовтавої рідини, що містить бажаний продукт як суміш діастереомерів та гідразону у співвідношенні приблизно 1:1. Цей матеріал використовують на наступних етапах без подальшого очищення. 4-Гідрокси-3,3-диметил-бутан-2-он До 25 мл 3-метил-бутан-2-ону додають 7.01 г параформальдегід та 36.0 мл трифтороцтової кислоти. Суміш нагрівають зі зворотнім холодильником 7 годин. Після охолодження додають 300 мл Н2О та 100 г (5 eq) NaHCO3. Суспензію фільтрують та органічний шар відділяють. Осад на фільтрі промивають двічі DCM, поєднані фільтрати сушать над Na2SO4 та розчинник 1 випарюють під зниженим тиском одержуючи 23.7 г помаранчевої рідини. Н ЯМР (400 МГц, CDCI3) δ 1.17 (s, 6H), 2.17 (s, 3Н), 2.38 (t, J=7 Гц, 1H), 3.65 (d, J = 7Гц, 2Н). 2,2-диметил-3-оксо-бутил ефір метансульфонової кислоти 23.7 г 4-Пдрокси-3,3-диметил-бутан-2-он розчиняють у 150 мл DCM. Додають 49.5 мл (3 eq) піридину та 17.5 мл (1.1 eq) мезилхлориду та суміш перемішують при кімнатній температурі 20 годин. Суспензію фільтрують та осад на фільтрі промивають двічі з DCM. Фільтрат промивають з 1 Μ НСІ та водний шар екстрагують двічі з DCM. Поєднані фільтрати сушать над Na2SO4 та розчинник випарюють під зниженим тиском 1 одержуючи 41.2 г коричневої рідини. Н ЯМР (400 МГц, CDCI3) δ 1.24 (s, 6H), 2.20 (s, 3Н), 3.03 (s, 3Н), 4.21 (s, 2H). 3,4,4-Триметил-4,5-дигідро-1Н-піразол 39.2 г 2,2-диметил-3-оксо-бутил ефіру метансульфонової кислоти розчиняють у 200 мл МеОН та охолоджують на кризі. 21.6 мл (2.2 eq) гідрату гідразину додають по краплинах та реакційну суміш перемішують при кімнатній температурі 1 годину. Реакційну суміш концентрують, додають 5 % NaHCO3 та екстрагують 3 рази з DCM. Поєднані органічні шари сушать над Na2SO4 та розчинник випарюють під зниженим тиском одержуючи 19.5 г помаранчевої рідини. Вакуумна дистиляція 10 г цієї рідини, вихід 6.4 г жовтавої рідини (76-78 °C, 1 20 мбар). Н ЯМР (400 МГц, CDCI3) δ 1.14 (s, 6H), 1.86 (s, 3Н), 3.14 (s, 2H), 4.00 (br s, 1H). 3-Диметиламіно-1-феніл-пропан-1-он гідрохлорид До розчину 0.5 мл концентрованого водного НСІ у 40 мл ЕЮН, додають ацетофенон (30.0 г), параформальдегід (10 0 г) та диметиламін гідрохлорид (26.5 г) та суміш нагрівають зі зворотнім холодильником 3 години. Суміш охолоджують до кімнатної температури, та осад фільтрують, промивають з ацетоном та сушать у вакуумі одержуючи 37.2 г білого кристалічного матеріалу. 17 UA 98122 C2 1 5 10 15 20 25 Н ЯМР (200 МГц, DMSO-d6) δ 2.84 (s, 6H), 3.38-3.55 (m, 2H), 3.57-3.74 (m, 2H), 7.48-7.73 (m, 3Н), 7.97-8.10 (m, 2H). 3-Феніл-4,5-дигідро-1Н-піразол У атмосфері N2, З-диметиламіно-1-феніл-пропан-1-он гідрохлорид (37.2 г) розчиняють у теплому МеОН (75 мл), та повільно додають до розчину гідрату гідразину (23 мл) та 50 % водний NaOH (12 мл) у МеОН (30 мл) перемішують при 50 °C. Суміш нагрівають зі зворотнім холодильником 2 години та випарюють під зниженим тиском. Крижану воду додають до осаду та після перемішування протягом 5 хвилин відфільтровують утворений твердий продукт. Осад вміщують у Et2O, сушать над Na2SO4, та випарюють до сухого стану під зниженим тиском одержуючи 19.7 г жовтої олії 80 % очистки, який використовують на подальших етапах без подальшого очищення. 1-(4-Хлор-феніл)-3-диметиламіно-пропан-1 -он гідрохлорид До ЕtOН (80 мл), додають р-хлорацетофенон (77.3 г, 0.50 моль), диметиламін гідрохлорид (52.7 г, 0.65 моль), параформальдегід (19.8 г, 0.66 моль) та концентрований водний НСІ (1 мл) та суміш нагрівають зі зворотнім холодильником 5 год. Суміш охолоджують до 40 °C, додають ацетон (400 мл), та при перемішуванні суміш охолоджують далі до 20 °C. Осад фільтрують, промивають з ацетоном та РА, та сушать на повітрі, одержуючи 69.5 г продукту, який використовують без подальшого очищення на наступному етапі. 3-(4-Хлор-феніл)-4,5-дигідро-1Н-піразол У атмосфері N2, 1-(4-хлор-феніл)-3-диметиламіно-пропан-1-он гідрохлорид (37.2 г) розчиняють у теплому МеОН (75 мл), та повільно додають до розчину гідрату гідразину (23 мл) та 50 % водного NaOH (12 мл) у МеОН (30 мл) перемішують при 50 °C. Суміш нагрівають зі зворотнім холодильником 2 години, та випарюють під зниженим тиском. Вода додають до осаду, супроводжуючи екстракцією з DCM. Органічну фазу промивають двічі з водою, сушать та випарюють під зниженим тиском, одержуючи 25.0 г жовтого твердого продукту, точка топлення 90-100 °C. 30 35 40 4-Феніл-4,5-дигідро-1Н-піразол У атмосфері N2, диметиламін гідрохлорид (7.27г) та формалін (37 %) (6.63мл) додають до феніл ацетальдегіду (10 мл) та перемішують усю ніч при кімнатній температурі. Реакційну суміш екстрагують один раз з диетил етером, органічний шар сушать над MgSO4 та розчин що містить проміжний 2-феніл-пропенал вміщують у МеОН. Додають гідрат гідразину (7.87 мл), та реакційну суміш перемішують 2 години при 50 °C (Et2O випарений). Суміш концентрують під зниженим тиском. Осад розчиняють у DCM та сушать над MgSO4, з подальшим випарюванням під зниженим тиском, з виходом 3.12 г жовтої олії яку використовують на наступному етапі без подальшого очищення. 18 UA 98122 C2 5 10 15 3-Феніл-бут-3-еn-2-он 1-Феніл-пропан-2-он (40.8 г) розчиняють у 200 мл МеОН. Формалін (37 %) (79 мл), піперидин (4 мл) та НОАс (4 мл) додають та реакційну суміш перемішують Зп при 60 °C. Реакційну суміш випарюють до сухого стану під зниженим тиском. Осад вміщують у диетил етер, та екстрагують з водою. Органічний шар промивають з 1М НСІ, сушать над MgSO4 та випарюють під зниженим 1 тиском до виходу 36.3 г жовтої рідини. Н ЯМР (400 МГц, CDCl3) δ 2.41 (s, 3Н), 5.87 (s, 1H), 6.18 (s, 1H), 7.24-7.40 (m, 5H). 3-Метил-4-феніл-4,5-дигідро-1Н-піразол Гідрат гідразину (12.06 мл) додають до З-Феніл-бут-3-ен-2-ону (36.3 г) у МеОН (200 мл). Реакційну суміш перемішують усю ніч при температурі рефлюксу. Розчинник випарюють під зниженим тиском. Осад вміщують у диетил етер та промивають водою. Органічну фазу сушать над Na2SO4 та випарюють під зниженим тиском. Сирий матеріал очищують випарювальною колонковою хроматографією елююванням з DCM:MeOH=98:2 одержуючи 19.7 г помаранчевої олії, що містить 65 % бажаного продукту, яку використовують на наступних етапах без подальшого очищення. 20 25 5-Феніл-4,5-дигідро-1Н-піразол У атмосфері N2, гідрат гідразину (9.2 мл) додають до розчину циннамальдегіду (10.0 г) у tBuOH (20 мл). Суміш нагрівають зі зворотнім холодильником усю ніч, з подальшою концентрацією під зниженим тиском. Воду додають до осаду, та водну фазу екстрагують двічі з DCM. Поєднані органічні шари промивають водою, сушать над Na2SO4 та концентрують під зниженим тиском. Це дає 10.46 г жовтої олії що містить 85 % бажаного продукту, який 1 використовують на наступних етапах без подальшого очищення. Н ЯМР (200 МГц, CDCl3) δ 2.61-2.80 (m, 1H), 3.04-3.23 (m, 1H), 4.72 (dd, J=8 та 10 Гц, 1Н), 5.60-6.10 (br s, 1H), 6.77-6.87 (m, 1H), 7.18-7.47 (m, 5H). 30 35 40 5-Фуран-2-їл-4,5-дигідро-1Н-піразол У атмосфері N2, гідрат гідразину (4.0 мл) додають до розчину 3-(2-фурил)акролеїн (5.0 г) у fBuOH (25 мл). Суміш нагрівають зі зворотнім холодильником 2 дні, з подальшим випарюванням під зниженим тиском. Осад вміщують у DCM та екстрагують двічі з 5 % водним NaHCO3. Органічну фазу сушать над Na2SO4 та випарюють під зниженим тиском. Це дає 5.3 г жовтої олії, що містить 45 % бажаного продукту та 55 % проміжного гідразону що не дає пройти реакції закриття кільця. Додаткове нагрівання зі зворотнім холодильником 24 год. у n-BuOH дає (після завершення) 5.6 г коричневої олії, що містить 58 % бажаного продукту та 42 % гідразону. Цей матеріал використовують на наступних етапах без подальшого очищення. Характеристика 1 сигналів піразоліну у Н ЯМР (400 МГц, СОСІ3): δ 2.87-3.08 (m, 2Н), 4.72-4.81 (m, 1Η), 6.87 (br s, 1Η). 19 UA 98122 C2 5 10 15 20 25 30 3-(3,4-Дигідро-2Н-піразол-3-іл)-піридине У атмосфері N2, гідрат гідразину (3.65 мл. 2 еквів.) додають до розчину 3-(3піридил)акролеїну (5.0 г) у t-BuOH (25 мл). Суміш нагрівають зі зворотнім холодильником 3 дні, з подальшим випарюванням під зниженим тиском. Осад вміщують у DCM та промивають з 5 % водним NaHCO3. Органічну фазу сушать над Na2SO4 та випарюють під зниженим тиском. Це дає 5.0 г червоної олії, що містить 74 % бажаного продукту та 26 % проміжного гідразону, що не дає пройти реакції закриття кільця. Цей матеріал використовують на наступних етапах без 1 подальшого очищення. Характеристика сигналів піразоліну у Н ЯМР (400 МГц, CDCI3): δ 2.632.75 (m, 1H), 3.13-3.25 (m, 1H), 4.72-4.82 (m, 1H), 6.85 (brs, 1H). 3-Фуран-3-іл-пропенал 6.08 г (трифенілфосфораніліден)ацетальдегід суспендують у 10 мл сухого DMF. Додають 1.67 мл (1 еквів.) 3-фуральдегіду та суміш перемішують усю ніч при 80 °C. Суміш вміщують у ЕА та промивають 4 рази з 5 % водним NaHCO3, органічну фазу сушать над Na2SO4, фільтрують та концентрують у вакуумі. Осад суспендують у РА, фільтрують та концентрують у вакуумі до виходу 1.47 г світло-коричневої олії, що містить 68 % бажаного продукту. Цей матеріал 1 використовують на наступних етапах без подальшого очищення. Характерні сигнали у Н ЯМР (400 МГц, CDCI3): δ 6.45 (dd, J=8 та 16 Гц, 1Н), 9.63 (d, J=8 Гц, 1Н). 5-Фуран-3-іл-4,5-дигідро-1Н-піразол 5.84 мл (10 еквів.) гідрат гідразину додають до 20 мл диетилетеру. Емульсію охолоджують на бані крига/NaCl до -10 °C. Розчин 1.47 г 3-фуран-3-іл-пропеналу у 20 мл диетилетеру додають по краплинах. Суміш перемішують усю ніч (на крижаній бані) та дають повільно досягти кімнатної температури. 5 % водний NaHCO3 додають та суміш екстрагують 3 рази з ЕА. Поєднані органічні шари сушать над Na2SO4, фільтрують та концентрують у вакуумі. Осад уловлюють у іонообмінну колону SCX, промивають МеОН та елююють з 1М NH3 у МеОН до виходу 950 мг помаранчевої олії, що містить 85 % бажаного продукту після випарювання. Цей 1 матеріал використовують на наступних етапах без подальшого очищення. Н ЯМР (400 МГц, CDCl3) δ 2.62-2.72 (m, 1H), 2.97-3.07 (m, 1H), 4.62-4.71 (m, 1Η), 5.57-5.74 (br s, 1Η), 6.36 (br s, 1H), 6.87 (br s, 1H), 7.35-7.41 (m, 2H). 35 40 45 3-Піридин-2-іл-пропенал 6.08 г (трифенілфосфораніліден)ацетальдегід суспендують у 10 мл сухого DMF. Додають 1.90 мл (1 еквів.) піридин-2-карбальдегід та суміш перемішують усю ніч при кімнатній температурі. Суміш вміщують у ЕА та промивають 4 рази з 5 % водним NaHCO3, органічну фазу сушать над Na2SO4, фільтрують та концентрують у вакуумі. Осад суспендують у РА, фільтрують та концентрують у вакуумі до виходу 1.50 г темно-жовтої олії, що містить 80 % бажаного 1 продукту. Цей матеріал використовують на наступних етапах без подальшого очищення. Н ЯМР (400 МГц, CDCI3) δ 7.09 (dd, J=8 та 16 Гц, 1Н), 7.30-7.36 (m, 1H), 7.49-7.59 (m, 2Н), 7.77 (dt, J=8, 8 та 2 Гц, 1Η), 8.67-8.74 (m, 1Η), 9.81 (d, J=8 Гц, 1Η). 20 UA 98122 C2 5 10 15 20 25 30 2-(3,4-Дигідро-2Н-піразол-3-іл)-піридин 4.56 мл (10 еквів.) гідрат гідразину додають до 20 мл диетилетеру. Емульсію охолоджують на бані крига/NaCI до -10 °C. Розчин 1.25 г 3-піридин-2-іл-пропеналу у 20 мл диетилетері додають по краплинах. Суміш перемішують усю ніч (на крижаній бані) та дають повільно досягти кімнатної температури. 5 % водний NaHCO3 додають та екстрагують 5 разів з ЕА. Поєднані органічні шари сушать над Na2SO4, фільтрують та концентрують у вакуумі. Осад уловлюють у іонообмінну колону SCX, промивають з МеОН та елююють з 1М NH3 у МеОН до виходу 1.28 г коричневої олії що містить 90 % бажаного продукту. Цей матеріал використовують 1 на наступних етапах без подальшого очищення. Н ЯМР (400 МГц, CDCI3) δ 2.84-2.94 (m, 1H), 3.19-3.29 (m, 1H), 4.82-4.90 (m, 1H), 6.83 (br s, 1H), 7.17-7.23 (m, 1H), 7.35-7.40 (m, 1H), 7.69 (dt, J=7.5, 7.5 та 2 Гц, 1Η), 8.53-8.58 (m, 1Η). 3-Піридин-4-іл-пропенал 6.08 г (трифенілфосфораніліден)ацетальдегід суспендують у 10 мл сухого DMF. Додають 1.93 мл (1 еквів.) піридин-4-карбальдегіду та суміш перемішують усю ніч при кімнатній температурі. Суміш вміщують у ЕА та промивають 4 рази з 5 % водним NaHCO3, органічну фазу сушать над Na2SO4, фільтрують та концентрують у вакуумі. Осад суспендують у РА, фільтрують та концентрують у вакуумі до виходу 1.17 г жовтої олії, що містить 80 % бажаного продукту. Цей 1 матеріал використовують на наступних етапах без подальшого очищення Н ЯМР (400 МГц, CDCl3) δ 6.85 (dd, J=8 та 16 Гц, 1Н), 7.39-7.47 (m, 3Н), 8.70-8.74 (m, 2Н), 9.78 (d, J=8 Гц, 1Η). 4-(3,4-Дигідро-2Н-піразол-3-іл)-піридин 4.27 мл (10 еквів.) гідрату гідразину додають до 20 мл диетилетеру. Емульсію охолоджують на бані крига/NaCI до -10 °C. Розчин 1.17 г 3-піридин-4-іл-пропеналу у 20 мл диетилетеру додають по краплинах. Суміш перемішують усю ніч (на крижаній бані) та дають повільно досягти кімнатної температури. 5 % водний NaHCO3 додають та екстрагують 5 разів з ЕА. Поєднані органічні шари сушать над Na2SO4, фільтрують та концентрують у вакуумі. Осад уловлюють у іонообмінну колону SCX, промивають з МеОН та елююють з 1М NH3 у МеОН до виходу 1.23 г коричневої олії, що містить 90 % бажаного продукту. Цей матеріал 1 використовують на наступних етапах без подальшого очищення. Н ЯМР (400 МГц, CDCl3) δ 2.61-2.71 (m, 1Η), 3.15-3.25 (m, 1Η), 4.68-4.76 (m, 1H), 6.82 (br s, 1H), 7.25-7.30 (m, 2H), 8.55-8.60 (m, 2H). 35 40 45 3-Тіофен-3-іл-пропенал 10.0 г (трифенілфосфораніліден)ацетальдегід суспендують у 10 мл сухого DMF. Додають 2.88 мл (1 еквів.) тіофен-3-карбальдегіду та суміш перемішують усю ніч при 80 °C. Суміш вміщують у ЕА та промивають 4 рази з 5 % водним NaHCO3, органічну фазу сушать над Na2SO4, фільтрують та концентрують у вакуумі. Осад суспендують у РА, фільтрують та концентрують у вакуумі до виходу 4.16 г помаранчевої олії, що містить 54 % бажаного продукту. Цей матеріал 1 використовують на наступних етапах без подальшого очищення. Характерні сигнали у Н ЯМР (400 МГц, CDCI3): δ 6.54 (dd, J=8 та 16 Гц, 1Н), 9.66 (d, J=8 Гц, 1Н). 5-Тіофен-3-іл-4,5-дигідро-1Н-піразол 14.6 мл (10 еквів.) гідрату гідразину додають до 50 мл диетилетеру. Емульсію охолоджують на бані крига/NaCI до -10 °C. Ррозчин 4.16 г 3-тіофен-3-іл-пропеналу у 25 мл диетилетері додають по краплинах. Суміш перемішують усю ніч (на крижаній бані) та дають повільно досягти кімнатної температури. 5 % водний NaНСО3 додають та екстрагують 3 рази з ЕА. 21 UA 98122 C2 5 10 15 20 25 30 35 Поєднані органічні шари сушать над Na2SO4, фільтрують та концентрують у вакуумі до виходу 4.12 г помаранчевої олії, що містить 70 % бажаного продукту. Цей матеріал використовують на наступних етапах без подальшого очищення. 1 Характеристика сигналів піразоліну у Н ЯМР (400 МГц, CDCI3): δ 2.78-2.88 (m, 1H), 3.03-3.13 (m, 1Η), 4.77-4.86 (m, 1H), 6.86 (br s, 1H). 3-Тіофен-2-іл-пропенал 10.0 г (трифенілфосфораніліден)ацетальдегід суспендують у 10 мл сухого DMF. Додають 3.07 мл (1 еквів.) тіофен-2-карбальдегіду та суміш перемішують усю ніч при 80 °C. Суміш вміщують у ЕА та промивають 4 рази з 5 % водним NaHCO3, органічну фазу сушать над Na2SO4, фільтрують та концентрують у вакуумі. Осад суспендують у РА, фільтрують та концентрують у вакуумі до виходу 4.27 г помаранчевої олії, що містить 50 % бажаного продукту. Цей матеріал 1 використовують на наступних етапах без подальшого очищення. Характерні сигнали у Н ЯМР (400 МГц, CDCI3): δ 6.52 (dd, J=8 та 16 Гц, 1Н), 9.63 (d, J=8 Гц, 1Н). 5-Тіофен-2-іл-4,5-дигідро-1Н-піразол 15.0 мл (10 еквів.) гідрат гідразину додають до 50 мл диетилетеру. Емульсію охолоджують на бані крига/NaCI до -10 °C. Розчин 4.27 г 3-тіофен-2-іл-пропеналу у 25 мл диетилетері додають по краплинах. Суміш перемішують усю ніч (на крижаній бані) та дають повільно досягти кімнатної температури. 5 % водний NaHCO3 додають та екстрагують 3 рази з ЕА. Поєднані органічні шари сушать над Na2SO4, фільтрують та концентрують у вакуумі до виходу 5.58 г помаранчевої, олії що містить 70 % бажаного продукту. Цей матеріал використовують на 1 наступних етапах без подальшого очищення. Характеристика сигналів піразоліну у Н ЯМР (400 МГц, CDCI3): δ 2.77-2.86 (m, 1H), 3.08-3.18 (m, 1H), 4.95-5.03 (m, 1H), 6.88 (brs, 1H). 3-Ізопропил-5-феніл-4,5-дигідро-1Н-піразол 0.38 мл 3-метил-2-бутанону розчиняють у 10 мл DCM. Додають 0.36 мл (1 еквів.) бензальдегіду, з подальшим доданням по краплинах 1.50 мл трифлікангідрид. Суміш перемішують протягом 1 години при кімнатній температурі. Потім, додають 10 мл МеОН та 0.87 мл (5 еквів.) гідрат гідразину. Суміш перемішують протягом 30 хвилинэ при кімнатній температурі, та концентрують у вакуумі. Осад вміщують у DCM, екстрагують з 5 % водним NaHCO3, та органічну фазу сушать над Na2SO4, фільтрують та концентрують у вакуумі до виходу 520 мг коричневої олії, що містить біля 50 % бажаного продукту, яку використовують на наступних етапах без подальшого очищення. 40 45 4-Метил-5-феніл-4,5-дигідро-1Н-піразол 5.22 мл (1 еквів.) гідрату гідразину додають до 100 мл диетилетеру. Емульсію охолоджують на крижаній бані. 15.0 мл 2-Метил-3-феніл-пропеналу додають по краплинах, та суміш перемішують усю ніч при кімнатній температурі. Додають Н2О, органічний шар відділяють та водний шар екстрагують з диетилетером. Поєднані органічні шари сушать над Na2SO4, 22 UA 98122 C2 5 10 15 20 25 30 35 40 45 50 фільтрують та концентрують у вакуумі. Вакуумно дистильований вихід 5.9 г бажаного продукту 1 (суміш діастереомерних пар) у якості чистої рідини (76-82 °C, 0.2-0.3 мбар). Н ЯМР (400 МГц, CDCl3) першої діастереомерної пари: δ 0.71 (d, J=7 Гц), 3Н), 3.20-3.31 (m, 1Н), 4.77 (d, J=10 Гц, 1 1Н), 6.73 (brs, 1H), 7.23-7.42 (m, 5Н), 8.55-8.60 (m, 2H). Н ЯМР (400 МГц, CDCI3) другої діастереомерної пари: δ 1.24 (d, J=7 Гц), ЗН), 2.90-3.11 (m, 1H), 4.22 (d, J=11 Гц, 1H), 6.71 (brs, 1H), 7.23-7.42 (m, 5H), 8.55-8.60 (m, 2H). 2-Бензиліден-бутиральдегід 30.0 мл бензальдегіду розчиняють у 150 мл ЕtOН та охолоджують на крижаній бані. Додають 5.01 мл 45 % КОН (0.2 еквів.), з подальшим доданням по краплинах 16.5 мл бутиральдегіду. Суміш перемішують протягом 3 днів при кімнатній температурі, підкислюють 1М НСІ та екстрагують з етером. Органічний шар сушать над Na2SO4, фільтрують та концентрують у вакуумі. Вакуумно дисильований вихід 20.4 г жовтої рідини (78-82 °C, 0.6 мбар) що містить 70 % бажаного продукту. Цей матеріал використовують на наступних етапах без подальшого 1 очищення. Характерні сигнали у Н ЯМР (400 МГц, CDCI3): δ 1.15 (t, J=7.5 Гц, 3Н), 2.57 (q, J=7.5 Гц, 1H), 7.22 (s, 1H), 9.56 (s, 1H). 4-Етил-5-феніл-4,5-дигідро-1Н-піразол 62 мл (10 еквів.) гідрату гідразину додають до 150 мл диетилетеру. Емульсію охолоджують на бані крига/NaCI до -10 °C. Розчин 20.4 г 2-бензиліден-бутиральдегіду у 100 мл етеру додають по краплинах при -10 °C та перемішують при -10 °C 3 години. Суміш перемішують усю ніч (на крижаній бані) та дають повільно досягти кімнатної температури. Додають Н2О, органічний шар відділяють та водний шар екстрагують 2 рази з диетилетером. Поєднані органічні шари сушать над Na2SO4, фільтрують та концентрують у вакуумі. Вакуумно дисильований вихід 6.1 г чистої рідини (102-106 °C, 0.6 мбар), що містить 94 % бажаного продукту (суміш діастереомерних пар). 1 Характерні сигнали першої діастереомерної пари: Н ЯМР (400 МГц, CDCI3) δ 0.83 (t, J=6.5 Гц, 3Н), 3.03-3.13 (m, 1H), 4.74-4.81 (m, 1H), 6.83 (br s, 1H). Характерні сигнали другої 1 діастереомерної пари: Н ЯМР (400 МГц, CDCl3) δ 1.00 (t, J=7.5 Гц, 3Н), 2.84-2.93 (m, 1H), 4.284.34 (m, 1H), 6.76 (br s, 1H). (1-Метил-1,2,5,6-тетрагідро-піридин-3-іл)-метанол 15.0 г гідроброміду метил ефіру 1-Метил-1,2,5,6-тетрагідро-піридин-3-карбонової кислоти вміщують у ЕА та екстрагують з 2М NaOH. Органічний шар відділяють та водний шар знову екстрагують з ЕА. Поєднані органічні шари сушать над Na2SO4, фільтрують та концентрують до виходу 8.27 г вільної основи у вигляді жовтої олії (84 %). 6.5 г LіАІН4 (3.2 еквів.) суспендують у 100 мл сухого THF та охолоджують на крижаній бані. До нього додають по краплинах розчин 8.27 г метил ефіру 1-метил-1,2,5,6-тетрагідро-піридин-3-карбонової кислоти (вільна основа) у 50 мл сухого THF. Суміш перемішують протягом 3 годин при кімнатній температурі. Суміш охолоджують на крижаній бані та додають по краплинах 6.5 мл Н 2О, 13 мл 2 Μ NaOH та 6.5 мл Н2О. Осад фільтрують, промивають з етером та фільтрат концентрують у вакуумі до виходу 6.7 1 г безбарвної oil. Н ЯМР (400 МГц, CDCI3) δ 2.18-2.26 (m, 2H), 2.36 (s, 3Н), 2.49 (t, J=6 Гц, 2Н), 2.92-2.97 (m, 2H), 4.00 (br s, 2H), 5.68 (br s, 1H). 1-Метил-1,2,5,6-тетрагідро-піридин-3-карбал ьдегід 2.88 мл оксаліл хлорид (2.4 еквів.) розчиняють у 20 мл DCM. Суміш охолоджують до -78 °C та додають по краплинах розчин 3.37 мл DMSO (2.0 еквів.) у 10 мл DCM. Суміш перемішують протягом 15 хвилин при -78 °C. Розчин 3.0 г (1 -Метил-1,2,5,6-тетрагідро-піридин-3-іл)-метанолу у 10 мл DCM додають по краплинах, утримуючи температуру нижче - 65 °C. Суміш перемішують 23 UA 98122 C2 5 10 протягом 15 хвилин при -78 °C. 9.81 мл триетиламіну (30 еквів.) додають по краплинах та потім суміші дають нагрітися до кімнатної температури. 50 мл DCM додають, щоб суміш мала можливість бути перемішаною. Суміш перемішують протягом 1 годин при кімнатній температурі. Додають Н2О, органічний шар відділяють та водний шар знову екстрагують з DCM. Поєднані органічні шари сушать над Na2SO4, фільтрують та концентрований до виходу 3.24 г помаранчевої олії (85 % чистоти) яку використовують без подальшого очищення на наступному 1 етапі. Н ЯМР (400 МГц, CDCI3) δ 2.43 (s, 3Н), 2.48-2.60 (m, 4H), 3.11-3.15 (m, 2H), 6.85 (m, 1H), 9.43 (s, 1H). 5-Метил-3а, 4,5,6,7,7а-гексагідро-1Н-піразоло[4,3-с]піридин 3.2 г 1-Метил-1,2,5,6-тетрагідро-піридин-3-карбальдегід розчиняють у 10 мл n-BuOH. Додають 2 еквів. гідрату гідразину, суміш нагрівають зі зворотнім холодильником 24 години та потім концентрують у вакуумі. Осад вміщують у DCM та екстрагують з 2М NaOH, та органічну фазу сушать над Na2SO4, фільтрують та концентрують у вакуумі до виходу 1.78 г коричневої олії яку використовують без подальшого очищення на наступному етапі. 15 20 25 30 35 40 Бензил-біс-(2-хлор-етил)-амін Біс-(2-хлор-етил)-амін гідрохлорид суспендують у 150 мл ацетонітрилу. Додають 34.8 г К2СО3 (3 еквів.) та 10.0 мл бензилбромід (1 еквів.). Суміш нагрівають зі зворотнім холодильником усю ніч. Концентрують над силікагелем та очищують випарювальною 1 колонковою хроматографією (елюент РА:етер = 95:5) вихід 4.11 г безбарвної oil. H ЯМР (400 МГц, CDCI3) δ 2.93 (t, J=7 Гц, 4H), 3.50 (t, J=7 Гц, 4H), 3.74 (s, 2H), 7.22-7.37 (m, 5H). 1-Бензил-піперид-4,4-дикарбонітрил 0.57 г малонітрилу розчиняють у 20 мл DMF Додають 1.31 г К2СО3 (1.1 еквів.) та суміш перемішують протягом 2 годин при 65 °C. Розчин 2.0 г бензил-біс-(2-хлор-етил)-аміну (1 еквів.) у 10 мл DMF додають по краплинах при 65 °C, та суміш перемішують протягом іще 3 год. при 65 °C. Після охолодження, суміш розбавляють з ЕА та екстрагують з 5 % водним NaHCO3. Органічну фазу сушать над Na2SO4, фільтрують та концентрують у вакуумі до виходу 2.02 г помаранчевої олії, що містить 85 % бажаного продукту та 15 % бензил-біс-(2-хлор-етил)1 амін. Цей матеріал використовують на наступному етапі без подальшого очищення. Н ЯМР (400 МГц, CDCI3) δ 2.24 (t, J=5.5 Гц, 4H), 2.50-2.75 (br s, 4H), 3.55 (s, 2H), 7.22-7.42 (m, 5H). С-(4-Амінометил-1-бензил-піперидин-4-іл)-метиламін 1.50 г LiAIH4 (3 еквів.) суспендують у 100 мл сухого диетилетеру та охолоджують на крижаній бані. До нього додають по краплинах розчин 2.99 г 1-бензил-піперид-4,4дикарбонітрилу у 50 мл сухого THF. Суміш перемішують усю ніч при кімнатній температурі. Суміш охолоджують на крижаній бані та додають по краплинах 1.5 мл Н 2О, 3 мл 2 Μ NaOH та 1.5 мл Н2О. Осад фільтрують, промивають з THF та фільтрат концентрують у вакуумі до виходу 2.63 г жовтої олі.ї що містить біля 60 % бажаного продукту, який використовують без 1 подальшого очищення на наступному етапі. Н ЯМР (400 МГц, CDCI3) δ 1.00-1.60 (br s, 2H), 1.46 (t, J=5.5 Гц, 4Н), 2.40 (t, J=5.5 Гц, 4Н), 2.65 (s, 4H), 3.50 (s, 2H) 7.20-7.36 (m, 5H). 8-Бензил-2,3,8-триаза-спіро[4.5]дец-2-ен 24 UA 98122 C2 5 10 15 20 25 30 35 40 45 2.48 г С-(4-Амінометил-1-бензил-піперидин-4-іл)-метиламін суспендують у 40 мл Н2О та 10 мл МеОН та охолоджують на крижаній бані. Одночасно, додають по краплинах 6.7 мл 30 % Н2О2 (6 еквів.) та 15.2 мл 10 % NaCIO (2.4 еквів.). Суміш перемішують при кімнатній температурі 1 годину. Суміш екстрагують 2 рази з DCM, поєднані органічні шари сушать над Na2SO4, фільтрують та концентрований до виходу 2.20 г жовтої олії, яку використовують без подальшого очищення на наступному етапі. Згідно схемі 2, сполуку 155 одержують з цим блоком піразолінової структури. Звідси, зняття захисту бензилу (АСЕ-хлорид у 1,2-DCE з подальшим МеОН) дає сполуку 156, яку метилюють відновлювальною алкіляцією ((СН2О)n у присутності NaBH(OAc)3 in 1,2-DCE) одержуючи сполуку 157. Метилмалонітрил До малонітрилу (10.00 г; 151.32 ммоль; 2.0 еквів.) додають йодметан (4.71 мл; 75.66 ммоль; 1.0 еквів.) та тетрабутиламоній бромід (0.98 д; 3.03 ммоль; 0.04 еквів.). Суміш перемішують при кімнатній температурі 30 хвилин, потім охолоджують на крижаній бані, та повільно додають калій mpem-бутоксид (8.49 д; 75.66 ммоль; 1.0 еквів.) (додання починається до затвердівання суміші). Суміш перемішують протягом 2 годин при кімнатній температурі. Додають воду, супроводжуючи екстракцією з DCM двічі. Сушать над Na2SO4, фільтрація та видалення розчинниак дають на виході 10 г коричневої рідини, яку очищують випарювальною-колонковою хроматографією з елюентами DCM:PA=1:1, 3:1 та DCM до виходу 3.25 г чистої рідини (solidified 1 upon standinr). Н ЯМР (400 МГц, CDCI3) δ 1.79 (d, J=7.5 Гц, 3Н), 3.79 (q, J=7.5 Гц, 1 Η). 2-Бензилоксиметил-2-метил-малононітрил Метилмалонітрил (3.22 г; 39.40 ммоль; 10 еквів.) розчиняють у THF (35 мл). Додають бензил хлорметил етер (7.54 г; 43.35 ммоль; 1.1 еквів.) та натрій йодид (0.20 г; 1.33 ммоль; 0.03 еквів.). Жовту суспензію охолоджують на крижаній бані та додають малими порціями натрій гідрид (1.89 д; 47.29 ммоль; 1.2 еквів.). Утворюється більш білий осад. Суміш перемішують протягом 30 хвил при кімнатній температурі, розбавляють етером, та екстрагують з 5 % водним NaHCO3. Органічну фазу сушать над Na2SO4, фільтрують та концентрують у вакуумі, одержуючи 9.6 г жовтої рідини / олії. Очищення випарювальною колонковою хроматографією (елюент ЕА:РА = 1 1:4) вихід 6.2 г жовтої олії. Н ЯМР (400 МГц, CDCl3) δ 1.78 (s, ЗН), 3.72 (s, 1H), 4.71 (s, 2H), 7.317.43 (m, 5H). 2-Бензилоксиметил-2-метил-пропан-1,3-диамін LiAIH4 (3.22 g; 84.84 ммоль; 3.0 еквів.) суспендують у 30 мл сухого диетилетеру та охолоджують на крижаній бані. Розчин 2-бензилоксиметил-2-метил-малононітрилу (5.72 г; 28.28 ммоль; 1.0 еквів.) у 20 мл сухого диетилетеру додають по краплинах. Суспензію перемішують при кімнатній температурі 4 години, та потім охолоджують на крижаній бані. До неї додають 3.22 мл Н2О, 6.44 мл 2 Μ NaOH та 3.22 мл Н2О. Осад відфільтровують та промивають з етером. 1 Фільтрат концентрують під зниженим тиском до виходу 5.47 г (84 %) безбарвної оіі, Н ЯМР (400 МГц, CDCI3) δ 0.84 (s, ЗН), 2.59-2.69 (m, 4H) 3.29 (s, 2H), 4.49 (s, 2H), 7.24-7.39 (m, 5H). 4-Бензилоксиметил-4-метил-4,5-дигідро-3Н-піразол 5.92 г 2-Бензилоксиметил-2-метил-пропан-1,3-диамін розчиняють у воді (40 мл) та МеОН (10 мл) та охолоджують на крижаній бані. Одночасно, 30 % Н2О2 (16.1 мл) та 10 % NaCIO (36.5 мл) додають по краплинах. Одержану білу емульсію перемішують усю ніч при кімнатній 25 UA 98122 C2 5 10 15 20 25 30 35 40 45 50 температурі. Суміш екстрагують з DCM, органічну фазу сушать над Na2SO4, фільтрують та концентрують у вакуумі до виходу 5.69 г блідо-жовтої олії, що містить біля 70 % бажаного 1 продукту, яку використовують без подальшого очищення на наступному етапі. Н ЯМР (400 МГц, CDCI3) δ 1.05 (s, ЗН), 3.22 (s, 2H), 4.11-4.20 (m, 2H), 4.29-4.38 (m, 2H), 4.48 (s: 2H), 7.24-7.39 (m, 5H). Тетрагідро-піран-4,4-дикарбонітрил Малононітрил (5.0 г) розчиняють у DMSO (5 мл). Потім, біс(2-брометил) етер (9.49 мл) та ТВАВ (1.22 г) додають, з подальшим доданням порціями KOfBu (8.49 г). Суміш перемішують протягом 4 год. при кімнатній температурі, вміщують у DCM та екстрагують 3 рази з 5 % водним NaHCO3. Органічну фазу сушать над Na2SO4 та випарюють під зниженим тиском. Сирий матеріал очищують випарювальною хроматографією елююванням з PA:Et2O 65:35 (Rf=0.24, 1 візуалізують з КМпО4) одержуючи 2.49 г (24 %) твердого продукту. Н ЯМР (400 МГц, CDCI3) δ 2.24 (t, 4H), 3.87 (t, 4H). С-(4-Амінометил-тетрагідро-піран-4-іл)-метиламін Тетрагідро-піран-4,4-дикарбонітрил (1.52 г) розчиняють у сухому THF (25 мл) та охолоджують до -10 °C. До цього розчину, BH3THF (56 мл 1М розчину у THF, 5 еквів.) додають по краплинах, суміші дають нагрітися до кімнатної температури, та потім перемішують при 60 °C 6 год. Суміш охолоджують на кризі, та додають НСІ (24.2 мл 6М водного розчину, 13 еквів.). Суміші дають нагрітися до кімнатної температури та перемішують 2 год. Суміш нейтралізують 2М водним NaOH та екстрагують тричі з DCM. Водний шар випарюють до сухого стану, осад перемішують СНСІ3, тверду частину відфільтровують та органічну фазу випарюють під Ί зниженим тиском до виходу 1.0 г (62 %) жовтої олії. Η ЯМР (400 МГц, CDCI3) δ 1.46 (t, 4H), 2.74 (s, 4H), 3.67 (t, 4H). 8-Окса-2,3-диаза-спіро[4.5]дец-2 єн С-(4-Амінометил-тетрагідро-піран-4-іл)-метиламін (1.0 г) вводять до суміші Н2О (10 мл) та МеОН (2.5 мл), та охолоджують на кризі. Одночасно, Н 2О2 (4.8 мл 30 % розчину, 6 еквів.) та NaClO (12.4 мл 10 % розчину, 2.4 еквів.) додають по краплинах, крижану баню видаляють, та суміш перемішують усю ніч при кімнатній температурі. Екстракція з DCM, сушать над Na2SO4 та випарювання під зниженим тиском дають на виході 380 мг чистої, жовтавої рідини, що містить 85 % бажаного продукту та 15 % вихідного матеріалу диаміну. Цей матеріал використовують на 1 наступних етапах без подальшого очищення. Н ЯМР (400 МГц, CDCI3) δ 1.49 (t, 4H), 3.65 (f, 4H), 4.28 (s, 4H). 2,2-Біс-(2,2,2-трифтор-етил)-малононітрил Малононітрил (20.15 ммоль) та 1-йод-3,3,3-трифторпропан (42.65 ммоль) розчиняють у 30 мл сухого THF, та суміш охолоджують на бані крига/сіль. 1.61 г NaH (40.3 ммоль) додають порціями, утримуючи температуру нижче 5 °C. Реакційну суміш перемішують при кімнатній температурі 2 години та випарюють під зниженим тиском. Сирий матеріал очищують 1 випарювальною хроматографією елююванням з DCM, з виходом 0.76 грамів олії. Н ЯМР (400 МГц, CDCI3) δ 2.62-2.49 (m, 4H), 2.31-2.24 (m, 4H) 2,2-Біс-(2,2,2-трифтор-етил)-пропан-1,3-диамін 340 мг LiAIH4 (8.95 ммоль) суспендують у 15 мл сухого Et2O та охолоджують на кризі. Розчин 760 мг 2,2-Біс-(2,2,2-трифтор-етил)-малононітрил у Et2O додають по краплинах при таких умовах, що температура утримується нижче 20 °C. Суміш перемішують усю ніч при кімнатній температурі, охолоджують на кризі, та гасять додаванням Н 2О (0.35 мл), 2М водного 26 UA 98122 C2 5 10 NaOH (0.70 мл), та знову Н2О (0.35 мл). Суспензію фільтрують, фільтрувальний брикет промивають з Et2O, та поєднані фільтрати випарюють до сухого стану під зниженим тиском одержуючи 0.72 г олії. Цей матеріал використовують на наступному етапі без подальшого очищення. 4,4-Біс-(2,2,2-трифтор-етил)-4,5-дигідро-3Н-піразол 2,2-Біс-(2,2,2-трифтор-етил)-пропан-1,3-диамін (720 шг) вводять до суміші Н2О (3 мл) та МеОН (0.75 мл), та охолоджують на кризі. Одночасно, Н 2О2 (1.7 мл 30 % розчину, 6 еквів.) та NaClO (3.85 мл 10 % розчину, 2.4 еквів.) додають по краплинах, крижану баню видаляють, та суміш перемішують усю ніч при кімнатній температурі. Суміш екстрагують з DCM, органічну фазу сушать над MgSO4, та випарювання під зниженим тиском вихід 0.82 г олії, що містить 50 % бажаного продукту та 50 % вихідного матеріалу диаміну. Цей матеріал використовують на 1 наступному етапі без подальшого очищення. Н ЯМР (400 МГц, СОСІ3) δ 4.25 (s, 2Η), 2.24-1.85 (m, 4Η), 1.85-1.43 (m, 4H). ПРИКЛАД 4: СИНТЕЗ ОКРЕМИХ СПОЛУК 15 20 25 30 35 Метил ефір (2-Хлор-бензенсульфоніл)-карбамінова кислота До 25.0 г 2-хлор-бензенсульфонаміду додають 75 мл ацетонітрилу та 45.2 мл (2.5 екв.) триетиламіну. Суміш охолоджують на крижаній бані та 15.1 мл метил хлороформату повільно додають по краплинах. Суміш перемішують усю ніч при кімнатній температурі та концентрують у вакуумі. Додають воду та водний шар промивають двічі з етером. Окислення водного шару з 2 Μ НСІ веде до утворення білого осаду. Суспензію фільтрують, осад промивають з Н 2О та 1 сушать у вакуумі до виходу 19.1 г білої твердої речовини. Н ЯМР (400 МГц, DMSO-d6) δ 3.58 (s, 3Н), 7.52-7.61 (m, 1H), 7.62-7.72 (m, 2H), 8.10 (dd, J=8 та 1.5 Гц, 1H), 12.42 (brs, 1H). 2-Хлор-N-4-етил-4,5-дигідро-піразол-1-карбоніл) бензенсульфонамід 8.5 г 4-Етил-4,5-дигідро-1Н-піразолу розчиняють у 75 мл толуолу. Додають 19.0 г метил ефіру (2-хлор-бензенсульфоніл)-карбамінової кислоти, та суміш нагрівають зі зворотнім холодильником 4 години. Після охолодження утворюється осад. Суспензію фільтрують, осад 1 промивають з РА та сушать у вакуумі до виходу 20.3 г білих кристалів. Н ЯМР (200 МГц, DMSOd6) δ 0.90 (t, J=7.5 Гц, 3Н), 1.30-1.70 (m, 2H), 3.00-3.40 (m, 1H), 3.25 (t, J=10.5 Гц, 1H), 3.74 (t, J10.5 Гц, 1H), 7.08 (s, 1H), 7.40-7.73 (m, 3Н), 8.03-8.16 (m, 1H), 10.00 (br s, 1H). 27 UA 98122 C2 5 10 2-Хлор-N-[диетиламіно-4-етил-4,5-дигідро-піразол-1-іл]-метилен]-бензен-сульфонамід (сполука 1) 2.0 г 2-Хлор-N-4-етил-4,5-дигідро-піразол-1-карбоніл)бензенсульфонаміду розчиняють у 10 мл DCE. Додають 1.07 г 2-Хлор-1,3-диметилімідазолін хлорид (DMC) та 1.75 мл TEA та суміш нагрівають зі зворотнім холодильником 1.5 годин, утворюючи проміжний хлорімін in situ. Потім, 5 мл (надлишок) диетиламіну додають та суміш перемішують усю ніч при кімнатній температурі. Суміш концентрують у вакуумі та додають Н2О. Екстракція з DCM (2 рази), сушкаf поєднаних органічних шарів над Na2SO4, випарювання до сухого стану та очищення з випарювальною 1 хроматографією (етер, Rf=0.35) дають на виході 320 мг жовтої олії Н ЯМР (400 МГц, CDCI3) δ 0.95 (t, J-7.5 Гц, 3Н), 1.16 (t, J=7 Гц, 6Н), 1.44-1.66 (m 2Н), 3.00-3.10 (m, 1Н), 3.48 (q, J=7 Гц, 4Н), 3.70 (dd, J=11 та 7 Гц, 1Н), 4.11 (t, J=11 Гц, 1Н), 6.97 (d, J = 2Гц, 1Н), 7.30-7.41 (m, 2Н), 7.46 (dd, J=7.5 та 2 Гц, 1Н), 8.16 (dd, J=7.5 та 2 Гц, 1Н). 15 20 25 N-(Біс-метилсульфаніл-метилен)-2-хлор-бензенсульфонамід До 41.6 г 2-хлор-бензенсульфонаміду додають 300 мл DMF та 22 мл сірковуглецю. Суміш охолоджують на крижаній бані. Розчин 29 г КОН (15.0 мл) у 100 мл Н2О додають по краплинах при таких умовах, що температура утримується нижче 10 °C. Суміш перемішують протягом 30 хвилин при 5 °C. Потім, 32 мл Mel додають по краплинах при таких умовах, що температура утримується нижче 10 °C. Потім, суміші дають нагрітися до кімнатної температури та перемішують іще 30 хвилин. Додають Н2О та утворюється осад. Його відфільтровують та промивають з Н2О. Осад розтирають в порошок з ЕЮН, відфільтровують та сушать у вакуумі до 1 виходу 42.6 г білих кристалів. Н ЯМР (200 МГц, CDCI3) δ 2.57 (s, 6Н), 7.32-7.60 (m, 3Н), 8.118.27 (br d, J=7.5 Гц, 1Η). 30 35 2-Хлор-N-[(4-етил-4,5-дигідро-піразол-1-іл)-метил-сульфаніл-метилен]бензенсульфон-амід 500 мг 4-Етил-4;5-дигідро-1Н-піразолу розчиняють у 10 мл піридину. Додають 1.51 г N-(Бісметилсульфаніл-метилен)-2-хлор-бензенсульфонаміду та суміш нагрівають зі зворотнім холодильником усю ніч. Суміш концентрують у вакуумі та додають Н 2О, з подальшою екстракцією двічі з DCM. Поєднані органічні шари сушать над Na2SO4 та концентрують у вакуумі. Сирий продукт очищують випарювальною хроматографією (градієнт ОСМ:ацетон = 1 100:0 до 95:5) до виходу 1.30 г жовтої олії. Н ЯМР (400 МГц, CDCl3) δ 1.02 (t, J=7.5 Гц, 3H): 1.55 28
ДивитисяДодаткова інформація
Назва патенту англійськоюSulfonylpyrazoline carboxamidine derivatives as antagonists of 5-ht6 receptors
Автори англійськоюIwema Bakker, Wouter I., Iwema Bakker Wouter I., Keizer Hiskias G., van der Neut, Martina A.W., Kruse, Cornelis G., van Loevezijn, Arnold, Zorgdrager, Jan
Назва патенту російськоюПроизводные сульфонилпиразол и сульфонилпиразолон карбоксамидина как антагонисты рецепторов 5-ht6
Автори російськоюИвема Баккер Воутер И., Кейзер Гискиас Г., ван дер Ньот Мартина А.В., Крузе Корнелис Г., ван Лувезейн Арнольд, Зоргдрагер Ян
МПК / Мітки
МПК: C07D 513/04, C07D 409/04, C07D 401/12, C07D 407/04, C07D 409/14, C07D 401/04, A61K 31/415, A61K 31/4155, C07D 409/12, C07D 407/12, C07D 403/12, C07D 231/12, A61P 25/00, C07D 231/06, C07D 417/12
Мітки: рецепторів, антагоністи, 5-ht6, сульфонілпіразолон, сульфонілпіразол, карбоксамідину, похідні
Код посилання
<a href="https://ua.patents.su/58-98122-pokhidni-sulfonilpirazol-ta-sulfonilpirazolon-karboksamidinu-yak-antagonisti-receptoriv-5-ht6.html" target="_blank" rel="follow" title="База патентів України">Похідні сульфонілпіразол та сульфонілпіразолон карбоксамідину як антагоністи рецепторів 5-ht6</a>
Попередній патент: Екструзійний картоплепродукт “повітряна картопля рисово-бурякова”
Наступний патент: Композиція для виготовлення сирокопченої ковбаси для гурманів
Випадковий патент: Спосіб кодування послідовності бітів даних в послідовність канальних бітів та носій запису для кодованої послідовності бітів даних