Спосіб одержання 5-(1-піперазиніл)бензофуран-2-карбоксаміду (варіанти) та проміжна сполука
Номер патенту: 76944
Опубліковано: 16.10.2006
Автори: Еммерт Стеффен, Бьотчер Хеннінг, Хелферт Берн, Бате Андреас
Формула / Реферат
1. Спосіб одержання 5-(1-піперазиніл)бензофуран-2-карбоксаміду, який відрізняється тим, що в одному реакторі проводять реакцію 5-бромсаліцилальдегіду спочатку зі сполукою формули І
L-CH2-COOR1, (І)
в якій L означає Сl, Вr, І або реакційноздатну етерифіковану групу ОН, а R1 означає алкіл, що містить від 1 до 6 атомів вуглецю, або бензил,
а потім з формамідом та одержують 5-L-бензофуран-2-карбоксамід (II), в якому L означає Сl, Вr, І або реакційноздатну етерифіковану групу ОН,
далі (II) піддають амінуванню з каталізаторами з перехідних металів, при якому проводять його реакцію з R2-піперазином, у якому R2 означає Н або амінозахисну групу, та одержують сполуку формули III
 , (III)
, (III)
в якій R2 означає Н або амінозахисну групу,
і далі, якщо R2 ![]() Н, то R2 відщеплюють.
Н, то R2 відщеплюють.
2. Спосіб за п. 1, який відрізняється тим, що L у сполуці формули І означає Вr.
3. Спосіб за п. 1, який відрізняється тим, що застосовують каталітичну систему з перехідним металом, якою є Рd(ОАс)2/Р(трет-бутил)3.
4. Спосіб за п. 1, який відрізняється тим, що в реакції 5-бромсаліцилальдегіду зі сполукою формули І як розчинник використовують N-метилпіролідон.
5. Спосіб одержання 5-(1-піперазиніл)бензофуран-2-карбоксаміду, який відрізняється тим, що проводять реакцію амінування сполуки формули IV
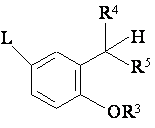 , (IV)
, (IV)
в якій L означає Сl, Вr, І або реакційноздатну етерифіковану групу ОН, R3 означає Н або CH2R6, R4 та R5 разом є карбонілом, R6 означає CN, COOH, COOR7 або CONH2, R7 означає алкіл, що містить від 1 до 6 атомів вуглецю,
з каталізаторами з перехідних металів з R2-піперазином, у якому R2 означає Н або амінозахисну групу,
і одержують сполуку формули V
 , (V)
, (V)
в якій R2 означає Н або амінозахисну групу, R3 означає Н або CH2R6, R4 та R5 разом є карбонілом, R6 означає CN, COOH, COOR7 або СОNН2, R7 означає алкіл, що містить від 1 до 6 атомів вуглецю,
і потім проводять її реакцію в одному реакторі спочатку зі сполукою формули І
L-CH2-COOR1, (І)
в якій L означає Сl, Вr, І або реакційноздатну етерифіковану групу ОН, та R1 означає алкіл, що містить від 1 до 6 атомів вуглецю, або бензил,
а далі - з формамідом та одержують сполуку формули III
 , (III)
, (III)
в якій R2 означає Н або амінозахисну групу,
і потім, якщо R2 ![]() Н, то R2 відщеплюють.
Н, то R2 відщеплюють.
6. Спосіб за п. 5, який відрізняється тим, що використовують каталітичну систему з перехідним металом, якою є Рd(ОАс)2/Р(трет-бутил)3.
7. Спосіб одержання 5-(1-піперазиніл)бензофуран-2-карбоксаміду, який відрізняється тим, що проводять реакцію сполуки формули V
 , (V)
, (V)
в якій R2 означає амінозахисну групу, R3 означає Н або CH2R6, R4 та R5 разом є карбонілом, R6 означає CN, СООН, COOR7 або CONH2, R7 означає алкіл, що містить від 1 до 6 атомів вуглецю,
з хлорацетамідом та одержують сполуку формули III
 , (III)
, (III)
в якій R2 означає амінозахисну групу,
і потім R2 відщеплюють.
8. Сполука формули V
 , (V)
, (V)
в якій
R2 означає Н або амінозахисну групу,
R3 означає Н або CH2R6,
R4 та R5 разом є карбонілом,
R6 означає CN, СООН, COOR7 або CONH2,
R7 означає алкіл, що містить від 1 до 6 атомів вуглецю,
R8 означає феніл, що може бути незаміщеним або моно- чи бізаміщеним R7, OR7, SR7 або Hal,
n означає 2 або 3,
а також її солі та сольвати.
Текст
1. Спосіб одержання 5-(1піперазиніл)бензофуран-2-карбоксаміду, який відрізняється тим, що в одному реакторі проводять реакцію 5-бромсаліцилальдегіду спочатку зі сполукою формули І L-CH2-COOR1, (І) в якій L означає Сl, Вr, І або реакційноздатну етерифіковану групу ОН, а R1 означає алкіл, що містить від 1 до 6 атомів вуглецю, або бензил, а потім з формамідом та одержують 5-Lбензофуран-2-карбоксамід (II), в якому L означає Сl, Вr, І або реакційноздатну етерифіковану групу ОН, далі (II) піддають амінуванню з каталізаторами з перехідних металів, при якому проводять його реакцію з R2-піперазином, у якому R2 означає Н або амінозахисну групу, та одержують сполуку формули III 2 3 76944 4 R6 означає CN, COOH, COOR7 або СОNН2, R7 в якій R2 означає амінозахисну групу, R3 означає Н означає алкіл, що містить від 1 до 6 атомів вуглеабо CH2R6, R4 та R5 разом є карбонілом, R6 ознацю, чає CN, СООН, COOR7 або CONH2, R7 означає і потім проводять її реакцію в одному реакторі алкіл, що містить від 1 до 6 атомів вуглецю, спочатку зі сполукою формули І з хлорацетамідом та одержують сполуку формули 1 L-CH2-COOR , (І) III в якій L означає Сl, Вr, І або реакційноздатну етеR2 1 N рифіковану групу ОН, та R означає алкіл, що містить від 1 до 6 атомів вуглецю, або бензил, N O (III) а далі - з формамідом та одержують сполуку формули III NH2 O , R2 2 в якій R означає амінозахисну групу, N і потім R2 відщеплюють. N O (III) 8. Сполука формули V R2 NH2 O , в якій R2 означає Н або амінозахисну групу, і потім, якщо R2 Н, то R2 відщеплюють. 6. Спосіб за п. 5, який відрізняється тим, що використовують каталітичну систему з перехідним металом, якою є Рd(ОАс)2/Р(трет-бутил)3. 7. Спосіб одержання 5-(1-піперазиніл)бензофуран2-карбоксаміду, який відрізняється тим, що проводять реакцію сполуки формули V R2 R4 N N H R5 (V) OR3 , Винахід відноситься до способу одержання 5(1-піперазиніл)бензофуран-2-карбоксаміду, який відрізняється тим, що a) в одному реакторі проводять реакцію 5бромсаліцилальдегіду спочатку зі сполукою з формулою І L-CH2-COOR1 (І) в якій L означає СІ, Вr, І або реакційноздатну етерифіковану групу ОН, та R1 означає алкіл, що містить від 1 до 6 атомів вуглецю або бензил, а потім з формамідом, та одержують 5-Lбензофуран-2-карбоксамід (II), в якому L представляє собою СІ, Вr, І або реакційноздатну етерифіковану групу ОН, (II) далі піддають амінуванню з каталізаторами з перехідних металів, при якому проводять його реакцію з R2-піперазином, у якому R2 представляє собою Η або амінозахисну групу, та одержують сполуку з формулою III R4 N N H R5 (V) OR3 , в якій R2 означає Н або амінозахисну групу, R3 означає Н або CH2R6, R4 та R5 разом є карбонілом, R6 означає CN, СООН, COOR7 або CONH2, R7 означає алкіл, що містить від 1 до 6 атомів вуглецю, R8 означає феніл, що може бути незаміщеним або моно- чи бізаміщеним R7, OR7, SR7 або Hal, n означає 2 або 3, а також її солі та сольвати. в якій R2 означає Η або амінозахисну групу, і далі, якщо R2 Η, то R2 відщеплюють, або b) проводять реакцію сполуки з формулою IV в якій L означає СІ, Вr, І або реакційноздатну етерифіковану групу ОН, R3 означає Η або CH2R6, R4 та R5 кожен, незалежно один від одного, представляють собою OR7, OR8, SR7 або SR8, R4 та R5 разом представляють собою, альтернативно, карбоніл, =S, =N-C(R7)2, =N-C(R8)2, =NOH, =N-OR7, =N-N[(R7)2], =N-N[(R8)2] або -O-(CH2)nO-, R6 означає CN, COOH, COOR7 або CONH2, 7 R означає алкіл, що містить від 1 до 6 атомів вуглецю, R8 означає феніл який може бути незаміщеним або моно- чи бізаміщеним R7, OR7, SR7 або Hal, n означає 2 або 3, при амінуванні з каталізаторами з перехідних 5 76944 6 металів, з R2-піперазином, в якому R2 означає Η та/або тим, що 5-(1-піперазиніл)бензофуран-2або амінозахисну групу, карбоксамід перетворюють в одну з його солей за і одержують сполуку з формулою V допомогою обробки кислотою. Винахід відноситься також до сполук з формулою V в якій R2 означає Η або амінозахисну групу, R3 означає Η або CH2R6, R4 та R5 кожен, незалежно друг від друга, представляють собою, OR7, OR8, SR7 або SR8, R4 та R5 разом представляють собою, альтернативно, карбоніл, =S, =N-C(R7)2, =N-C(R8)2, =NOH, -N-OR7, =N-N[(R7)2], =N-N[(R6)2] або -O-(CH2)nO-, R6 означає CN, COOH, COOR7 або CONH2, R7 означає алкіл, що містить від 1 до 6 атомів вуглецю, R8 означає феніл, що може бути незаміщеним або моно- чи бізаміщеним R7, OR7, SR7 або Hal, n означає 2 або 3, і потім проводять його реакцію в одному реакторі спочатку зі сполукою з формулою І L-CH2-COOR1 (І) в якій L означає СІ, Вr, І або реакційноздатну етерифіковану групу ОН, та R1 означає алкіл, що містить від 1 до 6 атомів вуглецю, або бензил, а далі - з формамідом, та одержують сполуку з формулою III в якій R2 означає Η або амінозахисну групу, і потім, якщо R2 * Н, то R2 відщеплюють, або с) проводять реакцію сполуки з формулою V в якій R2 означає амінозахисну групу, R3 означає Η або CH2R6, R4 та R5 кожен, незалежно друг від друга, означають OR7, OR8, SR7 або SR8, R4TaR5 разом представляють собою, альтернативно, карбоніл, =S, =N-C(R7)2, =N-C(R8)2, =NOH, =N-OR7, =N-N[(R7)2], =N-N[(R8)2] або -O-(CH2)nO-, R6 означає CN, COOH, COOR7 або CONH2, R7 означає алкіл, що містить від 1 до 6 атомів вуглецю, R8 означає феніл, що може бути незаміщеним, або моно- чи бізаміщеним R7, OR7, SR7 або Hal, n означає 2 або 3, з хлорацетамідом, та одержують сполуку з формулою III, в якій R2 означає амінозахисну групу, і потім R2 відщеплюють, в якій R2 означає Η або амінозахисну групу, R3 означає Η або CH2R6, R4 та R5 кожен, незалежно друг від друга, представляють собою, OR7, OR8, SR7 або SR8, R4 та R5 разом представляють собою, альтернативно, карбоніл, =S, =N-C(R7)2, =N-C(R8)2) =NOH, =N-OR7, =N-N[(R7)2], =N-N[(R8)2] або -O-(CH2)nO-, R6 означає CN, COOH, COOR7 або CONH2, R7 означає алкіл, що містить від 1 до 6 атомів вуглецю, R8 означає феніл, що може бути незаміщеним або моно- чи бізаміщеним R7, OR7, SR7 або Hal, n означає 2 або 3, а також їх солей та сольватів. 5-(1-піперазиніл)бензофуран-2-карбоксамід представляє собою важливу проміжну сполуку для одержання активних фармацевтичних інгредієнтів. Це описано, наприклад, у DE 19730989, WO 9857953, ЕР 738722, ЕР 736525, DE 4414113, DE 4333254 або DE 4101686. Похідні бензофурану як попередники описані, наприклад, у DE 19514567. Способи одержання гетероциклічних ароматичних амінів або ариламінів, в яких як каталізатори застосовуються перехідні метали, відомі й описані, наприклад, в ЕР 0802173. Реакції амінування як такі описані в оглядовій статті [J.F. Martinez в Angew, Ch. Int. 37, 20462062]. Інші способи одержання третинних ариламінів із застосуванням каталізаторів, виготовлених із триалкілфосфіну та паладія, розкриті в JP 10310561 (Kokai application), Заявка No. 9-119477 або JP 11-80346 (Kokai application), Заявка No. 9245218. Спосіб каталітичного одержання ариламінів з каталізаторами з перехідних металів був описаний S.L. Buchwald т ін. у US 5,576,460. Інший спосіб одержання ароматичних амінів із хлорованих ароматичних сполук у присутності паладієвого каталізатора описаний в ЕР 0846676, J.F. Hartwig та ін. у [J. Org. Chem. 1999, pp.5575-5580, або S.L. Buchwald та ін. у J.A.C.S. 1999, 121, 9550-9561]. У [Tetrahedron Letters 39 (1998) 617-620, Μ. Nishiyama] описує синтез N-арилпіперазинів з арилгалогенідів та піперазину з каталізаторами з перехідних металів. У ході досліджень синтезу медичних препаратів, описаних, наприклад, у DE 4333254 (ЕР 0648767), зненацька було виявлено, що 5-(1піперазиніл)бензофуран-2-карбоксамід можна одержувати, принаймні, з порівнянним або більш 7 76944 8 високим загальним виходом, ніж у прототипі, прильних кислот, переважно за допомогою TFA (тричому необхідно відзначити, що при цьому з'являфтороцтової кислоти) або хлорної кислоти, а таються значні переваги, найбільш істотні з яких кож за допомогою інших сильних неорганічних простота проведення реакції і, отже, простота викислот, таких, як соляна кислота або сірчана кисділення продукту. лота, а також сильних органічних карбоксильних Іншим наслідком цього є низьке споживання кислот, таких, як трихлороцтова кислота, або сурозчинника й енергії. льфонових кислот, таких, як бензол- або рЯкщо L у сполуках з формулами І, II або IV толуолсульфонова кислота. Допустимо додатково означає реакційноздатну етерифіковану групу ОН, присутність інертного розчинника, але це не завто це повинна бути, переважно, алкілсульфонілокжди необхідно. Придатними інертними розчиннисигрупа, що містить від 1 до 6 атомів вуглецю (пеками є, переважно, органічні розчинники, наприреважно, метилсульфонілоксигрупа або трифторклад карбоксильні кислоти, такі, як оцтова кислота, метилсульфонілоксигрупа), ефіри, такі, як тетрагідрофуран або діоксан, аміди, арилсульфонілоксигрупа, яка містить 6-10 атомів такі, як диметилформамід, галогеновані вуглеводвуглецю (переважно, фенілабо рні, такі, як дихлорметан, крім того, також спирти, толілсульфонілоксигрупа, а, крім того, також 2такі, як метанол, етанол або ізопропанол, та вода. нафталінсульфонілоксигрупа) або, альтернативно, Крім того, придатними є суміші зазначених вище фторсульфонілоксигрупа. розчинників. TFA застосовують, переважно, у надR1 представляє собою алкіл або бензил. Алкіл лишку, без додавання інших розчинників, а хлорну у даному випадку містить 1, 2, 3, 4, 5 або 6 атомів кислоту застосовують, переважно, у виді суміші вуглецю, переважно, 1, 2, 3 або 4 атоми вуглецю, оцтової кислоти та 70% хлорної кислоти в співвідособливо переважно, наприклад, метил або етил, ношенні 9:1. Температури реакцій знаходяться, крім того, пропіл, ізопропіл, а також бутил, ізобупереважно, в інтервалі від близько 0 та до близько тил, бутил або трет-бутил. 50°, переважно, між 15 та 30°. Групу ВОС переваУ сполуках з формулою І, L означає переважжно відщеплюють із застосуванням TFA у дихлорно СІ, крім того, такожВr. метані або за допомогою від 3 до 5N соляної кисR2 означає Η або амінозахисну групу. Особлилоти в діоксані при 15-30°. во переважно, щоб R2 представляв собою аміноЗахисні групи, які можна видаляти гідрогенолізахисну групу. зом (наприклад CBZ або бензил), можна відщепТермін "амінозахисна група" є загальновідоляти, наприклад, за допомогою обробки воднем у мим та відноситься до груп, що придатні для захиприсутності каталізатора (наприклад, каталізатора сту (блокування) аміногруп від хімічних реакцій, з шляхетних металів, таких, як паладій, переважале які легко піддаються видаленню після того, як но, на підложці, такій, як графіт). бажана хімічна реакція проведена на інших полоПридатними для цих цілей розчинниками є пеженнях молекули. Звичайно такими групами є, рераховані вище, особливо, наприклад, спирти, зокрема, ацилова, арилова, аралкоксиметилова такі, як метанол або етанол, або аміди, такі, як або аралкілова групи. Оскільки амінозахисні групи DMF. В загальному випадку, гідрогеноліз прововидаляють після проведення бажаної реакції (чи дять при температурах між 0 та 100° та тисках між послідовності реакцій), їхній тип та розмір не маприблизно 1 та 200бар, переважно, при 20-30° та ють істотного значення; проте, переважними є ті, 1-10бар. котрі містять 1-20, особливо 1-8 атомів вуглецю. R3 переважно означає Н. Термін "ацилова група" в описі даного способу та R3 та R4 переважно означають метокси-, етокданих сполук варто розуміти в самому широкому си-, пропокси- або феноксигрупу. змісті. Він охоплює ацилові групи, витягнуті з аліR4 та R5 разом представляють собою, зокрефатичних, араліфатичних, ароматичних або гетема, карбоніл. роциклічних карбонових кислот або сульфонових У сполуках з формулою IV, Hal переважно кислот і, зокрема, алкоксикарбонільну, арилоксиозначає Вr. карбонільну й особливо аралкоксикарбонільну Сполуки з формулою IV та V можуть знаходигрупи. Прикладами ацилових груп цього типу є тися також у виді димерів, які можна знову розщеалканоїли, такі, як ацетил, пропіоніл, бутирил; пити на відповідні саліцилальдегіди, в яких L та R2 аралканоїли, такі, як фенілацетил; ароїли, такі, як приймають зазначені вище значення: бензоїл або толіл; арилоксіалканоїли, такі, як феноксіацетил; алкоксикарбоніли, такі, як метоксикарбоніл, етоксикарбоніл, 2,2,2трихлоретоксикарбоніл, ВОС (третбутоксикарбоніл), 2-йодоетоксикарбоніл; аралкілоксикарбоніли, такі, як CBZ (карбобензоксикарбоніл), на який також посилаються як на "Z"), 4метоксибензилоксикарбоніл, FMOC (9фторенілметоксикарбоніл); арилсульфоніли, такі, як Mtr (4-метокси-2,3,6-триметилфенілсульфоніл). R7 означає алкіл. У даному випадку, алкіл місОсобливо переважно, якщо R2 представляє тить 1, 2, 3, 4, 5 або 6 атомів вуглецю, переважно, собою бензил або ВОС. 1, 2, 3 або 4 атоми вуглецю, особлива перевага Амінозахисну групу можна видалити зі сполуки віддається, наприклад, метилу або етилу, і, крім з формулою III - у залежності від типу використатого, пропілу, ізопропілу, а також бутилу, ізобутиної захисної групи - за допомогою, наприклад, си 9 76944 10 лу, сек-бутилу або трет-бутилу. Придатні для застосування комплекси перехіУ сполуках з формулами IV та V, дних металів включають PdCI2 або Pd(OAc)2 або =N-C(R7)2 означає, переважно, =N-C(CH3)2, інші похідні Pd2+, попередньо відновлені за допо8 =N-C(R )Z означає, переважно, =Ν-Ο(феніл)Z, могою, наприклад, NaSH4 або фосфінів (цей етап =N-OR7 означає, переважно, =N-OCH3, може бути опущений у випадку надлишку ліганду 7 =N-N[(R )2] означає, переважно, =N-N[(CH3)2], R3P) або сполуки типу Pd(O), такі, як, наприклад, =N-N[(R3)Z] означає, переважно, =ΝPd(DBA)2 або Pd2 (DBA)3 (DBA = дибензиліденацеΝ[(феніл)2]. тон). Сполуки з формулами І та IV або відомі, або їх До комплексів паладія цього ряду можна доможна одержати за методиками, які відомі самі по дати відповідні комплекси лігандів нікелю або міді. собі та описані в літературі [наприклад, у класичКрім того, можна застосовувати такі ліганди, як них роботах, таких, як Houben-Weyl, Methoden der солі Ν,Ν-діарилімідазолію за методикою, описаorganischen Chemie [Methods of Organic Chemistry], ною [J. Huang та ін., Org. Lett. I, 1999, 1307-1309]. Georg-Thieme Verlag, Stuttgart], та їх можна одерВ число придатних для застосування лігандів жати при реакційних умовах, що відомі та є придафосфіну або аза/фосфіну входять трис-ортотними для названих реакцій. Можна застосовувати толілфосфін також варіанти цих реакцій, що самі по собі відомі, трициклогексилфосфін але тут докладно не описуються. 1-(2-дифенілфосфіно-1-нафтил)ізохінолін Спосіб: варіант а) (QUINAP) Реакцію 5-бромсаліцилальдегіду спочатку зі 1,3-біс(диметиламіно)нафталін сполукою з формулою І, а потім з формамідом, Phe2P-CH2-PPhe2 проводять в одному реакторі в придатному інертЗокрема, також Р(трет-бутил)3 = P(t-Bu)3 ному розчиннику з додаванням основи. 1,1'-біс(дифенілфосфано)ферроцен (DPPF у Прикладами придатних інертних розчинників є виді комплексу DPPFxPdCI2) вуглеводні, такі, як гексан, петролейний ефір, бен2,2'-біс(дифенілфосфіно)-1,1'-бінафтил (= зол, толуол або ксилол; хлоровані вуглеводні, такі, BINAP) як трихлоретилен, 1,2-дихлоретан, тетрахлорме(S)-дибутфос = 1-(2-ди-треттан, хлороформ або дихлорметан, ефіри, такі, як бутилфосфанілфенил)етилдиметиламін діетиловий ефір, діізопропіловий ефір, тетрагід1-(N,N-диметиламіно)-1'рофуран (THF) або діоксан; гліколеві ефіри, такі, (дициклогексилфосфіно)біфеніл як етиленгліколь монометиловий або моноетило1-(ди-t-бутилфосфіно)біфеніл вий ефір, етиленгліколя диметиловий ефір (диг1,1'-біс(ди-t-бутилфосфіно)біфеніл лім); кетони, такі, як ацетон або бутанон; нітрили, (t-Bu)2P-(CH2)n-P(t-Bu)2 n = 1, 2, 3 такі, як ацетонітрил; сульфоксиди, такі, як димети(t-Bu)2P-(CH2)m-X-(CH2)n-P(t-Bu)2 m, n = 1, 2, 3; лсульфоксид (DMSO); сірковуглець; нітросполуки, Χ = О, такі, як нітрометан або нітробензол; можна також … застосовувати суміші названих розчинників один з або альтернативно одним. DBtPF = 1,1'-біс(ди-третЧас протікання реакції, в залежності від застобутилфосфіно)ферроцен. совуваних умов, може складати від декількох хвиПрикладами придатних розчинників є вуглеволин до 14 днів, а температура реакції знаходиться дні, такі, як бензол, толуол, ксилол; хлоровані вугв діапазоні від близько 0° до 150°, переважно, між леводні, такі, як, наприклад, дихлорметани; кето60° та 120°. ни, такі, як ацетон, бутанон; ефіри, такі, як Найбільше переважно, щоб час протікання рететрагідрофуран (THF) або діоксан; нітрили, такі, акції знаходився в інтервалі від 4 до 20 годин, а як ацетонітрил, можуть бути придатними також температура - між 90 та 115°. суміші цих розчинників один з одним. Придатними основами є такі сполуки, як, наВ залежності від застосовуваних умов, час приклад, карбонати Na, К або Cs. протікання реакції може варіюватися від декількох Потім однореакторну реакцію проводять з фохвилин до 14 днів, та а температура реакції звирмамідом, переважно, в присутності органічної чайно підтримується в інтервалі між 0° та 180°, основи, переважно, алкоксиду лужного металу, звичайно між 30° та 130°. такого, як, наприклад, трет-бутоксид Na, та його Прикладами придатних основ є алкоксиди лувідповідний спирт, та в результаті одержують 5жних металів, такі, як, наприклад, Na третНаІ-бензофуран-2-карбоксамід (II). В (II), Hal ознабутоксид. чає, переважно, Вr. Спосіб: варіант b) Реакцію переважно проводять при температуРеакцію сполук з формулою IV з R2рах від 0 до 60°. піперазином проводять при умовах, описаних виІнші способи одержання (II) описані, наприще у варіанті а). клад, у [Bull. Soc. Chim. Fr., 1971; 4329, та О. Dann R4 та R5 можуть бути перетворені в карбонільта ін. у Justus Liebigs Ann. Chem. 1975; 160-194]. ну групу. Наступну однореакторну реакцію сполуки Описана вище однореакторна реакція протікає з з формулою V зі сполукою з формулою І та потім з кращим виходом, ніж ці зазначені реакції. формамідом теж проводять при описаних вище Для одержання сполуки з формулою III, проумовах. Видалення R2, якщо R2 Η, теж роблять водять реакцію (II) з R2-піперазином в придатному при описаних вище умовах. інертному розчиннику, в присутності основи та Основу з формулою І або з формулою V може каталізатора з перехідного металу. бути перетворено в асоційовану сіль з кислотним 11 76944 12 залишком за допомогою кислоти, наприклад, за тровують з відсмоктуванням та повторно промидопомогою реакції еквівалентних кількостей основають у 1 літрі демінералізованої води. ви та кислоти в інертному розчиннику, такому, як Кристали сушать протягом ночі, до припиненетанол, з наступним випарюванням. Особливо ня зміни ваги, при зниженому тиску та 60°С (вага придатними для цієї реакції кислотами є такі, котрі продукту: 113г світлобежевих кристалів; т. топл. приводять до одержання фізіологічно прийнятних 210-213°; CAS 35351-21-4). солей. Таким чином, можна застосовувати неоргаФізичні та спектроскопічні характеристики віднічні кислоти, наприклад сірчану кислоту, азотну повідають даним, опублікованим у: [Rene; Royer; кислоту, гідрогалогенідні кислоти, такі, як соляна BSCFAS; Bull. Soc. Chim. Fr; 1971; 4329, та Dann, кислота або бромистоводнева кислота, фосфорні О. та ін.; JLACBF; Justus Liebigs Ann. Chem.; GE; кислоти, такі, як ортофосфорна кислота, сульфа1975; 160-194]. мінова кислота, крім того, органічні кислоти, особТаким чином можна одержувати з порівнянниливо аліфатичні, аліциклічні, араліфатичні, аромами виходами 5-хлорбензофуран-2-карбоксамід (т. тичні гетероциклічні або моноосновні або топл. 200-202°), 5-фторбензофуран-2-карбоксамід поліосновні карбоксильні, сульфонові або сірчані та 5-йодбензофуран-2-карбоксамід. кислоти, наприклад мурашина кислота, оцтова 2) Синтез 5-(4-бензил-1кислота, пропіонова кислота, півалова кислота, піперазиніл)бензофуран-2-карбоксаміду шляхом діетилоцтова кислота, малонова кислота, бурштиамінування з каталізаторами з перехідних металів нова кислота, пімелова кислота, фумарова кисло5-бромбензофуран-2-карбоксаміду з застосуванта, малеїнова кислота, молочна кислота, винноканям бензилпіперазину м'яна кислота, яблучна кислота, лимонна кислота, глюконова кислота, аскорбінова кислота, нікотинова кислота, ізонікотинова кислота, метан- або етансульфонова кислота, етандисульфонова кислота, 2-гідроксіетансульфонова кислота, бензолсульфонова кислота, р-толуолсульфонова кислота, нафталенмоно- та -дисульфонова кислоти, лаурилсернокислі кислоти. Солі з фізіологічно Для ілюстрації проведення синтезу застосовунеприйнятними кислотами, наприклад, пікрати, ється каталітична система Pd(OAc)2/P(t-Bu)3: можна застосовувати для виділення і/чи очищення 0,30г P(t-Bu)3, 4,5г 5-бромбензофуран-2сполук з формулою І. карбоксаміду, 4,9г бензилпіперазину та 5,0г Na tВище та нижче всі температури зазначені в °С. OBu додають до суспензії 0,085г ацетату Pd(ll) у В приведених нижче прикладах термін "звичайна 150мл ксилолу після того, як остання перемішуваобробка" означає, що, якщо потрібно, додають лася протягом 15 хвилин, та суміш витримують воду, якщо необхідно - доводять рН до значень від при 125°С протягом 12-18 годин під захисним га2 до 10, в залежності від складу кінцевого продукзоподібним азотом. Після охолодження, суміш ту, продукт екстрагують етилацетатом або дихлододають до 500мл 2N соляної кислоти, та тричі рметаном, розділяють фази, органічну фазу супроводять екстракцію водної фази за допомогою шать над сульфатом натрію та випарюють, та 200мл етилацетату. Водну фазу доводять до рН продукт очищають хроматографією на силікагелі 10 за допомогою водного розчину NaOH (20%) при і/чи за допомогою кристалізації. контролі рН та температури (20-25°С), та отримаПриклад 1 ний у виді твердої фази 5-(4-бензил-11) Синтез 5-бромбензофуран-2-карбоксаміду піперазиніл)бензофуран-2-карбоксамід відфільтровують та кристалізують, наприклад, з етанолу/води (вага продукту: 4,0г/64%/т. топл. 277-279°). 3) Синтез 5-(1-піперазиніл)бензофуран-2карбоксаміду 5-(4-бензил-1піперазиніл)бензофуран-2-карбоксаміду Проведення реакції з етилбромацетатом: 200г 5-бром-2-гідроксибензальдегіду розчиняють в 2000мл NMP при перемішуванні, та додають 144г карбонату калію та 175г етилбромацетату. Суміш перемішують при 105° в атмосфері азоту протягом 15 годин. Отриманий жовтогарячий розчин із украпленнями кристалів охолоджують до 25°, додають 135г формаміду, та перемішують суміш ще протягом 30 хвилин. Далі, протягом 15 хвилин вводять 557мл метоксиду натрію (30% у МеОН), без охолодження. Через 3 години маємо коричнюватий розчин із украпленнями кристалів. Його вливають у 6 літрів демінералізованої води (10°), та перемішують суміш ще протягом 30 хвилин. Кристали відфільтровують з відсмоктуванням, промивають у 1 літрі демінералізованої води, повторно суспендують у 4 літрах демінералізованої води, відфіль Спосіб проведення гідрогенолізу: 5,0г 5-(4-бензил-1-піперазиніл)бензофуран-2карбоксаміду додають до 300мл етанолу, а потім вводять у систему 9г паладія на активованому вугіллі (5%) та 5г НОАс (100%), та проводять дебензилювання до кінця при 20-30°С за допомогою водню. В результаті фільтрації та видалення розчинника при зниженому тиску, наступній кристалізації з спирту або води та висушування при 60°С при зниженому тиску, можна виділити продукт (3,1г/85%/т. топл. 252-255°), спектроскопічно іден 13 76944 14 тичний матеріалу, який одержують за описаними при 20-22° за допомогою 20-25мл 32% розчину раніше методиками, у тому числі, у DE гідроокису натрію. Потім продукт відфільтровують 4101686/розкритий 23.7.92; DE 4333254/розкритий та сушать (вага продукту: 0,65г/70%/т. топл. 2526.4.95; ЕР 0648767/опублікований 19.4.95; ЕР 255°). 0738722/опублікований 23.10.96). Приклад 4 Приклад 2 1) Синтез 5-(4-бензилпіперазин-1-іл)-21) Синтез 5-(4-трет-бутоксикарбоніл-1гідроксибензальдегіду піперазиніл)бензофуран-2-карбоксаміду з 5бромбензофуран-2-карбоксаміду 0,9г 5-бромбензофуран-2-карбоксаміду, 1,1г ВОС-піперазину та 1,45г Na t-OBu додають до суспензії 0,06г Pd(DBA)2 та 0,25г P(t-Bu)3 у 40мл диметилового ефіру діетиленгліколю, та суміш витримують при 120-130°С протягом 16 годин в атмосфері захисного газу. Після охолодження, суміш додають до води, органічну фазу розбавляють за допомогою 100мл МТВЕ та тричі промивають у 50мл води. Розчинник випарюють, та продукт, що утворився у виді твердої фази, відфільтровують та очищають кристалізацією з етанолу (вага продукту: 0,7г/55%/т. топл. 210213°). Наступні стадії видалення захисної групи ВОС за допомогою соляної кислоти й одержання 5-(1піперазиніл)бензофуран-2-карбоксаміду, що представлені нижче тільки у виді рівнянь реакцій, можна здійснити за методиками, які описані, наприклад, у [GREENE T.W. та WUTS P.G.M., PROTECTIVE GROUPS IN ORGANIC SYNTHESIS]. Приклад 3 Синтез 5-(1-піперазиніл)бензофуран-2карбоксаміду з 5-бромбензофуран-2-карбоксаміду 0,9г 5-бромбензофуран-2-карбоксаміду, 0,97г піперазину та 2,20г Na t-OBu додають до суспензії 0,06г Pd(DBA)2 та 0,07г 1-(N,N-диметиламіно)-1'(дициклогексилфосфіно)біфенілу в 50мл толуолу, та суміш витримують при 120-130° протягом 16 в атмосфері захисного газу. Після охолодження, реакційну суміш додають до суміші 50мл води та 10мл 37% соляної кислоти, потім додають 100мл етилацетату та перемішують суміш протягом 20 хвилин. Видаляють невелику кількість продукту, який не розчинився, та відокремлюють органічну фазу. Водну фазу ще раз промивають шляхом струшування в 50мл етилацетату та звільняють від залишків розчинника при зниженому тиску, потім очищають за допомогою вугілля та фільтрують. Кристалічний продукт осаджують з фільтрату 0,6г біс(дибензиліденацетон)палладія та 0,16г три-трет-бутилфосфіну додають в атмосфері азоту до 200мл толуолу, та отриманий темночервоний розчин перемішують при 20° протягом 20 хвилин. Потім додають 10г 5-бром-2гідроксибензальдегіду, 9,7г 1-бензилпіперазину та 7,2г трет-бутоксиду натрія. Суміш перемішують при 60° протягом 24 годин, потім охолоджують, додають 800мл води, та двічі екстрагують суміш за допомогою 500мл етилацетату. Органічні фази поєднують та промивають у 300мл води, потім видаляють розчинник - при 30° та при зниженому тиску. Темно-жовтогарячу олію, що залишилася, (9,7г) очищають за допомогою хроматографії (300г силікагелю; МТВ ефір/гептан 5:1; 1,5 літра). Залишається 9,9г світло-жовтих кристалів (67%). т. топл. 101-103°; MS 296 (М+), 205, 119, 91 (100%). 2) Синтез етил 4-(4-бензилпіперазин-1-іл)-2формілфеноксиацетату В атмосфері азоту 0,5г 5-(4-бензилпіперазин1-іл)-2-гідроксибензальдегіду розчиняють у 5мл NMP при 20°С при перемішуванні, потім додають 0,25г карбонату калію та 0,2мл етилбромацетату. Суміш перемішують при 110° протягом 4 годин та охолоджують до 15°, потім до суміші додають 30мл води та 30мл етилацетату, розділяють фази, та водну фазу екстрагують за допомогою 30мл етилацетату. Поєднують органічні фази, двічі промивають їх у 30мл води та звільняють від розчинника при зниженому тиску. Жовту олію, що залишилася, (0,7г) піддають хроматографії на 10г силікагелю (МТВ ефір/гептан 5:1), та одержують 0,45г продукту (70%; жовтувата олія), MS 382 (М+), 296, 263, 199, 149, 119, 91 (100 %). Приклад 5 1) Синтез етил 5-(4-бензилпіперазин-1іл)бензофуран-2-карбоксилату При перемішуванні, 0,5г 5-(4-бензилпіперазин1-іл)-2-гідроксибензальдегіду додають при 20° до 15 76944 16 5мл NMP, потім до розчину додають 0,25г карбодвічі екстрагують суміш за допомогою 500мл етинату калію та 0,2мл етилбромацетату. Суміш пелацетату. Органічні фази поєднують та промиваремішують при 105° протягом 15 годин, потім охоють у 300мл води, потім видаляють розчинник при лоджують до 25°. Отриману порцію додають до 30° та при зниженому тиску. Темно-жовтогарячу 30мл води (10°) при перемішуванні, потім водну олію, що залишилася, (11г) очищають за допомофазу тричі екстрагують при 10° за допомогою гою хроматографії (300г силікагелю; МТВ 50мл етилацетату, поєднують органічні фази, ефір/гептан 5:1; 1-5 літрів); залишається 7,8г світпромивають їх у 50мл води та звільняють від розло-жовтих кристалів (51%), т. топл. 84-86°; MS 306 чинника при зниженому тиску (1,2г жовтогарячої (М+), 250 (100%), 233, 176, 164. олії). За допомогою колоночної хроматографії на 2) Синтез етил 4-(4-трет30г силікагелю (МТВ ефір/гептан 5:1) одержують бутоксикарбонілпіперазин-1-іл)-20,43г світло-жовтих кристалів (71%), т. топл. 105формілфеноксиацетату 107°; MS 364 (М+), 268, 204, 146, 119, 91 (100%). Зразки відповідного гідрохлориду (т. топл. 219222°) можна одержати за допомогою розчинення в етанолі, з наступним додаванням водного розчину 1N соляної кислоти, виділенням отриманої твердої фази та її висушуванням при зниженому тиску. В атмосфері азоту 0,5г 5-(4-третПриклад 6 бутоксипіперазин-1-іл)-2-гідроксибензальдегіду 1) Синтез 5-(4-бензилпіперазин-1розчиняють при перемішуванні в 5мл NMP при іл)бензофуран-2-карбоксаміду 20°, потім додають 0,25г карбонату калію та 0,2мл етилбромацетату. Суміш перемішують при 110° протягом 30 хвилин та охолоджують до 25°. Потім до суміші додають 30мл води та 30мл етилацетату, та розділяють фази, після чого водну фазу екстрагують за допомогою 30мл етилацетату. Органічні фази поєднують та промивають у 30мл води, потім звільняють від розчинника при зниженому При перемішуванні, 500мг 5-(4тиску. До суспензії кристалів, що залишилася, добензилпіперазин-1-іл)-2-гідроксибензальдегіду дають 30мл толуолу, 30мл води та 5мл 1N НСІ, додають при 20° в атмосфері азоту до 5мл NMP, потім толуолову фазу видаляють при зниженому потім до розчину додають 0,25г карбонату калію та тиску, кристалічний осад відокремлюють та при 0,2мл етилбромацетату. Суміш перемішують при 40° сушать при зниженому тиску (0,48г; 75 %), т. 105° протягом 15 годин та охолоджують до 25°. топл. 93-94°С; MS 392 (М+), 336 (100 %), 250/249, Потім до суміші додають 0,2мл формаміду, та пе57. ремішують протягом ще 30 хвилин. Далі при 25° Приклад 8 протягом 15 хвилин додають 1мл метоксиду на1) Синтез етил 5-(4-треттрію (30% розчин у метанолі), після чого суміш бутоксикарбонілпіперазин-1-іл)бензофуран-2перемішують при 25-30° ще протягом 3 годин. Покарбоксилату тім реакційну суміш вливають у ЗО мл води (10°), тричі екстрагують водну фазу при 10° за допомогою 50 мл етилацетату, поєднують органічні фази, промивають їх у 50мл води, та видаляють розчинник при зниженому тиску (0,7г жовтогарячої олії). Роблять рекристалізацію олії з 10мл толуолу (375мг світло-жовтих кристалів; 66%), т. топл. 206208°; MS 335 (М+), 244, 189, 146,91 (100%). 520мг 5-(4-трет-бутоксикарбонілпіперазин-1Після видалення захисних груп одержують 5іл)-2-гідроксибензальдегіду додають при 20° в ат(1-піперазиніл)бензофуран-2-карбоксамід. мосфері азоту при перемішуванні до 5мл NMP, Приклад 7 потім до розчину додають 0,25г карбонату калію та 1) Синтез 5-(4-трет-бутоксикарбонілпіперазин0,2мл етилбромацетату. Суміш перемішують при 1-іл)-2-гідроксибензальдегіду 105° протягом 3 годин, потім охолоджують до 25°. Отриману порцію додають до 30мл води (10)° при перемішуванні, водну фазу тричі екстрагують при 10° за допомогою 30мл етилацетату, органічні фази поєднують та промивають спочатку в 30мл насиченого розчину NaCI, потім у 30мл води та зві0,58г біс(дибензиліденацетон)палладія та льняють від розчинника при зниженому тиску (0,6г 0,16г три-трет-бутилфосфіну додають в атмосфері жовтогарячої олії з кристалічними компонентами). азоту до 200мл толуолу, та отриманий розчин, що Після хроматографії на 30г силікагелю (МТВ набуває темно-червоного кольору, перемішують ефір/гептан 5:1), можна виділити 0,45г світлопри 20° протягом 30 хвилин. Потім додають 10г 5жовтих кристалів (70%), т. топл. 116-117°; MS 374 бром-2-гідроксибензальдегіду, 10,2г трет-бутил 1(М+), 318 (100%), 244, 232. піперазинкарбоксилату та 7,2г трет-бутоксиду наПриклад 9 трію. Суміш перемішують при 60° протягом 24 го1) Синтез 5-(4-трет-бутоксикарбонілпіперазиндин та охолоджують, потім додають 800мл води та 1-іл)-бензофуран-2-карбоксаміду 17 76944 18 (М+), 289 (100 %), 272, 244, 215,203. Після видалення групи ВОС по вже описаному способу, одержують 5-(1-піперазиніл)бензофуран2-карбоксамід. Приклад 10 1) Синтез 5-(4-трет-бутоксикарбонілпіперазин1-іл)-бензофуран-2-карбоксаміду При 20° 1,04г 5-(4-трет5мл 1-метил-2-піролідону, 0,16г хлорацетаміду бутоксикарбонілпіперазин-1-іл)-2та 0,25г карбонату калію при 20°С додають при гідроксибензальдегіду в атмосфері азоту при пеперемішуванні в атмосфері азоту до 0,5г 5-(4-третремішуванні додають до 10мл NMP, потім до розбутоксикарбонілпіперазин-1-іл)-2чину додають та 0,5г карбонату калію та 0,4мл гідробензальдегіду. Суміш перемішують при 60°С етилбромацетату. Суміш перемішують при 120° протягом 16 годин, охолоджують, та потім фільтпротягом 5 годин та охолоджують до 25°. Потім до рують, після чого видаляють розчинник при знисуміші додають 0,4мл формаміду, та продовжують женому тиску. Залишок поміщають у МТВ ефір, перемішувати протягом ще 30 хвилин. Потім проповторно фільтрують та концентрують, потім затягом 15 хвилин, без охолодження, додають 1,9мл лишок кристалізують з толуолу. Вихід виділеного метоксиду натрію (30% розчин у метанолі), та продукту складає 0,34г (60%). продовжують перемішування ще протягом години 2) Синтез 5-(4-бензилпіперазин-1при 25-30°. До цієї партії додають 30мл води та іл)бензофуран-2-карбоксаміду 30мл етилацетату, розділяють фази, та водну фа10мл 1-метил-2-піролідону, 0,4г хлорацетаміду зу екстрагують за допомогою 30мл етилацетату. та 0,8г карбонату калію додають при 20°С при пеОрганічні фази поєднують, промивають у 30мл ремішуванні в атмосфері азоту до 1,0г 5-(4води, та видаляють розчинник при зниженому тисбензилпіперазин-1-іл)-2-гідроксибензальдегіду. ку (1,1г жовтогарячої кристалічної суспензії). Після Суміш перемішують при 60° протягом 16 годин, кристалізації з застосуванням 20мл толуолу, заохолоджують, потім фільтрують, після чого видалишається 500мг світло-бежевих кристалів. Матоляють розчинник при зниженому тиску. Залишок чний розчин випарюють, та олію, яка залишилася, поміщають у МТВ ефір, повторно фільтрують та розчиняють у 10мл толуолу. Після 3 годин при 0°, концентрують, потім залишок кристалізують з тоутворюються нові світло-бежеві кристали (ідентичлуолу. Вихід виділеного продукту складає 0,73г ні з першими кристалами; 70мг). Сумарний вихід (65%). (0,57г) складає 49%, т. топл. 202-204°, MS 345 Комп’ютерна верстка О. Гапоненко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for producing 5-(1-piperazinyl)-benzofuran-2-carboxamide (variants) and an intermediary compound
Назва патенту російськоюСпособ получения 5-(1-пиперазинил)бензофуран-2-карбоксамида (варианты) и промежуточное соединение
МПК / Мітки
МПК: C07D 295/205, C07D 295/08, C07B 61/00, C07D 307/85, C07D 295/112
Мітки: проміжна, 5-(1-піперазиніл)бензофуран-2-карбоксаміду, спосіб, одержання, варіанти, сполука
Код посилання
<a href="https://ua.patents.su/9-76944-sposib-oderzhannya-5-1-piperazinilbenzofuran-2-karboksamidu-varianti-ta-promizhna-spoluka.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 5-(1-піперазиніл)бензофуран-2-карбоксаміду (варіанти) та проміжна сполука</a>
Попередній патент: Форма для машини, що формує скляні вироби
Наступний патент: Спосіб лікування хворих на пізній та ранній прихований сифіліс
Випадковий патент: Система розсувних дверей "браун"













