Похідні бензімідазолу, корисні у лікуванні розладів, пов’язаних з рецептором trpvl
Формула / Реферат
1. Сполука формули І:
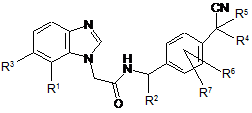 , I
, I
в якій:
R1 вибрана з CN, галогену або С(=О)СН3;
R2 вибрана з метилу або Н;
R3 вибрана з Н або галогену;
кожна з R4, R5 незалежно вибрана з метилу або етилу, або R4 і R5 разом з атомом карбону, до якого вони приєднані, утворюють 3-6-членний циклоалкіл або 5- або 6-членну гетероциклоалкільну групу;
кожна з R6, R7 незалежно вибрана з Н, галогену, метилу або етилу;
або її фармацевтично прийнятна сіль;
причому сполука формули І не належить до групи, яку складають:
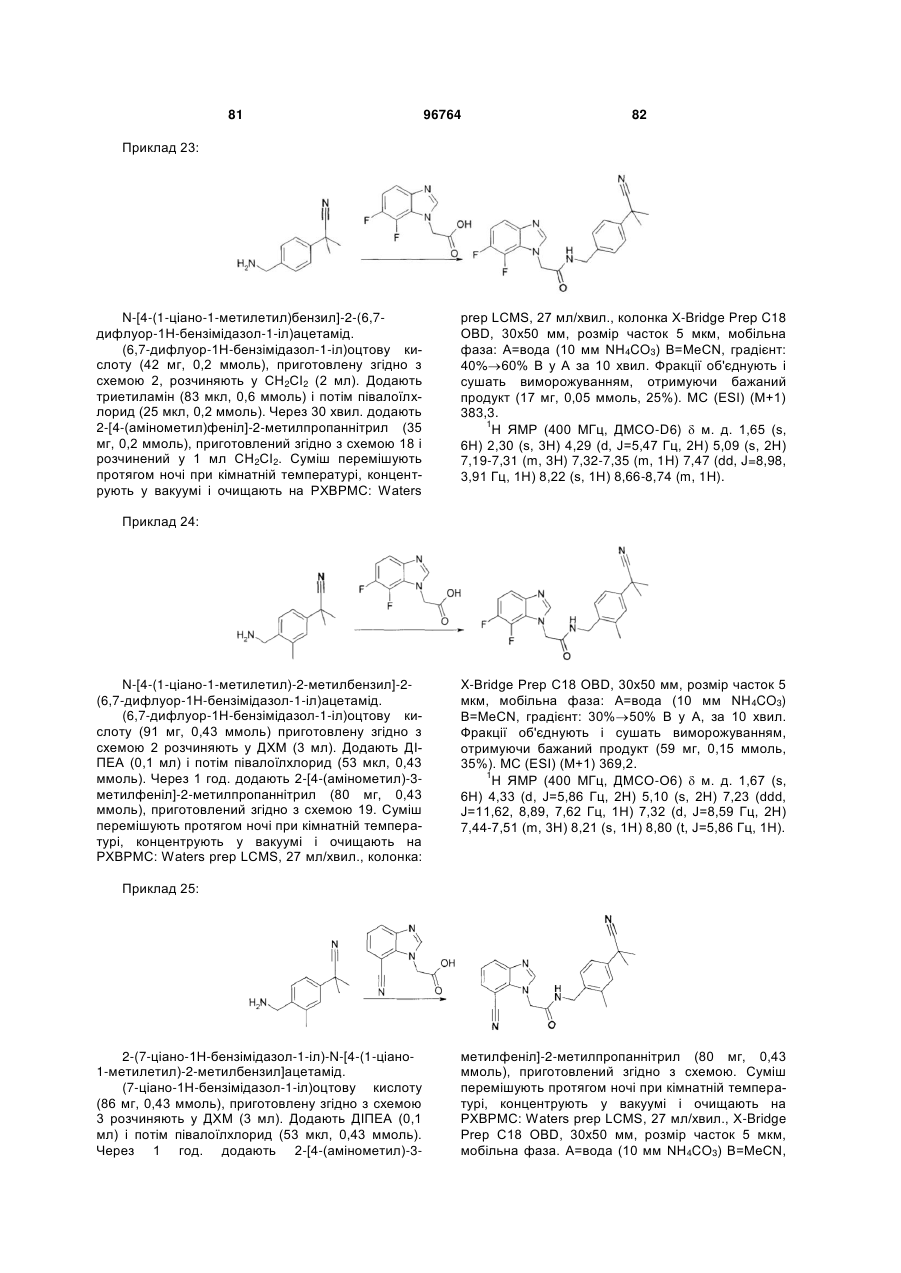
N-[4-(1-ціано-1-метилетил)бензил]-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)-ацетамід;
2-(7-хлор-1Н-бензімідазол-1-іл)-N-[4-(1-ціано-1-метилетил)-3-флуорбензил]ацетамід;
(+)-2-(7-ціано-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціаноциклогексил)феніл]етил}ацетамід;
(+)-N-{1-[4-(1-ціано-1-метилетил)-2-метилфеніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід;
(+,-)-2-(6-хлор-7-флуор-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)-2-метилфеніл]етил}ацетамід;
(+)-2-(7-ацетил-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-ацетамід;
(+)-N-{1-[4-(1-ціаноциклогексил)феніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід;
(+)-2-(7-хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)-3-флуорфеніл]етил}ацетамід;
(+)-N-{1-[4-(1-ціано-1-метилетил)-3-флуорфеніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід;
(+)-N-{1-[4-(1-ціаноциклобутил)феніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід;
(R)(+)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід;
(R)(+)-2-(7-ціано-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-ацетамід;
(+)-2-(7-ціано-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)-3-флуорфеніл]-етил}ацетамід;
(+)-2-(7-ацетил-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)-3-флуорфеніл]-етил}ацетамід;
(R)(+)-N-{1-[4-(1-ціано-1-етилпропіл)феніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід.
2. Сполука за п. 1 або її фармацевтично прийнятна сіль, яка відрізняється тим, що R1 незалежно вибрана з хлору або флуору.
3. Сполука за п. 1 або її фармацевтично прийнятна сіль, яка відрізняється тим, що R3 незалежно вибрана з хлору або флуору.
4. Сполука за п. 2 або її фармацевтично прийнятна сіль, яка відрізняється тим, що R3 незалежно вибрана з хлору або флуору.
5. Сполука за п. 1 або її фармацевтично прийнятна сіль, яка відрізняється тим, що R4 і R5 незалежно вибрані з метилу або етилу.
6. Сполука за п. 2 або її фармацевтично прийнятна сіль, яка відрізняється тим, що R4 і R5 незалежно вибрані з метилу або етилу.
7. Сполука за п. 3 або її фармацевтично прийнятна сіль, яка відрізняється тим, що R4 і R5 незалежно вибрані з метилу або етилу.
8. Сполука за п. 4 або її фармацевтично прийнятна сіль, яка відрізняється тим, що R4 і R5 незалежно вибрані з метилу або етилу.
9. Сполука за п. 1 або її фармацевтично прийнятна сіль, яка відрізняється тим, що R4 і R5 разом з атомом карбону, до якого вони приєднані, утворюють 3-, 4- або 6-членний циклоалкіл або 5- або 6-членну гетероциклоалкільну групу.
10. Сполука за п. 2 або її фармацевтично прийнятна сіль, яка відрізняється тим, що R4 і R5 разом з атомом карбону, до якого вони приєднані, утворюють 3-, 4- або 6-членний циклоалкіл або 5- або 6-членну гетероциклоалкільну групу.
11. Сполука за п. 3 або її фармацевтично прийнятна сіль, яка відрізняється тим, що R4 і R5 разом з атомом карбону, до якого вони приєднані, утворюють 3-, 4- або 6-членний циклоалкіл або 5- або 6-членну гетероциклоалкільну групу.
12. Сполука за п. 4 або її фармацевтично прийнятна сіль, яка відрізняється тим, що R4 і R5 разом з атомом карбону, до якого вони приєднані, утворюють 3-, 4- або 6-членний циклоалкіл або 5- або 6-членну гетероциклоалкільну групу.
13. Сполука за п. 1 або її фармацевтично прийнятна сіль, яка відрізняється тим, що кожна з R6, R7 незалежно вибрана з флуору або хлору.
14. Сполука за п. 1 або її фармацевтично прийнятна сіль, яка відрізняється тим, що кожна з R6, R7 незалежно є Н.
15. Сполука за п. 2 або її фармацевтично прийнятна сіль, яка відрізняється тим, що кожна з R6, R7 незалежно є Н.
16. Сполука за п. 3 або її фармацевтично прийнятна сіль, яка відрізняється тим, що кожна з R6, R7 незалежно є Н.
17. Сполука за п. 4 або її фармацевтично прийнятна сіль, яка відрізняється тим, що кожна з R6, R7 незалежно є Н.
18. Сполука за п. 5 або її фармацевтично прийнятна сіль, яка відрізняється тим, що кожна з R6, R7 незалежно є Н.
19. Сполука за п. 6 або її фармацевтично прийнятна сіль, яка відрізняється тим, що кожна з R6, R7 незалежно є Н.
20. Сполука за п. 7 або її фармацевтично прийнятна сіль, яка відрізняється тим, що кожна з R6, R7 незалежно є Н.
21. Сполука за п. 8 або її фармацевтично прийнятна сіль, яка відрізняється тим, що кожна з R6, R7 незалежно є Н.
22. Сполука за п. 9 або її фармацевтично прийнятна сіль, яка відрізняється тим, що кожна з R6, R7 незалежно є Н.
23. Сполука за п. 10 або її фармацевтично прийнятна сіль, яка відрізняється тим, що кожна з R6, R7 незалежно є Н.
24. Сполука за п. 11 або її фармацевтично прийнятна сіль, яка відрізняється тим, що кожна з R6, R7 незалежно є Н.
25. Сполука за п. 12 або її фармацевтично прийнятна сіль, яка відрізняється тим, що кожна з R6, R7 незалежно є Н.
26. Сполука, вибрана з групи, яку складають:
(S)(-)-2-(7-ціано-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-ацетамід;
(S)(-)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-2-(7-флуор-1Н-бензімідазол-1-іл)ацетамід;
(S)(-)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-2-(7-хлор-1Н-бензімідазол-1-іл)ацетамід;
(S)(-)-N-{1-[4-(1-ціано-1-етилпропіл)феніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід;
(-)-N-{1-[4-(1-ціаноциклобутил)феніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід;
(-)-N-{1-[4-(1-ціаноциклогексил)феніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід;
(-)-2-(7-ціано-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціаноциклогексил)феніл]етил}ацетамід;
(-)-2-(7-ціано-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціаноциклобутил)феніл]етил}ацетамід;
(-)-2-(7-ацетил-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-ацетамід;
(S)(-)-2-(7-ацетил-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)-3-флуорфеніл]-етил}ацетамід;
(-)-N-{1-[4-(1-ціано-1-метилетил)-3-флуорфеніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід;
(-)-2-(7-хлор-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)-3-флуорфеніл]-етил}ацетамід;
(-)-2-(7-ціано-1Н-бензімідазол-1-іл)-N-[4-(1-ціано-1-метилетил)-3-флуорбензил]-ацетамід;
(-)-2-(7-хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)-3-флуорфеніл]етил}ацетамід;
(-)-2-(7-хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)-3-метилфеніл]етил}ацетамід;
(-)-2-(7-хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)-3-метилфеніл]етил}ацетамід;
(-)-N-{1-[4-(4-ціанотетрагідро-2Н-тіопіран-4-іл)-2-метилфеніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід;
(-)-N-{1-[4-(1-ціано-1-метилетил)-2-метилфеніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід;
(-)-N-{1-[4-(1-ціано-1-метилетил)-2-метилфеніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід;
(-)-N-{1-[4-(1-ціано-1-метилетил)-2-метилфеніл]етил}-2-(7-флуор-1Н-бензімідазол-1-іл)ацетамід;
(-)-N-{1-[3-хлор-4-(1-ціано-1-метилетил)феніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід;
(-)-N-{1-[3-хлор-4-(1-ціано-1-метилетил)феніл]етил}-2-(7-ціано-1Н-бензімідазол-1-іл)ацетамід;
(-)-2-(7,6-дифлуор-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)-3-метилфеніл]-етил}ацетамід;
(-)-2-(7-ціано-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)-3-метилфеніл]-етил}ацетамід;
(S)(-)-2-(6-хлор-7-флуор-1Н-бензімідазол-1-іл)-N-{[4-(1-ціано-1-метилетил)феніл]-етил}ацетамід;
або її фармацевтично прийнятна сіль.
27. Сполука, вибрана з групи, яку складають:
(+,-)-2-(7-ціано-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-ацетамід;
(+,-)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід;
(+,-)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-2-(7-флуор-1Н-бензімідазол-1-іл)ацетамід;
(+,-)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-2-(7-хлор-1Н-бензімідазол-1-іл)ацетамід;
(+,-)-N-{1-[4-(1-ціано-1-етилпропіл)феніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід;
(+,-)-N-{1-[4-(1-ціаноциклобутил)феніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід;
(+,-)-N-{1-[4-(1-ціаноциклогексил)феніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід;
(+,-)-2-(7-ціано-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціаноциклогексил)феніл]етил}-ацетамід;
(+,-)-2-(7-ціано-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціаноциклопропіл)феніл]етил}-ацетамід;
(+,-)-2-(7-ціано-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціаноциклобутил)феніл]етил}ацетамід;
(+,-)-2-(7-ацетил-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-ацетамід;
(+,-)-2-(7-ацетил-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)-3-флуорфеніл]-етил}ацетамід;
(+,-)-2-(7-ціано-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)-3-флуорфеніл]-етил}ацетамід;
(+,-)-2-(7-хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)феніл]-етил}ацетамід;
(+,-)-2-(7-хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)-3-флуорфеніл]етил}ацетамід;
(+,-)-2-(7-хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)-3-метилфеніл]етил}ацетамід;
(+,-)-2-(7-хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)-3-метилфеніл]етил}ацетамід;
(+,-)-N-{1-[4-(4-ціанотетрагідро-2Н-тіопіран-4-іл)-2-метилфеніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід;
N-[4-(1-ціано-1-метилетил)-2-метилбензил]-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід;
2-(7-ціано-1Н-бензімідазол-1-іл)-N-[4-(1-ціано-1-метилетил)-2-метилбензил]ацетамід;
(+,-)-N-{1-[4-(1-ціано-1-метилетил)-2-метилфеніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід;
(+,-)-N-{1-[4-(1-ціано-1-метилетил)-2-метилфеніл]етил}-2-(7-флуор-1Н-бензімідазол-1-іл)ацетамід;
(+,-)-N-{1-[3-хлор-4-(1-ціано-1-метилетил)феніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід;
(+,-)-N-{1-[3-хлор-4-(1-ціано-1-метилетил)феніл]етил}-2-(7-ціано-1Н-бензімідазол-1-іл)ацетамід;
(+,-)-2-(7,6-дифлуор-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)-3-метилфеніл]етил}ацетамід;
(+,-)-2-(7-ціано-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)-3-метилфеніл]етил}ацетамід;
2-(6-хлор-7-флуор-1Н-бензімідазол-1-іл)-N-{[4-(1-ціано-1-метилетил)-2-метилбензил]ацетамід;
або її фармацевтично прийнятна сіль.
28. Сполука (S)(-)-2-(7-хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}ацетамід або її фармацевтично прийнятна сіль.
29. Сполука (S)(-)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід або її фармацевтично прийнятна сіль.
30. Сполука за п. 1, призначена для використання у лікуванні ноцицептичних больових розладів у ссавця.
31. Сполука за п. 1, призначена для використання у лікуванні хронічних ноцицептичних больових розладів у ссавця.
32. Сполука за п. 1 або її фармацевтично прийнятна сіль, призначена для використання у лікуванні остеоартриту.
33. Сполука за п. 1 або її фармацевтично прийнятна сіль, призначена для використання у лікуванні тендиніту.
34. Сполука за п. 1 або її фармацевтично прийнятна сіль, призначена для використання у лікуванні хронічного тендиніту.
35. Сполука за п. 1 або її фармацевтично прийнятна сіль, призначена для використання у лікуванні тазового болю.
36. Сполука за п. 1 або її фармацевтично прийнятна сіль, призначена для використання у лікуванні периферійної нейропатії (головним чином PHN).
37. Сполука за п. 1 або її фармацевтично прийнятна сіль, призначена для використання у лікуванні шлунково-стравохідного рефлюксу (GERD).
38. Сполука за п. 1 або її фармацевтично прийнятна сіль, призначена для використання у лікуванні синдрому подразнення кишечнику (IBS).
39. Сполука за п. 1 або її фармацевтично прийнятна сіль, призначена для використання у лікуванні гіперактивності сечового міхура.
40. Спосіб лікування ноцицептичних больових розладів, який включає введення ефективної кількості сполуки за п. 1 або її фармацевтично прийнятної солі пацієнту, що потребує цього.
41. Спосіб лікування ноцицептичних больових розладів, який включає введення ефективної кількості сполуки (S)(-)-2-(7-хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього.
42. Спосіб лікування ноцицептичних больових розладів, який включає введення ефективної кількості сполуки (S)(-)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього.
43. Спосіб лікування хронічних ноцицептичних больових розладів, який включає введення ефективної кількості сполуки за п. 1 або її фармацевтично прийнятної солі пацієнту, що потребує цього.
44. Спосіб лікування хронічних ноцицептичних больових розладів, який включає введення ефективної кількості сполуки (S)(-)-2-(7-хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього.
45. Спосіб лікування хронічних ноцицептичних больових розладів, який включає введення ефективної кількості сполуки (S)(-)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього.
46. Спосіб лікування остеоартриту, який включає введення ефективної кількості сполуки за п. 1 або її фармацевтично прийнятної солі пацієнту, що потребує цього.
47. Спосіб лікування остеоартриту, який включає введення ефективної кількості сполуки (S)(-)-2-(7-хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)феніл]-етил}ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього.
48. Спосіб лікування остеоартриту, який включає введення ефективної кількості сполуки (S)(-)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього.
49. Спосіб лікування тендиніту, який включає введення ефективної кількості сполуки за п. 1 або її фармацевтично прийнятної солі пацієнту, що потребує цього.
50. Спосіб лікування тендиніту, який включає введення ефективної кількості сполуки (S)(-)-2-(7-хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)феніл]-етил}ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього.
51. Спосіб лікування тендиніту, який включає введення ефективної кількості сполуки (S)(-)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього.
52. Спосіб лікування хронічного тендиніту, який включає введення ефективної кількості сполуки за п. 1 або її фармацевтично прийнятної солі пацієнту, що потребує цього.
53. Спосіб лікування хронічного тендиніту, який включає введення ефективної кількості сполуки (S)(-)-2-(7-хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)-феніл]-етил}ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього.
54. Спосіб лікування хронічного тендиніту, який включає введення ефективної кількості сполуки (S)(-)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього.
55. Спосіб лікування тазового болю, який включає введення ефективної кількості сполуки за п. 1 або її фармацевтично прийнятної солі пацієнту, що потребує цього.
56. Спосіб лікування тазового болю, який включає введення ефективної кількості сполуки (S)(-)-2-(7-хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)феніл]-етил}ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього.
57. Спосіб лікування тазового болю, який включає введення ефективної кількості сполуки (S)(-)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього.
58. Спосіб лікування периферійної нейропатії (головним чином PHN), який включає введення ефективної кількості сполуки за п. 1 або її фармацевтично прийнятної солі пацієнту, що потребує цього.
59. Спосіб лікування периферійної нейропатії (головним чином PHN), який включає введення ефективної кількості сполуки (S)(-)-2-(7-хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)феніл]-етил}ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього.
60. Спосіб лікування периферійної нейропатії (головним чином PHN), який включає введення ефективної кількості сполуки (S)(-)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього.
61. Фармацевтична композиція, яка містить сполуку за п. 1 або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій.
62. Фармацевтична композиція, яка містить сполуку (S)(-)-2-(7-хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}ацетамід або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій.
63. Фармацевтична композиція, яка містить сполуку (S)(-)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій.
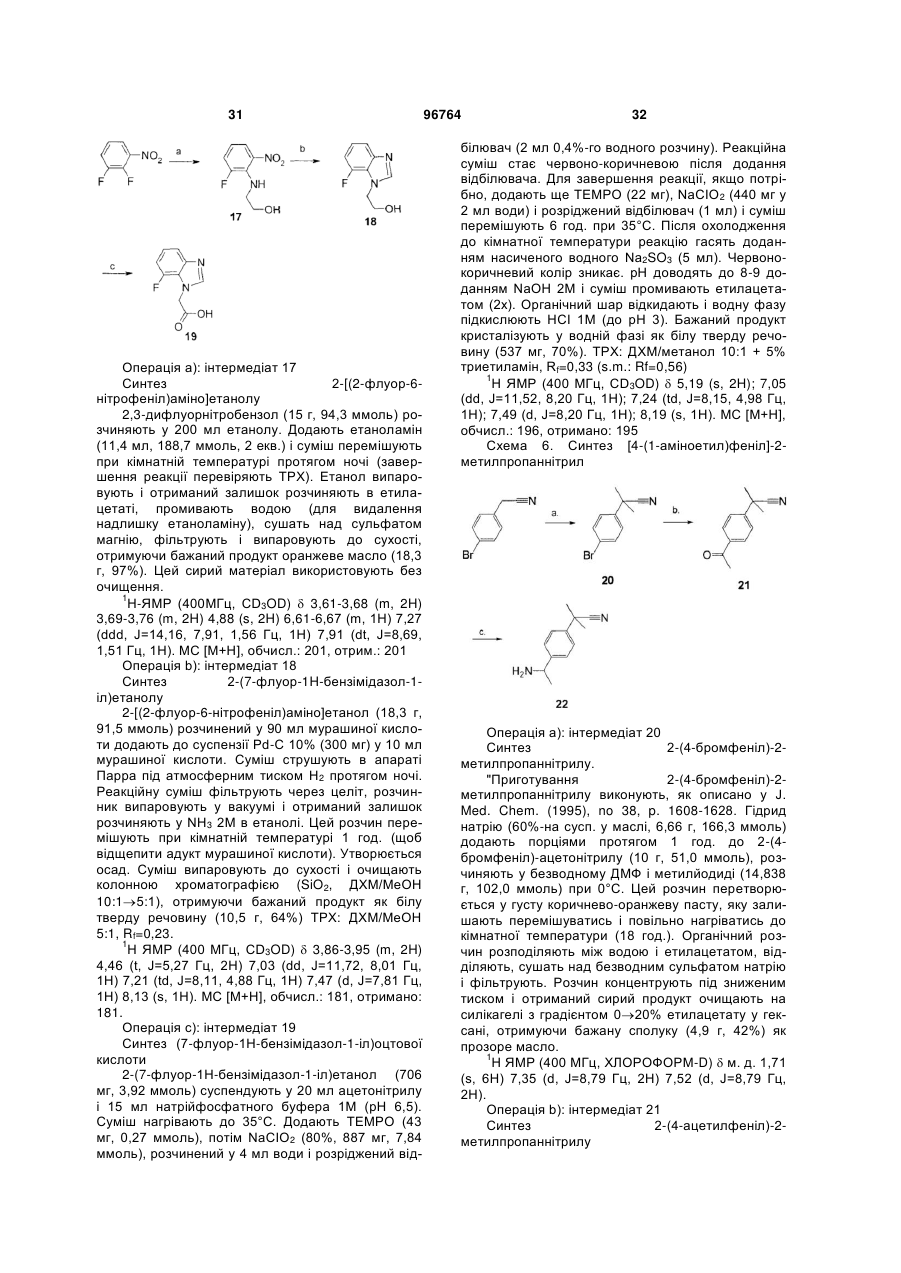
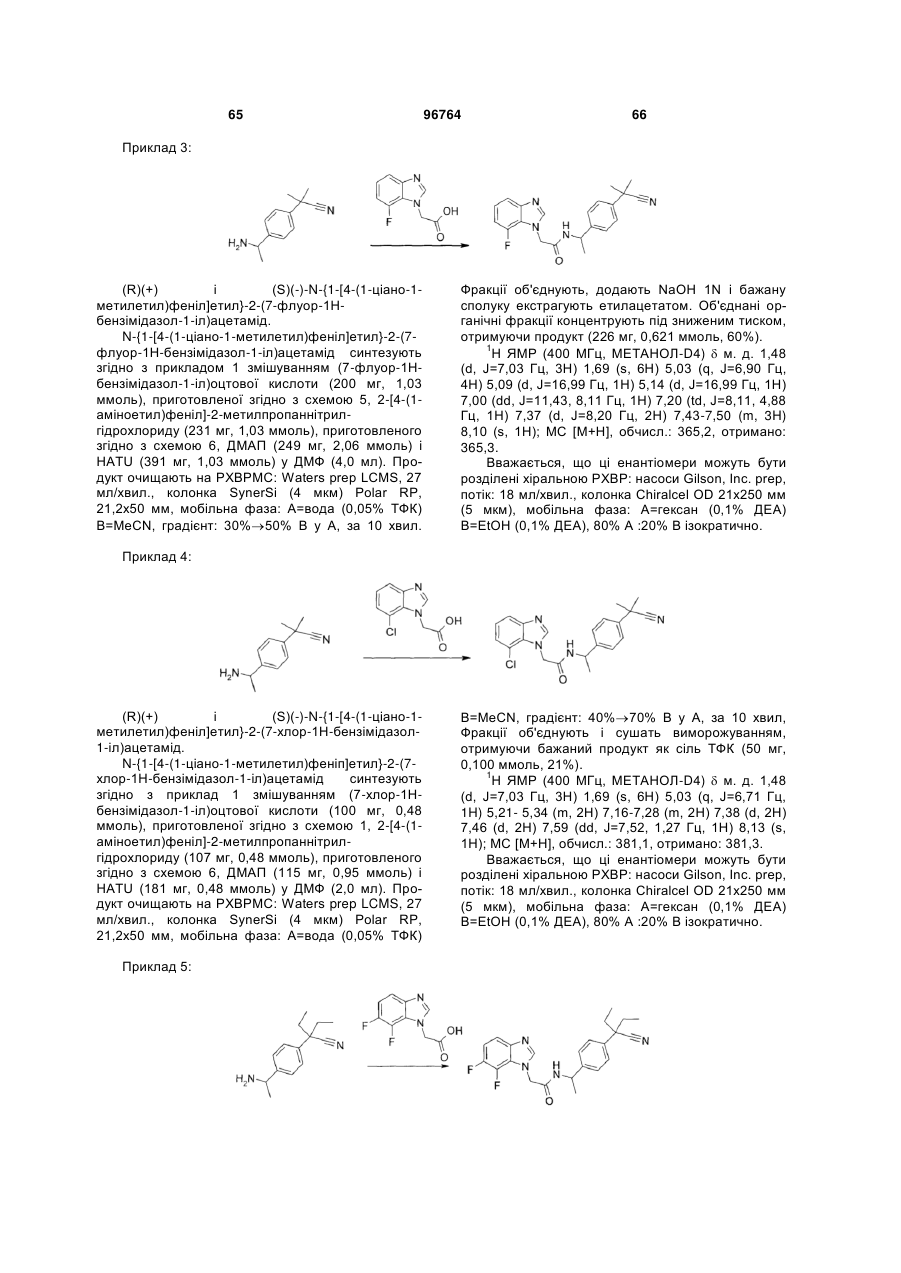
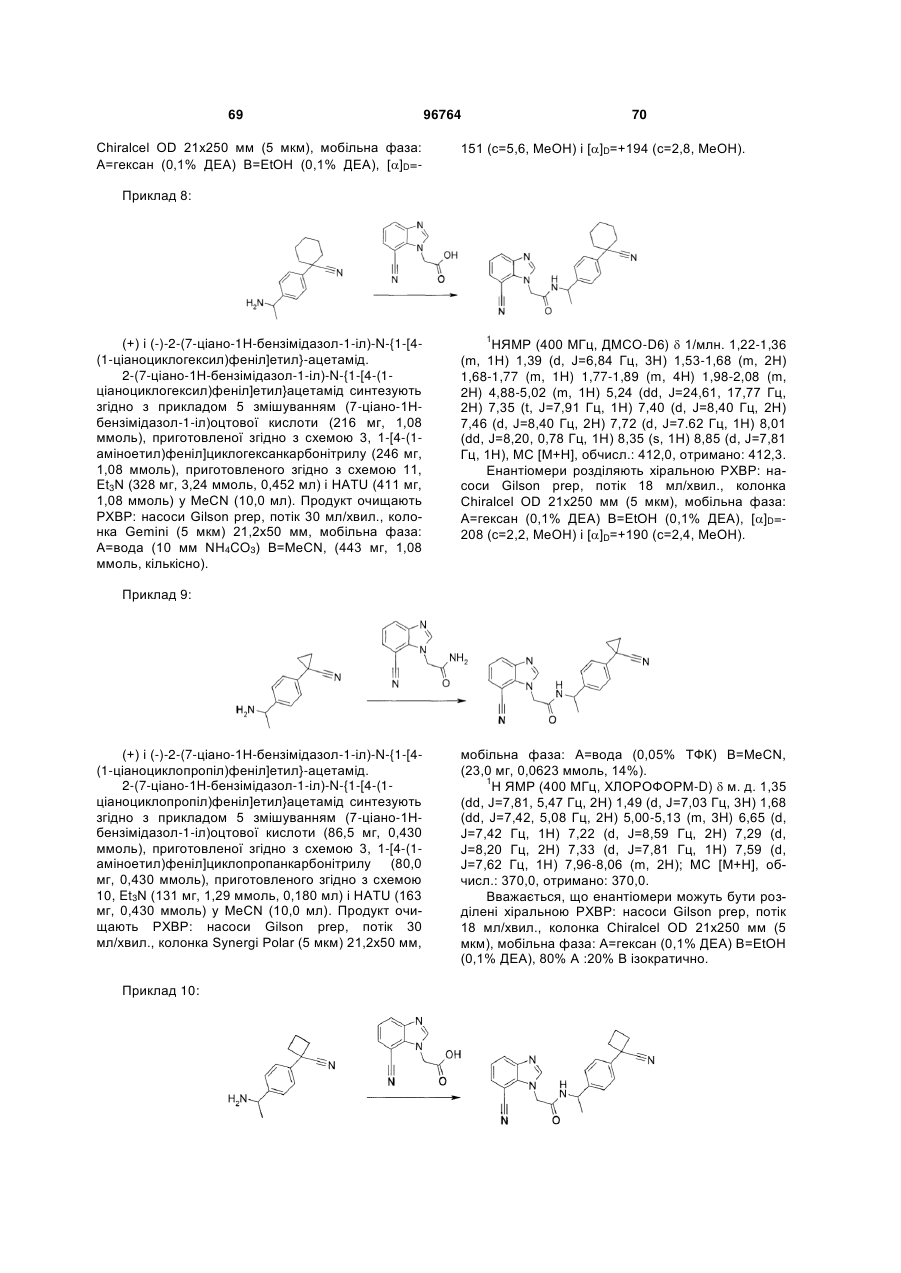
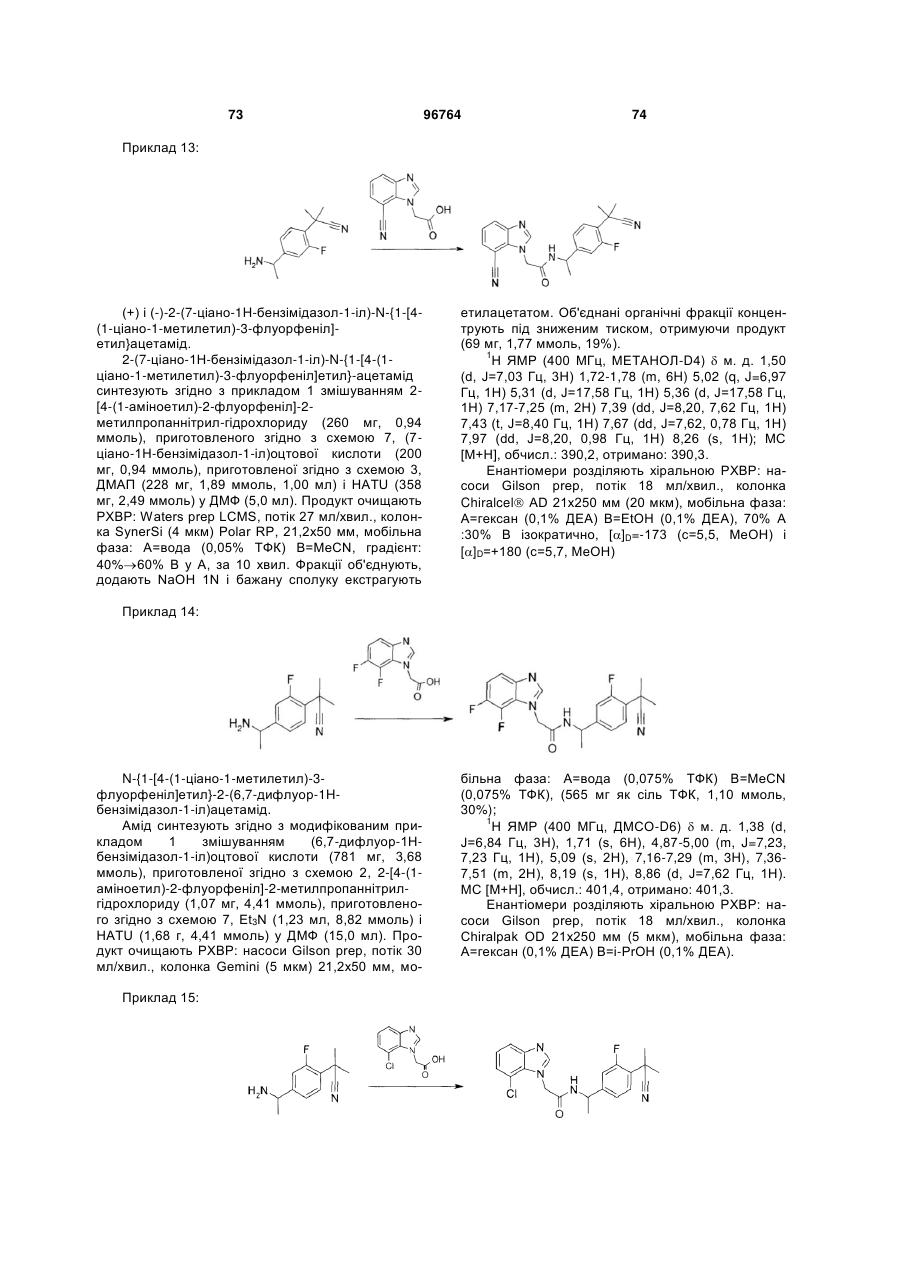
Текст
1. Сполука формули І: CN R5 N R4 N H R3 N R6 R1 R7 R2 O ,I в якій: 1 R вибрана з CN, галогену або С(=О)СН3; 2 R вибрана з метилу або Н; 3 R вибрана з Н або галогену; 4 5 кожна з R , R незалежно вибрана з метилу або 4 5 етилу, або R і R разом з атомом карбону, до якого вони приєднані, утворюють 3-6-членний циклоалкіл або 5- або 6-членну гетероциклоалкільну групу; 6 7 кожна з R , R незалежно вибрана з Н, галогену, метилу або етилу; або її фармацевтично прийнятна сіль; причому сполука формули І не належить до групи, яку складають: N-[4-(1-ціано-1-метилетил)бензил]-2-(6,7-дифлуор1Н-бензімідазол-1-іл)-ацетамід; 2 (19) 1 3 4. Сполука за п. 2 або її фармацевтично прийнят3 на сіль, яка відрізняється тим, що R незалежно вибрана з хлору або флуору. 5. Сполука за п. 1 або її фармацевтично прийнят4 5 на сіль, яка відрізняється тим, що R і R незалежно вибрані з метилу або етилу. 6. Сполука за п. 2 або її фармацевтично прийнят4 5 на сіль, яка відрізняється тим, що R і R незалежно вибрані з метилу або етилу. 7. Сполука за п. 3 або її фармацевтично прийнят4 5 на сіль, яка відрізняється тим, що R і R незалежно вибрані з метилу або етилу. 8. Сполука за п. 4 або її фармацевтично прийнят4 5 на сіль, яка відрізняється тим, що R і R незалежно вибрані з метилу або етилу. 9. Сполука за п. 1 або її фармацевтично прийнят4 5 на сіль, яка відрізняється тим, що R і R разом з атомом карбону, до якого вони приєднані, утворюють 3-, 4- або 6-членний циклоалкіл або 5- або 6-членну гетероциклоалкільну групу. 10. Сполука за п. 2 або її фармацевтично прийня4 5 тна сіль, яка відрізняється тим, що R і R разом з атомом карбону, до якого вони приєднані, утворюють 3-, 4- або 6-членний циклоалкіл або 5- або 6-членну гетероциклоалкільну групу. 11. Сполука за п. 3 або її фармацевтично прийня4 5 тна сіль, яка відрізняється тим, що R і R разом з атомом карбону, до якого вони приєднані, утворюють 3-, 4- або 6-членний циклоалкіл або 5- або 6-членну гетероциклоалкільну групу. 12. Сполука за п. 4 або її фармацевтично прийня4 5 тна сіль, яка відрізняється тим, що R і R разом з атомом карбону, до якого вони приєднані, утворюють 3-, 4- або 6-членний циклоалкіл або 5- або 6-членну гетероциклоалкільну групу. 13. Сполука за п. 1 або її фармацевтично прийня6 7 тна сіль, яка відрізняється тим, що кожна з R , R незалежно вибрана з флуору або хлору. 14. Сполука за п. 1 або її фармацевтично прийня6 7 тна сіль, яка відрізняється тим, що кожна з R , R незалежно є Н. 15. Сполука за п. 2 або її фармацевтично прийня6 7 тна сіль, яка відрізняється тим, що кожна з R , R незалежно є Н. 16. Сполука за п. 3 або її фармацевтично прийня6 7 тна сіль, яка відрізняється тим, що кожна з R , R незалежно є Н. 17. Сполука за п. 4 або її фармацевтично прийня6 7 тна сіль, яка відрізняється тим, що кожна з R , R незалежно є Н. 18. Сполука за п. 5 або її фармацевтично прийня6 7 тна сіль, яка відрізняється тим, що кожна з R , R незалежно є Н. 19. Сполука за п. 6 або її фармацевтично прийня6 7 тна сіль, яка відрізняється тим, що кожна з R , R незалежно є Н. 20. Сполука за п. 7 або її фармацевтично прийня6 7 тна сіль, яка відрізняється тим, що кожна з R , R незалежно є Н. 21. Сполука за п. 8 або її фармацевтично прийня6 7 тна сіль, яка відрізняється тим, що кожна з R , R незалежно є Н. 22. Сполука за п. 9 або її фармацевтично прийня6 7 тна сіль, яка відрізняється тим, що кожна з R , R незалежно є Н. 96764 4 23. Сполука за п. 10 або її фармацевтично прийн6 ятна сіль, яка відрізняється тим, що кожна з R , 7 R незалежно є Н. 24. Сполука за п. 11 або її фармацевтично прийн6 ятна сіль, яка відрізняється тим, що кожна з R , 7 R незалежно є Н. 25. Сполука за п. 12 або її фармацевтично прийн6 ятна сіль, яка відрізняється тим, що кожна з R , 7 R незалежно є Н. 26. Сполука, вибрана з групи, яку складають: (S)(-)-2-(7-ціано-1Н-бензімідазол-1-іл)-N-{1-[4-(1ціано-1-метилетил)феніл]етил}-ацетамід; (S)(-)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-2(7-флуор-1Н-бензімідазол-1-іл)ацетамід; (S)(-)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-2(7-хлор-1Н-бензімідазол-1-іл)ацетамід; (S)(-)-N-{1-[4-(1-ціано-1-етилпропіл)феніл]етил}-2(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід; (-)-N-{1-[4-(1-ціаноциклобутил)феніл]етил}-2-(6,7дифлуор-1Н-бензімідазол-1-іл)ацетамід; (-)-N-{1-[4-(1-ціаноциклогексил)феніл]етил}-2-(6,7дифлуор-1Н-бензімідазол-1-іл)ацетамід; (-)-2-(7-ціано-1Н-бензімідазол-1-іл)-N-{1-[4-(1ціаноциклогексил)феніл]етил}ацетамід; (-)-2-(7-ціано-1Н-бензімідазол-1-іл)-N-{1-[4-(1ціаноциклобутил)феніл]етил}ацетамід; (-)-2-(7-ацетил-1Н-бензімідазол-1-іл)-N-{1-[4-(1ціано-1-метилетил)феніл]етил}-ацетамід; (S)(-)-2-(7-ацетил-1Н-бензімідазол-1-іл)-N-{1-[4-(1ціано-1-метилетил)-3-флуорфеніл]-етил}ацетамід; (-)-N-{1-[4-(1-ціано-1-метилетил)-3флуорфеніл]етил}-2-(6,7-дифлуор-1Нбензімідазол-1-іл)ацетамід; (-)-2-(7-хлор-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано1-метилетил)-3-флуорфеніл]-етил}ацетамід; (-)-2-(7-ціано-1Н-бензімідазол-1-іл)-N-[4-(1-ціано-1метилетил)-3-флуорбензил]-ацетамід; (-)-2-(7-хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1[4-(1-ціано-1-метилетил)-3флуорфеніл]етил}ацетамід; (-)-2-(7-хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1[4-(1-ціано-1-метилетил)-3метилфеніл]етил}ацетамід; (-)-2-(7-хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1[4-(1-ціано-1-метилетил)-3метилфеніл]етил}ацетамід; (-)-N-{1-[4-(4-ціанотетрагідро-2Н-тіопіран-4-іл)-2метилфеніл]етил}-2-(6,7-дифлуор-1Нбензімідазол-1-іл)ацетамід; (-)-N-{1-[4-(1-ціано-1-метилетил)-2метилфеніл]етил}-2-(6,7-дифлуор-1Нбензімідазол-1-іл)ацетамід; (-)-N-{1-[4-(1-ціано-1-метилетил)-2метилфеніл]етил}-2-(6,7-дифлуор-1Нбензімідазол-1-іл)ацетамід; (-)-N-{1-[4-(1-ціано-1-метилетил)-2метилфеніл]етил}-2-(7-флуор-1Н-бензімідазол-1іл)ацетамід; (-)-N-{1-[3-хлор-4-(1-ціано-1метилетил)феніл]етил}-2-(6,7-дифлуор-1Нбензімідазол-1-іл)ацетамід; (-)-N-{1-[3-хлор-4-(1-ціано-1метилетил)феніл]етил}-2-(7-ціано-1Нбензімідазол-1-іл)ацетамід; 5 (-)-2-(7,6-дифлуор-1Н-бензімідазол-1-іл)-N-{1-[4-(1ціано-1-метилетил)-3-метилфеніл]-етил}ацетамід; (-)-2-(7-ціано-1Н-бензімідазол-1-іл)-N-{1-[4-(1ціано-1-метилетил)-3-метилфеніл]-етил}ацетамід; (S)(-)-2-(6-хлор-7-флуор-1Н-бензімідазол-1-іл)-N{[4-(1-ціано-1-метилетил)феніл]-етил}ацетамід; або її фармацевтично прийнятна сіль. 27. Сполука, вибрана з групи, яку складають: (+,-)-2-(7-ціано-1Н-бензімідазол-1-іл)-N-{1-[4-(1ціано-1-метилетил)феніл]етил}-ацетамід; (+,-)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-2(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід; (+,-)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-2-(7флуор-1Н-бензімідазол-1-іл)ацетамід; (+,-)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-2-(7хлор-1Н-бензімідазол-1-іл)ацетамід; (+,-)-N-{1-[4-(1-ціано-1-етилпропіл)феніл]етил}-2(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід; (+,-)-N-{1-[4-(1-ціаноциклобутил)феніл]етил}-2-(6,7дифлуор-1Н-бензімідазол-1-іл)ацетамід; (+,-)-N-{1-[4-(1-ціаноциклогексил)феніл]етил}-2(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід; (+,-)-2-(7-ціано-1Н-бензімідазол-1-іл)-N-{1-[4-(1ціаноциклогексил)феніл]етил}-ацетамід; (+,-)-2-(7-ціано-1Н-бензімідазол-1-іл)-N-{1-[4-(1ціаноциклопропіл)феніл]етил}-ацетамід; (+,-)-2-(7-ціано-1Н-бензімідазол-1-іл)-N-{1-[4-(1ціаноциклобутил)феніл]етил}ацетамід; (+,-)-2-(7-ацетил-1Н-бензімідазол-1-іл)-N-{1-[4-(1ціано-1-метилетил)феніл]етил}-ацетамід; (+,-)-2-(7-ацетил-1Н-бензімідазол-1-іл)-N-{1-[4-(1ціано-1-метилетил)-3-флуорфеніл]-етил}ацетамід; (+,-)-2-(7-ціано-1Н-бензімідазол-1-іл)-N-{1-[4-(1ціано-1-метилетил)-3-флуорфеніл]-етил}ацетамід; (+,-)-2-(7-хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1[4-(1-ціано-1-метилетил)феніл]-етил}ацетамід; (+,-)-2-(7-хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1[4-(1-ціано-1-метилетил)-3флуорфеніл]етил}ацетамід; (+,-)-2-(7-хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1[4-(1-ціано-1-метилетил)-3метилфеніл]етил}ацетамід; (+,-)-2-(7-хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1[4-(1-ціано-1-метилетил)-3метилфеніл]етил}ацетамід; (+,-)-N-{1-[4-(4-ціанотетрагідро-2Н-тіопіран-4-іл)-2метилфеніл]етил}-2-(6,7-дифлуор-1Нбензімідазол-1-іл)ацетамід; N-[4-(1-ціано-1-метилетил)-2-метилбензил]-2-(6,7дифлуор-1Н-бензімідазол-1-іл)ацетамід; 2-(7-ціано-1Н-бензімідазол-1-іл)-N-[4-(1-ціано-1метилетил)-2-метилбензил]ацетамід; (+,-)-N-{1-[4-(1-ціано-1-метилетил)-2метилфеніл]етил}-2-(6,7-дифлуор-1Нбензімідазол-1-іл)ацетамід; (+,-)-N-{1-[4-(1-ціано-1-метилетил)-2метилфеніл]етил}-2-(7-флуор-1Н-бензімідазол-1іл)ацетамід; (+,-)-N-{1-[3-хлор-4-(1-ціано-1метилетил)феніл]етил}-2-(6,7-дифлуор-1Нбензімідазол-1-іл)ацетамід; (+,-)-N-{1-[3-хлор-4-(1-ціано-1метилетил)феніл]етил}-2-(7-ціано-1Нбензімідазол-1-іл)ацетамід; 96764 6 (+,-)-2-(7,6-дифлуор-1Н-бензімідазол-1-іл)-N-{1-[4(1-ціано-1-метилетил)-3метилфеніл]етил}ацетамід; (+,-)-2-(7-ціано-1Н-бензімідазол-1-іл)-N-{1-[4-(1ціано-1-метилетил)-3-метилфеніл]етил}ацетамід; 2-(6-хлор-7-флуор-1Н-бензімідазол-1-іл)-N-{[4-(1ціано-1-метилетил)-2-метилбензил]ацетамід; або її фармацевтично прийнятна сіль. 28. Сполука (S)(-)-2-(7-хлор-6-флуор-1Нбензімідазол-1-іл)-N-{1-[4-(1-ціано-1метилетил)феніл]етил}ацетамід або її фармацевтично прийнятна сіль. 29. Сполука (S)(-)-N-{1-[4-(1-ціано-1метилетил)феніл]етил}-2-(6,7-дифлуор-1Нбензімідазол-1-іл)ацетамід або її фармацевтично прийнятна сіль. 30. Сполука за п. 1, призначена для використання у лікуванні ноцицептичних больових розладів у ссавця. 31. Сполука за п. 1, призначена для використання у лікуванні хронічних ноцицептичних больових розладів у ссавця. 32. Сполука за п. 1 або її фармацевтично прийнятна сіль, призначена для використання у лікуванні остеоартриту. 33. Сполука за п. 1 або її фармацевтично прийнятна сіль, призначена для використання у лікуванні тендиніту. 34. Сполука за п. 1 або її фармацевтично прийнятна сіль, призначена для використання у лікуванні хронічного тендиніту. 35. Сполука за п. 1 або її фармацевтично прийнятна сіль, призначена для використання у лікуванні тазового болю. 36. Сполука за п. 1 або її фармацевтично прийнятна сіль, призначена для використання у лікуванні периферійної нейропатії (головним чином PHN). 37. Сполука зап. 1 або її фармацевтично прийнятна сіль, призначена для використання у лікуванні шлунково-стравохідного рефлюксу (GERD). 38. Сполука за п. 1 або її фармацевтично прийнятна сіль, призначена для використання у лікуванні синдрому подразнення кишечнику (IBS). 39. Сполука за п. 1 або її фармацевтично прийнятна сіль, призначена для використання у лікуванні гіперактивності сечового міхура. 40. Спосіб лікування ноцицептичних больових розладів, який включає введення ефективної кількості сполуки за п. 1 або її фармацевтично прийнятної солі пацієнту, що потребує цього. 41. Спосіб лікування ноцицептичних больових розладів, який включає введення ефективної кількості сполуки (S)(-)-2-(7-хлор-6-флуор-1Нбензімідазол-1-іл)-N-{1-[4-(1-ціано-1метилетил)феніл]етил}ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. 42. Спосіб лікування ноцицептичних больових розладів, який включає введення ефективної кількості сполуки (S)(-)-N-{1-[4-(1-ціано-1метилетил)феніл]етил}-2-(6,7-дифлуор-1Нбензімідазол-1-іл)ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. 43. Спосіб лікування хронічних ноцицептичних больових розладів, який включає введення ефек 7 96764 8 тивної кількості сполуки за п. 1 або її фармацевтично прийнятної солі пацієнту, що потребує цього. 44. Спосіб лікування хронічних ноцицептичних больових розладів, який включає введення ефективної кількості сполуки (S)(-)-2-(7-хлор-6-флуор1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1метилетил)феніл]етил}ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. 45. Спосіб лікування хронічних ноцицептичних больових розладів, який включає введення ефективної кількості сполуки (S)(-)-N-{1-[4-(1-ціано-1метилетил)феніл]етил}-2-(6,7-дифлуор-1Нбензімідазол-1-іл)ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. 46. Спосіб лікування остеоартриту, який включає введення ефективної кількості сполуки за п. 1 або її фармацевтично прийнятної солі пацієнту, що потребує цього. 47. Спосіб лікування остеоартриту, який включає введення ефективної кількості сполуки (S)(-)-2-(7хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1-[4-(1ціано-1-метилетил)феніл]-етил}ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. 48. Спосіб лікування остеоартриту, який включає введення ефективної кількості сполуки (S)(-)-N-{1[4-(1-ціано-1-метилетил)феніл]етил}-2-(6,7дифлуор-1Н-бензімідазол-1-іл)ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. 49. Спосіб лікування тендиніту, який включає введення ефективної кількості сполуки за п. 1 або її фармацевтично прийнятної солі пацієнту, що потребує цього. 50. Спосіб лікування тендиніту, який включає введення ефективної кількості сполуки (S)(-)-2-(7хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1-[4-(1ціано-1-метилетил)феніл]-етил}ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. 51. Спосіб лікування тендиніту, який включає введення ефективної кількості сполуки (S)(-)-N-{1-[4(1-ціано-1-метилетил)феніл]етил}-2-(6,7-дифлуор1Н-бензімідазол-1-іл)ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. 52. Спосіб лікування хронічного тендиніту, який включає введення ефективної кількості сполуки за п. 1 або її фармацевтично прийнятної солі пацієнту, що потребує цього. 53. Спосіб лікування хронічного тендиніту, який включає введення ефективної кількості сполуки (S)(-)-2-(7-хлор-6-флуор-1Н-бензімідазол-1-іл)-N{1-[4-(1-ціано-1-метилетил)-феніл]-етил}ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. 54. Спосіб лікування хронічного тендиніту, який включає введення ефективної кількості сполуки (S)(-)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-2(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. 55. Спосіб лікування тазового болю, який включає введення ефективної кількості сполуки за п. 1 або її фармацевтично прийнятної солі пацієнту, що потребує цього. 56. Спосіб лікування тазового болю, який включає введення ефективної кількості сполуки (S)(-)-2-(7хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1-[4-(1ціано-1-метилетил)феніл]-етил}ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. 57. Спосіб лікування тазового болю, який включає введення ефективної кількості сполуки (S)(-)-N-{1[4-(1-ціано-1-метилетил)феніл]етил}-2-(6,7дифлуор-1Н-бензімідазол-1-іл)ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. 58. Спосіб лікування периферійної нейропатії (головним чином PHN), який включає введення ефективної кількості сполуки за п. 1 або її фармацевтично прийнятної солі пацієнту, що потребує цього. 59. Спосіб лікування периферійної нейропатії (головним чином PHN), який включає введення ефективної кількості сполуки (S)(-)-2-(7-хлор-6-флуор1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1метилетил)феніл]-етил}ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. 60. Спосіб лікування периферійної нейропатії (головним чином PHN), який включає введення ефективної кількості сполуки (S)(-)-N-{1-[4-(1-ціано-1метилетил)феніл]етил}-2-(6,7-дифлуор-1Нбензімідазол-1-іл)ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. 61. Фармацевтична композиція, яка містить сполуку за п. 1 або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій. 62. Фармацевтична композиція, яка містить сполуку (S)(-)-2-(7-хлор-6-флуор-1Н-бензімідазол-1-іл)N-{1-[4-(1-ціано-1-метилетил)феніл]етил}ацетамід або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій. 63. Фармацевтична композиція, яка містить сполуку (S)(-)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}2-(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій. Винахід стосується нових сполук, фармацевтичних композицій, що містять зазначені сполуки і використання зазначених сполук у терапії, а також стосується способів приготування зазначених спо лук і нових інтермедіатів, що використовуються у їх приготуванні. Відчуття болю у ссавців виникає внаслідок активації периферійних терміналів спеціалізованої групи сенсорних нейронів, відомих як ноціцептори. 9 Капсаїцин, активний інгредієнт гострих перців, викликає стійку активацію ноціцепторів і залежне від дози відчуття болю у людини. Клонування ванілоїдного рецептора 1 (VR1 або TRPV1) показало, що VR1 є молекулярною ціллю для капсаїцину у його аналогів. (Caterina, M.J., Schumacher, M.A., et al. Nature (1997) v. 389 p. 816-824). Функціональні дослідження з використанням VR1 показують, що він також активується токсичним теплом, дією кислоти на тканини і іншими запальними медіаторами (Tominaga, Μ., Caterina, M.J. et al. Neuron (1998) v. 21, p. 531-543). Експресія VR1 також регулюється після таких пошкоджень периферійного нерву, які викликають нейропатичний біль. Ці властивості VR1 роблять його природним компонентом болю і хвороб, пов'язаних з запаленням. Хоча агоністи рецептора VR1 можуть діяти як анальгетики руйнуванням ноціцептора, використання таких агоністів, як капсаїцин і його аналоги обмеженим через їх гостроту, нейротоксичність і спричинення гіпотермії. Агенти, що блокують активність VR1, мають бути більш корисними. Антагоністи сприяють анальгетичним властивостям, не є їдкими і не мають побічної нейротоксичності. Вважають, що сполуки з активним інгібітором VR1 можуть бути використані для лікування і/або профілактики таких розладів, як біль, зокрема, запального або травматичного походження, наприклад, викликаний артритом, ішемією, раком, фіброміалгією; біль у спині і післяопераційний біль (Walker et al J Pharmacol Exp Ther. (2003) Jan; 304(1):56-62). До цього можна додати такі больові стани, що можуть лікуватись пригніченням VR1, як вісцеральні болі, наприклад, хронічні болі тазової кістки, цистити, синдром подразнення кишечнику (IBS), панкреатити тощо, а також нейропатичний біль, наприклад, сідничний, діабетичну нейропатію, нейропатії ВІЛ, множинний склероз тощо (Walker et al. ibid, Rashid et al. J Pharmacol Exp Ther. (2003) Mar; 304(3):940-8). Вважають, що ці сполуки також потенційно корисними у лікуванні запальних розладів, наприклад, астми, кашлю і запальної кишкової хвороби (IBD) (Hwang, Oh Curr Opin Pharmacol (2002) Jun;2(3):235-42). Сполуки блокери активності VR1 також корисними у лікуванні сверблячки шкірних хвороб, наприклад, псоріазу, і шлунково-стравохідного рефлюксу і (GERD), блювоти, раку, нетримання сечі і гіперактивності сечового міхура (Yiangou et al. BJU Int (2001) Jun; 87(9):774-9, Szallasi Am J Clin Pathol (2002) 118: 110-21). Інгібітори VR1 також можуть бути використані у лікуванні і/або профілактиці наслідків дії активаторів VR1, наприклад капсаїцину або сльозогінного газу, кислоти або тепла (Szallasi ibid). Ще одним застосуванням може бути лікування толерантності до активаторів VR1 або лікування інтерстиціального циститу і пов'язаного з цим болю. У WO2004/100865 описано сполуки, що інгібіторами активності рецептора 1 (VR1). Визначення У цьому описі: Символи "(+,-)" означають рацемічну суміш сполук. 96764 10 Термін "алкіл", використаний окремо або як суфікс або префікс, стосується лінійних або розгалужених ланцюгових гідрокарбонових радикалів, що включають від 1 до приблизно 12 атомів карбону. Термін "алкілен", використаний окремо або як суфікс або префікс, стосується дивалентних лінійних або розгалужених ланцюгових гідрокарбонових радикалів, що включають 1 від до приблизно 12 атом карбону, які слугують для зв'язування двох структур. Термін "алкеніл", використаний окремо або як суфікс або префікс, стосується моновалентного лінійного або розгалуженого ланцюгового гідрокарбонового радикалу з щонайменше одним карбонкарбоновим подвійним зв'язком, який включає щонайменше від 2 до приблизно 12 атомів карбону. Термін "алкініл", використаний окремо або як суфікс або префікс, стосується моновалентного лінійного або розгалуженого ланцюгового гідрокарбонового радикалу з щонайменше одним карбонкарбоновим потрійним зв'язком, який включає щонайменше від 2 і до приблизно 12 атомів карбону. Термін "амін" або "аміно" стосується радикалів загальної формули -NRR', де R і R' незалежно вибрані з гідрогену або гідрокарбонового радикалу. Термін "ароматичний" стосується гідрокарбонових радикалів з одним або більше поліненасиченими карбоновими кільцями ароматичного характеру, (наприклад, з 4n+2 делокалізованимии електронами), які включають від 6 до приблизно 14 атомів карбону. Термін "арил", використаний окремо або як суфікс або префікс, стосується гідрокарбонового радикалу з одним або більше поліненасиченими карбоновими кільцями ароматичного характеру (наприклад, з 4n+2 делокалізованимии електронами, які включають від 5 до приблизно 14 атомів карбону, причому цей радикал знаходиться на карбоні ароматичного кільця. Термін "циклоалкіл", використаний окремо або як суфікс або префікс, стосується моновалентного гідрокарбонового радикалу, який містить кільце і включає щонайменше від 3 до приблизно 12 атомів карбону. Термін "гетероциклоалкіл" стосується насиченого або ненасиченого циклоалкілу, в якому щонайменше один кільцевий карбон (і будь-які пов'язані з ним атоми гідрогену) незалежно заміщені щонайменше одним гетероатомом, вибраним з О і N. Такі циклоалкіли включають (не лише) такі групи, як морфолініл, піперидиніл, піперазиніл і піродиніл. Термін "галоген" стосується флуорних, хлорних, бромних і йодних радикалів. Термін "гетероцикл" або "гетероциклічний" або "гетероциклічний компонент" стосується моновалентних і дивалентних радикалів, які мають один або більше гетероатомів, незалежно вибраних з Ν, Ο, Ρ і S, як частин кільцевої структури, і включають щонайменше від 3 до приблизно 20 атомів у кільцях, бажано, 5- і 6-членних. Гетероциклічний компонент може бути насичений або ненасичений, мати один або більше подвійних зв'язків і містити більше одного кільця. 11 Термін "гетероарил" стосується гетероциклічних моновалентних і дивалентних радикалів ароматичного характеру. Гетероциклічний компонент включає, наприклад, такий моноциклічний компонент, як азирідин, оксиран, тиіран, ацетидин, оксетан, тіетан, піролідин, піролін, імідазолідин, піразолідин, діоксолан, сульфолан, 2,3-дигідрофуран, 2,5-дигідрофуран тетрагідрофуран, тіофан, тіофен, піперидин, 1,2,3,6-тетрагідропіридин, піперазин, морфолін, тіоморфолін, піран, тіопіран, 2,3-дигідропіран, тетрагідропіран, 1,4-дигідропіридин, 1,4-діоксан, 1,3діоксан, діоксан, гомопіперидин, 2,3,4,7-тетрагідро1Н-азепін, гомопіперазин, 1,3-діоксепан, 4,7дигідро-1,3-діоксепін і гексаметиленоксид. Крім того, гетероциклічний компонент включає гетероарильні кільця, наприклад, піридил, піразиніл, піримідиніл, піридазиніл, тієніл, фурил, піроліл, імідазоліл, тіазоліл, оксазоліл, піразоліл, ізотіазоліл, ізоксазоліл, 1,2,3-тріазоліл, тетразоліл, 1,2,3тіадіазоліл, 1,2,3-оксадіазоліл, 1,2,4-тріазоліл, 1,2,4-тіадіазоліл, 1,2,4-оксадіазоліл, 1,3,4тріазоліл, 1,3,4-тіадіазоліл, і 1,3,4 оксадіазоліл. Гетероциклічний компонент також включає поліциклічний компонент, наприклад, індол, індолін, хінолін, тетрагідрохінолін, ізохінолін, тетрагідроізохінолін, 1,4-бензодіоксан, кумарин, дигідрокумарин, бензофуран, 2,3дигідробензофуран, 1,2-бензізоксазол, бензотіофен, бензоксазол, бензтіазол, бензімідазол, бензотріазол, тіоксантин, карбазол, карболін, акридин, піролізидин і хінолізидин. На додаток до поліциклічних гетероциклів, описаних вище, гетероциклічний компонент включає поліциклічний гетероциклічний компонент, в якому злиті два або більше кільця включають більше одного зв'язку, спільного для обох кілець, і більше двох атомів, спільних для обох кілець, приклади таких гетероциклів з містками включають хінуклідин, діазабіцикло [2,2,1]гептан і 7оксабіцикло[2,2,1]гептан. Термін "гідрокарбіл" стосується будь-якої структури, що містить лише карбон і атоми гідрогену у кількості до 14. Термін "ссавець" включає будь-яку з різних теплокровних хребетних тварин класу Mammalia, включаючи (не лише) людину, для яких взагалі характерним наявність волосся на шкірі. Термін "пацієнт" стосується особи, якій приділяють медичну увагу, догляд або лікування. Одним з втілень винаходу є сполука формули І: в якій: 1 R вибрана з CN, галогену, С(=О)СН3; 2 R вибрана з метилу або Н; 96764 12 3 R вибрана з Η або галогену; 4 5 кожна з R , R незалежно вибрана з метилу 4 5 або етилу або R і R разом з атомом карбону, до якого вони приєднані, утворюють 3-6-членний циклоалкіл або 5- або 6-членну гетероциклоалкільну групу; 6 7 кожна з R , R незалежно вибрана з Н, галогену, метилу або етилу; або її фармацевтично прийнятна сіль; причому сполука формули І не жодною з таких сполук: N-[4-(1-ціано-1-метилетил)бензил]-2-(6,7дифлуор-1Н-бензімідазол-1-іл)-ацетамід; 2-(7-хлор-1H-бензімідазол-1-іл)-N-[4-(1-ціано1-метилетил)-3-флуорбензил]ацетамід; (+)-2-(7-ціано-1H-бензімідазол-1-іл)-N-{1-[4-(1ціаноциклогексил)феніл]етил}ацетамід; (+)-N-{1-[4-(1-ціано-1-метилетил)-2метилфеніл]етил}-2-(6,7-дифлуор-1Нбензімідазол-1-іл)ацетамід; (+,-)-2-(6-хлор-7-флуор-1H-бензімідазол-1-іл)N-{1-[4-(1-ціано-1-метилетил)-2метилфеніл]етил}ацетамід; (+)-2-(7-ацетил-1H-бензімідазол-1-іл)-N-{1-[4(1-ціано-1-метилетил)феніл]етил}ацетамід; (+)-N-{1-[4-(1-ціаноциклогексил)феніл]етил}-2(6,7-дифлуор-1H-бензімідазол-1-іл)ацетамід; (+)-2-(7-хлор-6-флуор-1H-бензімідазол-1-іл)-N{1-[4-(1-ціано-1-метилетил)-3флуорфеніл]етил}ацетамід; (+)-N-{1-[4-(1-ціано-1-метилетил)-3флуорфеніл]етил}-2-(6,7-дифлуор-1Hбензімідазол-1-іл)ацетамід; (+)-N-{1-[4-(1-ціаноциклобутил)феніл]етил}-2(6,7-дифлуор-1H-бензімідазол-1-іл)ацетамід; (R)(+)-N-{1-[4-(1-ціано-1метилетил)феніл]етил}-2-(6,7-дифлуор-1Hбензімідазол-1-іл)ацетамід; (R)(+)-2-(7-ціано-1H-бензімідазол-1-іл)-N-{1-[4(1-ціано-1-метилетил)феніл]етил}-ацетамід; (+)-2-(7-ціано-1H-бензімідазол-1-іл)-N-{1-[4-(1ціано-1-метилетил )-3-флуорфеніл]-етил}ацетамід; (+)-2-(7-ацетил-1H-бензімідазол-1-іл)-N-{1-[4(1-ціано-1-метилетил)-3-флуорфеніл]етил}ацетамід; (R)(+)-N-{1-[4-(1-ціано-1етилпропіл)феніл]етил}-2-(6,7-дифлуор-1Hбензімідазол-1-іл)ацетамід. Одним з втілень винаходу сполука формули І 1 або її фармацевтично прийнятна сіль, в якій R незалежно вибрана з хлору або флуору. Одним з втілень винаходу сполука формули І 3 або її фармацевтично прийнятна сіль, в якій R вибрана з хлору або флуору. Одним з втілень винаходу сполука формули І 1 або її фармацевтично прийнятна сіль, в якій R 3 незалежно вибрана з хлору або флуору, і R вибрана з хлору або флуору. Одним з втілень винаходу сполука формули І 4 5 або її фармацевтично прийнятна сіль, в якій R і R незалежно вибрані з метилу або етилу. Одним з втілень винаходу сполука формули І 1 або її фармацевтично прийнятна сіль, в якій R 4 5 незалежно вибрана з хлору або флуору, a R і R незалежно вибрані з метилу або етилу. 13 Одним з втілень винаходу сполука формули І 3 або її фармацевтично прийнятна сіль, в якій R 4 5 вибрана з хлору або флуору, a R і R незалежно вибрані з метилу або етилу. Одним з втілень винаходу сполука формули І 1 або її фармацевтично прийнятна сіль, в якій R 3 незалежно вибрана з хлору або флуору, R вибра4 5 на з хлору або флуору, і R і R незалежно вибрані з метилу або етилу. Одним з втілень винаходу сполука формули І 4 5 або її фармацевтично прийнятна сіль, в якій R і R разом з атомом карбону, до якого вони приєднані, утворюють 3-, 4-, або 6-членний циклоалкіл або 5або 6-членну гетероциклоалкільну групу. Одним з втілень винаходу сполука формули І 1 або її фармацевтично прийнятна сіль, в якій R 4 5 незалежно вибрана з хлору або флуору, a R і R разом з атомом карбону, до якого вони приєднані, утворюють 3-, 4-, або 6-членний циклоалкіл або 5або 6-членну гетероциклоалкільну групу. Одним з втілень винаходу сполука формули І 3 або її фармацевтично прийнятна сіль, в якій R 4 5 вибрана з хлору або флуору, a R і R разом з атомом карбону, до якого вони приєднані, утворюють 3-, 4-, або 6-членний циклоалкіл або 5- або 6-членну гетероциклоалкільну групу. Одним з втілень винаходу сполука формули І 1 або її фармацевтично прийнятна сіль, в якій R 3 незалежно вибрана з хлору або флуору, R вибра4 5 на з хлору або флуору, і R і R разом з атомом карбону, до якого вони приєднані, утворюють 3, 4, або 6 членний циклоалкіл або 5- або 6-членн гетероциклоалкільну групу. Одним з втілень винаходу сполука формули І або її фармацевтично прийнятна сіль, в якій кожна 6 7 з R , R незалежно вибрана з флуору або хлору. Одним з втілень винаходу сполука формули І або її фармацевтично прийнятна сіль, в якій кожна 6 7 з R , R незалежно є Н. Одним з втілень винаходу сполука формули І 1 або її фармацевтично прийнятна сіль, в якій R незалежно вибрана з хлору або флуору, а кожна з 6 7 R , R незалежно є Н. Одним з втілень винаходу сполука формули І 3 або її фармацевтично прийнятна сіль, в якій R 6 7 вибрана з хлору або флуору, а кожна з R , R незалежно є Н. Одним з втілень винаходу сполука формули І 1 або її фармацевтично прийнятна сіль, в якій R 3 незалежно вибрана з хлору або флуору, R вибра6 7 на з хлору або флуору, і кожна з R , R незалежно є Н. Одним з втілень винаходу сполука формули І 4 5 або її фармацевтично прийнятна сіль, в якій R і R незалежно вибрані з метилу або етилу, а кожна з 6 7 R , R незалежно є Н. Одним з втілень винаходу сполука формули І 1 або її фармацевтично прийнятна сіль, в якій R 4 5 незалежно вибрана з хлору або флуору, R і R незалежно вибрані з метилу або етилу, і кожна з 6 7 R , R незалежно є Н. Одним з втілень винаходу сполука формули І 3 або її фармацевтично прийнятна сіль, в якій R 4 5 вибрана з хлору або флуору, R і R незалежно 6 7 вибрані з метилу або етилу, і кожна з R , R є Н. 96764 14 Одним з втілень винаходу сполука формули І 1 або її фармацевтично прийнятна сіль, в якій R 3 незалежно вибрана з хлору або флуору, R вибра4 5 на з хлору або флуору, R і R незалежно вибрані 6 7 з метилу або етилу, і кожна з R , R є Н. Одним з втілень винаходу сполука формули І 4 5 або її фармацевтично прийнятна сіль, в якій R і R разом з атомом карбону, до якого вони приєднані, утворюють 3-, 4-, або 6-членний циклоалкіл або 5або 6-членну гетероциклоалкільну групу, а кожна з 6 7 R , R є Н. Одним з втілень винаходу сполука формули І 1 або її фармацевтично прийнятна сіль, в якій R 4 5 незалежно вибрана з хлору або флуору, R і R разом з атомом карбону до якого вони приєднані, утворюють 3-, 4-, або 6-членний циклоалкіл або 5або 6-членну гетероциклоалкільну групу, а кожна з 6 7 R і R є Н. Одним з втілень винаходу сполука формули І 3 або її фармацевтично прийнятна сіль, в якій R 4 5 вибрана з хлору або флуору, R і R разом з атомом карбону, до якого вони приєднані, утворюють 3-, 4-, або 6-членний циклоалкіл або 5- або 66 7 членну гетероциклоалкільну групу, а кожна з R , R є Н. Одним з втілень винаходу сполука формули І 1 або її фармацевтично прийнятна сіль, в якій R 3 незалежно вибрана з хлору або флуору, R вибра4 5 на з хлору або флуору, R і R разом з атомом карбону, до якого вони приєднані, утворюють 3-, 4, або 6-членний циклоалкіл або 5- або 6- членну 6 7 гетероциклоалкільну групу, а кожна з R і R є Н. Одним з втілень винаходу сполука, вибрана з групи, яку складають: (S)(-)-2-(7-ціано-1Н-бензімідазол-1-іл)-N-{1-[4(1-ціано-1-метилетил)феніл]етил}-ацетамід; (S)(-)-N-{1-[4-(1-ціано-1метилетил)феніл]етил}-2-(7-флуор-1Hбензімідазол-1-іл)ацетамід; (S)(-)-N-{1-[4-(1-ціано-1метилетил)феніл]етил}-2-(7-хлор-1H-бензімідазол1-іл)ацетамід; (S)(-)-N-{1-[4-(1-ціано-1етилпропіл)феніл]етил}-2-(6,7-дифлуор-1Hбензімідазол-1-іл)ацетамід; (-)-N-{1-[4-(1-ціаноциклобутил)феніл]етил}-2(6,7-дифлуор-1H-бензімідазол-1-іл)ацетамід; (-)-N-{1-[4-(1-ціаноциклогексил)феніл]етил}-2(6,7-дифлуор-1H-бензімідазол-1-іл)ацетамід; (-)-2-(7-ціано-1H-бензімідазол-1-іл)-N-{1-[4-(1ціаноциклогексил)феніл]етил}ацетамід; (-)-2-(7-ціано-1H-бензімідазол-1-іл)-N-{1-[4-(1ціаноциклобутил)феніл]етил}ацетамід; (-)-2-(7-ацетил-1H-бензімідазол-1-іл)-N-{1-[4-(1ціано-1-метилетил)феніл]етил}-ацетамід; (S)(-)-2-(7-ацетил-1H-бензімідазол-1-іл)-N-{1[4-(1-ціано-1-метилетил)-3-флуорфеніл]етил}ацетамід; (-)-N-{1-[4-(1-ціано-1-метилетил)-3флуорфеніл]етил}-2-(6,7-дифлуор-1Нбензімідазол-1-іл)ацетамід; (-)-2-(7-хлор-1H-бензімідазол-1-іл)-N-{1-[4-(1ціано-1-метилетил)-3-флуорфеніл]етил}-ацетамід; (-)-2-(7-ціано-1H-бензімідазол-1-іл)-Ν-[4-(1ціано-1-метилетил)-3-флуорбензил]-ацетамід; 15 (-)-2-(7-хлор-6-флуор-1H-бензімідазол-1-іл)-N{1-[4-(1-ціано-1-метилетил)-3флуорфеніл]етил}ацетамід; (-)-2-(7-хлор-6-флуор-1H-бензімідазол-1-іл)-N{1-[4-(1-ціано-1-метилетил)-3метилфеніл]етил}ацетамід; (-)-2-(7-хлор-б-флуор-1H-бензімідазол-1-іл)-N{1-[4-(1-ціано-1-метилетил)-3метилфеніл]етил}ацетамід; (-)-N-{1-[4-(4-ціанотетрагідро-2Н-тіопіран-4-іл)2-метилфеніл]етил}-2-(6,7-дифлуор-1Hбензімідазол-1-іл)ацетамід; (-)-N-{1-[4-(1-ціано-1-метилетил)-2метилфеніл]етил}-2-(6,7-дифлуор-1Hбензімідазол-1-іл)ацетамід; (-)-N-{1-[4-(1-ціано-1-метилетил)-2метилфеніл]етил}-2-(6,7-дифлуор-1Hбензімідазол-1-іл)ацетамід; (-)-N-{1-[4-(1-ціано-1-метилетил)-2метилфеніл]етил}-2-(7-флуор-1H-бензімідазол-1іл)ацетамід; (-)-N-{1-[3-хлор-4-(1-ціано-1метилетил)феніл]етил}-2-(6,7-дифлуор-1Нбензімідазол-1-іл)ацетамід; (-)-N-{1-[3-хлор-4-(1-ціано-1метилетил)феніл]етил}-2-(7-ціано-1Hбензімідазол-1-іл)ацетамід; (-)-2-(6,7-дифлуор-1H-бензімідазол-1-іл)-N-{1[4-(1-ціано-1-метилетил)-3-метилфеніл]етил}ацетамід; (-)-2-(7-ціано-1H-бензімідазол-1-іл)-N-{1-[4-(1ціано-1-метилетил)-3-метилфеніл]етил}-ацетамід; (S)(-)-2-(6-хлор-7-флуор-1H-бензімідазол-1-іл)N-{[4-(1-ціано-1-метилетил)феніл]-етил}-ацетамід; і її фармацевтично прийнятна сіль. Одним з втілень винаходу сполука, вибрана з групи, яку складають: (+,-)-2-(7-ціано-1H-бензімідазол-1-іл)-N-{1-[4(1-ціано-1-метилетил)феніл]етил}-ацетамід; (+,-)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}2-(6,7-дифлуор-1H-бензімідазол-1-іл)ацетамід; (+,-)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}2-(7-флуор-1H-бензімідазол-1-іл)ацетамід; (+,-)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}2-(7-хлор-1H-бензімідазол-1-іл)ацетамід; (+,-)-N-{1-[4-(1-ціано-1-етилпропіл)феніл]етил}2-(6,7-дифлуор-1H-бензімідазол-1-іл)ацетамід; (+,-)-N-{1-[4-(1-ціаноциклобутил)феніл]етил}-2(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетамід; (+,-)-N-{1-[4-(1-ціаноциклогексил)феніл]етил}2-(6,7-дифлуор-1H-бензімідазол-1-іл)ацетамід; (+,-)-2-(7-ціано-1H-бензімідазол-1-іл)-N-{1-[4(1-ціаноциклогексил)феніл]етил}-ацетамід; (+,-)-2-(7-ціано-1H-бензімідазол-1-іл)-N-{1-[4(1-ціаноциклопропіл)феніл]етил}-ацетамід; (+,-)-2-(7-ціано-1H-бензімідазол-1-іл)-N-{1-[4(1-ціаноциклобутил)феніл]етил}ацетамід; (+,-)-2-(7-ацетил-1H-бензімідазол-1-іл)-N-{1-[4(1-ціано-1-метилетил)феніл]етил}-ацетамід; (+,-)-2-(7-ацетил-1H-бензімідазол-1-іл)-N-{1-[4(1-ціано-1-метилетил)-3-флуорфеніл]етил}ацетамід (+,-)-2-(7-ціано-1H-бензімідазол-1-іл)-N-{1-[4(1-ціано-1-метилетил)-3-флуорфеніл]етил}ацетамід; 96764 16 (+,-)-2-(7-хлор-6-флуор-1H-бензімідазол-1-іл)N-{1-[4-(1-ціано-1-метилетил)феніл]етил}ацетамід; (+,-)-2-(7-хлор-6-флуор-1H-бензімідазол-1-іл)N-{1-[4-(1-ціано-1-метилетил)-3флуорфеніл]етил}ацетамід; (+,-)-2-(7-хлор-6-флуор-1H-бензімідазол-1-іл)N-{1-[4-(1-ціано-1-метилетил)-3метилфеніл]етил}ацетамід; (+,-)-2-(7-хлор-6-флуор-1H-бензімідазол-1-іл)N-{1-[4-(1-ціано-1-метилетил)-3метилфеніл]етил}ацетамід; (+,-)-N-{1-[4-(4-ціанотетрагідро-2Н-тіопіран-4іл)-2-метилфеніл]етил}-2-(6,7-дифлуор-1Hбензімідазол-1-іл)ацетамід; N-[4-(1-ціано-1-метилетил)-2-метилбензил]-2(6,7-дифлуор-1H-бензімідазол-1-іл)ацетамід 2-(7-ціано-1H-бензімідазол-1-іл)-N-[4-(1-ціано1-метилетил)-2-метилбензил]ацетамід; (+,-)-N-{1-[4-(1-ціано-1-метилетил)-2метилфеніл]етил}-2-(6,7-дифлуор-1Нбензімідазол-1-іл)ацетамід; (+,-)-N-{1-[4-(1-ціано-1-метилетил)-2метилфеніл]етил}-2-(7-флуор-1H-бензімідазол-1іл)ацетамід (+,-)-N-{1-[3-хлор-4-(1-ціано-1метилетил)феніл]етил}-2-(6,7-дифлуор-1Hбензімідазол-1-іл)ацетамід; (+,-)-Ν-{1-[3-хлор-4-(1-ціано-1метилетил)феніл]етил}-2-(7-ціано-1Hбензімідазол-1-іл)ацетамід; (+,-)-2-(7,6-дифлуор-1H-бензімідазол-1-іл)-N{1-[4-(1-ціано-1-метилетил)-3метилфеніл]етил}ацетамід; (+,-)-2-(7-ціано-1H-бензімідазол-1-іл)-N-{1-[4(1-ціано-1-метилетил)-3метилфеніл]етил}ацетамід; 2-(6-хлор-7-флуор-1H-бензімідазол-1-іл)-N-{[4(1-ціано-1-метилетил)-2-метилбензил]ацетамід; і її фармацевтично прийнятна сіль. Одним з втілень винаходу сполука (S)(-)-2-(7хлор-6-флуор-1H-бензімідазол-1-іл)-N-{1-[4-(1ціано-1-метилетил)феніл]етил}ацетамід і її фармацевтично прийнятна сіль. Одним з втілень винаходу сполука (S)(-)-N-{1[4-(1-ціано-1-метилетил)феніл]етил}-2-(6,7дифлуор-1H-бензімідазол-1-іл)ацетамід і її фармацевтично прийнятна сіль. Одним з втілень винаходу сполука формули І або її фармацевтично прийнятна сіль, призначена для використання у лікуванні хронічних ноцицептичних больових розладів у ссавців. Одним з втілень винаходу сполука формули І або фармацевтично прийнятна сіль, призначена для використання у лікуванні остеоартриту. Одним з втілень винаходу сполука формули І або її фармацевтично прийнятна сіль, призначена для використання у лікуванні хронічного тендиніту. Одним з втілень винаходу сполука формули І або її фармацевтично прийнятна сіль, призначена для використання у лікуванні тазового болю. Одним з втілень винаходу сполука формули І або її фармацевтично прийнятна сіль, призначена для використання у лікуванні периферійної нейропатії (головним чином PHN). 17 Одним з втілень винаходу сполука формули І або її фармацевтично прийнятна сіль, призначена для використання у лікуванні шлунковостравохідного рефлюксу (GERD), Одним з втілень винаходу сполука формули І або її фармацевтично прийнятна сіль, призначена для використання у лікуванні синдрому подразнення кишечнику (IBS). Одним з втілень винаходу сполука формули І або її фармацевтично прийнятна сіль, призначена для використання у лікуванні гіперактивності сечового міхура. Одним з втілень винаходу спосіб лікування ноцицептичних больових розладів, який включає введення ефективної кількості сполуки формули І або її фармацевтично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу спосіб лікування ноцицептичних больових розладів, який включає введення ефективної кількості сполуки (S)(-)-2-(7хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1-[4-(1ціано-1-метилетил)феніл]етил}ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу спосіб лікування ноцицептичних больових розладів, який включає введення ефективної кількості сполуки (S)(-)-N-{1[4-(1-ціано-1-метилетил)феніл]етил}-2-(6,7дифлуор-1Н-бензімідазол-1-іл)ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу спосіб лікування хронічних ноцицептичних больових розладів, який включає введення ефективної кількості сполуки формули І або її фармацевтично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу спосіб лікування хронічних ноцицептичних больових розладів, який включає введення ефективної кількості сполуки (S)(-)-2-(7-хлор-6-флуор-1Н-бензімідазол-1-іл)-N{1-[4-(1-ціано-1-метилетил)феніл]етил}ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу спосіб лікування хронічних ноцицептичних больових розладів, який включає введення ефективної кількості сполуки (S)(-)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-2(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу спосіб лікування остеоартрит, який включає введення ефективної кількості сполуки формули І або її фармацевтично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу спосіб лікування остеоартрит, який включає введення ефективної кількості сполуки (S)(-)-2-(7-хлор-6-флуор-1Нбензімідазол-1-іл)-N-{1-[4-(1-ціано-1метилетил)феніл]етил}ацетамід або її фармацевтично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу спосіб лікування остеоартрит, який включає введення ефективної кількості сполуки (S)(-)-N-{1-[4-(1-ціано-1метилетил)феніл]етил}-2-(6,7-дифлуор-1Н 96764 18 бензімідазол-1-іл)ацетамід або її фармацевтично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу спосіб лікування хронічного тендиніту, який включає введення ефективної кількості сполуки формули 1 або її фармацевтично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу спосіб лікування хронічного тендиніту, який включає введення ефективної кількості сполуки (S)(-)-2-(7-хлор-6-флуор1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1метилетил)феніл]етил}ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу спосіб лікування хронічного тендиніту, який включає введення ефективної кількості сполуки (S)(-)-N-{1-[4-(1-ціано-1метилетил)феніл]етил}-2-(6,7-дифлуор-1Нбензімідазол-1-іл)ацетамід або її фармацевтично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу спосіб лікування хронічного тендиніту, який включає введення ефективної кількості сполуки формули І або її фармацевтично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу спосіб лікування хронічного тендиніту, який включає введення ефективної кількості сполуки (S)(-)-2-(7-хлор-6-флуор1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1метилетил)феніл]етил}ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу спосіб лікування хронічного тендиніту, який включає введення ефективної кількості сполуки (S)(-)-N-{1-[4-(1-ціано-1метилетил)феніл]етил}-2-(6,7-дифлуор-1Нбензімідазол-1-іл)ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу спосіб лікування тазового болю, який включає введення ефективної кількості сполуки формули І або її фармацевтично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу спосіб лікування тазового болю, який включає введення ефективної кількості сполуки (S)(-)-2-(7-хлор-6-флуор-1Нбензімідазол-1-іл)-N-{1-[4-(1-ціано-1метилетил)феніл]етил}ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу спосіб лікування тазового болю, який включає введення ефективної кількості сполуки (S)(-)-N-{1-[4-(1-ціано-1метилетил)феніл]етил}-2-(6,7-дифлуор-1Нбензімідазол-1-іл)ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу спосіб лікування периферійної нейропатії (головним чином PHN), який включає введення ефективної кількості сполуки формули І або її фармацевтично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу спосіб лікування периферійної нейропатії (головним чином PHN), який включає введення ефективної кількості сполуки (S)(-)-2-(7-хлор-6-флуор-1Н-бензімідазол-1іл)-N-{1-[4-(1-ціано-1 19 метилетил)феніл]етил}ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу спосіб лікування периферійної нейропатії (головним чином PHN), який включає введення ефективної кількості сполуки (S)(-)-N-{1-[4-(1-ціано-1метилетил)феніл]етил}-2-(6,7-дифлуор-1Нбензімідазол-1-іл)ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу спосіб лікування шлунково-стравохідного рефлюксу (GERD), який включає введення ефективної кількості сполуки формули 1 або її фармацевтично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу спосіб лікуванняшлунково-стравохідного рефлюксу (GERD), який включає введення ефективної кількості сполуки (S)(-)-2-(7-хлор-6-флуор-1Н-бензімідазол-1-іл)-N{1-[4-(1-ціано-1-метилетил)феніл]етил}ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу А спосіб лікування шлунково-стравохідного рефлюксу (GERD), який включає введення ефективної кількості сполуки (S)(-)-N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-2(6,7-дифлуор-1Н-бензімідазол-1-іл)ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу спосіб лікування синдрому подразнення кишечнику (IBS), який включає введення ефективної кількості сполуки формули 1 або її фармацевтично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу спосіб лікування синдрому подразнення кишечнику (IBS), який включає введення ефективної кількості сполуки (S)(-)-2(7-хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1-[4-(1ціано-1-метилетил)феніл]етил}ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу спосіб лікування синдрому подразнення кишечнику (IBS), який включає введення ефективної кількості сполуки (S)(-)N-{1-[4-(1-ціано-1-метилетил)феніл]етил}-2-(6,7дифлуор-1Н-бензімідазол-1-іл)ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу спо сіб лікування гіпе рактивності с ечового міхура, який включає введення ефективної кількості сполуки формули 1 або її фармацевтично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу спо сіб лікування гіпе рактивності с ечового міхура, який включає введення ефективної кількості сполуки (S)(-)-2-(7хлор-6-флуор-1Н-бензімідазол-1-іл)-N-{1-[4-(1ціано-1-метилетил)феніл]етил}ацетаміду або її фармацевтично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу спосіб лікування гіперактивності сечового міхура, який включає введення ефективної кількості сполуки (S)(-)-N-{1-[4(1-ціано-1-метилетил)феніл]етил}-2-(6,7-дифлуор1Н-бензімідазол-1-іл)ацетаміду або її фармацев 96764 20 тично прийнятної солі пацієнту, що потребує цього. Одним з втілень винаходу фармацевтична композиція, яка містить сполуку формули 1 або її фармацевтично прийнятну сіль і фармацевтично прийнятного носія. Одним з втілень винаходу фармацевтична композиція, яка містить сполуку (S)(-)-2-(7-хлор-6флуор-1Н-бензімідазол-1-іл)-N-{1-[4-(1-ціано-1метилетил)феніл]етил}ацетамід або її фармацевтично прийнятну сіль і фармацевтично прийнятного носія. Одним з втілень винаходу фармацевтична композиція, яка містить сполуку (S)(-)-N-{1-[4-(1ціано-1-метилетил)феніл]етил}-2-(6,7-дифлуор-1Hбензімідазол-1-іл)ацетамід або її фармацевтично прийнятну сіль і фармацевтично прийнятного носія. Особливості і переваги винаходу розглядаються у наведеному далі детальному описі. Слід відзначити, що комбінування деяких втілень винаходу може дати окреме втілення, а деякі ознаки, що містяться в окремому втіленні, можуть утворити субкомбінації. Деякі сполуки винаходу мають хіральний центр. Деякі форми можуть бути фракціоновані хіральною хроматографією, причому фракціоновані правообертальні сполуки мають більшу антагоністичну активність, ніж лівообертальні. Не звертаючись до теорії, можна вважати, що (+)-ізомери (R)-енантіомерами, а (-)-ізомери (S)енантіомерами. Отже, хоча правообертальні, (D) або (+), або (R), і лівообертальні, (L) або (-), або (S)-сполуки входять в об'єм винаходу, бажаними сполуками винаходу лівообертальні, (S) або (-), сполуки. Знак повертання визначають для довжини хвилі натрію при 22°С за стандартною процедурою у розчинниках у концентраціях, при яких міжмолекулярні з'єднання не очікуються і не відбуваються. Було показано, що хіральний (-)-2-[4-(1аміноетил)феніл]-2-метил-пропаннітрил, отриманий фракціонуванням відповідної рацемічної суміші, має (S)-конфігурацію. Було також показано, що (-)-амін хіральним вихідним матеріалом для отримання (-)-активної кінцевої сполуки, зазначеної у втіленні. Оскільки не спостерігалось інверсії амінного хірального стереогенного центру при реакції сполучення, можна припустити, що конфігурація ()-активних кінцевих сполук (отриманих з використанням даного хірального аміну) є також (S)конфігурацією. Для хіральних кінцевих (-)-активних сполук, отриманих з використанням інших, але схожих бензильних амінів, описаних вище, можна упевнено сподіватись, що xіральний центр має таку ж (S)конфігурацію, хоча тут можливі виключення. Були проведені аналізи для перевірки хіральної структури 2-[4-(1-аміноетил)феніл]-2-метилпропаннітрилу. Результати ІЧ аналізу з вібраційним круговим дихроїзмом у комбінації з молекулярною механікою і обчисленнями прогнозованої щільності спектру VCD згідно з функціональною теорією відповідають припущенню щодо конфігурацій. 21 Конкретні сполуки, описані тут, ілюструють винахід, не обмежуючи його. Інші сполуки згідно з винаходом очевидними для фахівця після розгляду описаних тут процесів, способів і сполук. Описані тут сполуки можуть використовуватись у формі вільної основи або у вигляді фармацевтично прийнятної солі, і/або у формі фармацевтично прийнятного гідрату, наприклад, фармацевтично прийнятної солі сполуки формули І, включаючи отримані з такими кислотами, як метансульфонова, етансульфонова, гідрохлорна, нітрокислота, фосфорна, сульфурова, гідробромна, гідройодна. Фармацевтично прийнятну сіль можна також отримати з використанням таких органічних кислот, як аліфатичні моно- і дикарбоксилати і ароматичні кислоти. Інші фармацевтично прийнятні солі сполуки винаходу включають, наприклад, сульфат, піросульфат, бісульфат, бісульфіт, нітрат і фосфат. Сполуки формули І можуть бути виготовлені способами, відомими у галузі і призначеними для отримання аналогічних сполук. Отже, сполуки згідно з винаходом можуть бути приготовлені за процедурами, описаними у літературі, з відомих сполук або з заздалегідь приготовлених інтермедіатів. Тут розглядаються способи приготування попередників сполуки або їх використання у практичних аспектів винаходу. Фахівцю зрозуміло, що деякі сполуки винаходу містять, наприклад, асиметрично заміщений карбон і, відповідно, можуть існувати і бути ізольовані в оптично активній і рацемічній формах. Деякі сполуки можуть виявляти поліморфізм і, отже, винахід включає рацемічні, оптично активні, поліморфічні або стереоізомерні форми або їх суміші. Такі форми мають властивості, корисні у лікуванні розладів, описаних нижче, приготування оптично активних форм добре відомим фахівцям (наприклад, розрізненням рацемічних форм рекристалізацією, синтезом з використанням оптично активних вихідних матеріалів, хіральним синтезом або хроматографічною сепарацією з використанням хіральної стаціонарної фази). Сполуки формули І антагоністами VR-1 і тому сполуки формули І і їх фармацевтично прийнятні солі можуть бути використані у лікуванні болю, гострого болю, хронічного болю, ноцицептичного болю, гострого ноцицептичного болю, хронічного ноцицептичного болю, нейропатичного болю, гострого нейропатичного болю, хронічного нейропатичного болю, запального болю, гострого запального болю, хронічного запального болю. Лікування таких розладів включає введення теплокровній тварині, бажано, ссавцю, більш бажано, людині, що потребує такого лікування, ефективної кількості сполуки формули І або фармацевтично прийнятної солі зазначеної сполуки. Винахід включає також використання сполуки формули І у лікуванні остеоартриту, хронічного тендиніту, тазового болю і периферійної нейропатії (головним чином, PHN), шлунковостравохідного рефлюксу (GERD), синдрому подразнення кишечнику (IBS) і гіперактивності сечового міхура. 96764 22 Крім того, винахід включає використання сполуки формули І у приготуванні медикаменту для лікування такого розладу, як біль у теплокровної тварини, бажано, ссавця, більше бажано, людини, що страждає від такого розладу. Винахід також включає фармацевтичну композицію, придатну для лікування описаних вище розладів введенням теплокровній тварині, що страждає від таких розладів, ефективної кількості фармацевтичної композиції з сполукою формули І або її фармацевтично прийнятною сіллю. Винахід також включає фармацевтичну композицію, що включає сполуку формули І, визначену вище або її фармацевтично прийнятну сіль, у комбінації з фармацевтично прийнятним носієм. Щонайменше одна з описаних сполук виявляє антагоністичну активність до VR-1 в описаному тут аналізі, при концентрації приблизно 1 мкМ. Вибрані сполуки винаходу мають таку активність при концентрації менше приблизно 100 нМ. Сполуки, описані тут, можуть бути приготовлені у формі, придатній для перорального введення, наприклад, як таблетки, коржики, тверді і м'які капсули, водний розчин, масляний розчин, емульсія і суспензії. Сполуки можуть бути також приготовлені для топічного введення, наприклад, у вигляді крему, мазі, желе, спрею або водних розчинів, масляних розчинів, емульсій або суспензій. Описані тут сполуки можуть також бути пристосовані до носового введення, наприклад, як носове уприскування, носові краплі або сухий порошок. Композиції можна також вводити вагінально або ректально у формі супозиторію, або парентерально, наприклад, внутрішньовенно, інтравезикулярно, підшкірно або внутрішньом'я-зово ін'єкцією або інфузією. Ці сполуки можна вводити інсуфляцією (наприклад, як тонкий порошок), а також трансдермально або під'язично. Сполуки винаходу можуть бути отримані за звичайними процедурами з використанням звичайних фармацевтичних ексципієнтів, добре відомих у галузі. Наприклад, композиції, призначені для перорального введення можуть містити один або більше забарвлювачів, підсолоджувачів, смакових добавок і/або консервантів. Кількість активного інгредієнту у суміші з одним або більше ексципієнтами в одиночній дозованій формі залежить від пацієнта і обраного способу введення. Згідно з відомими принципами медицини, розмір дози сполуки формули І для терапевтичного або профілактичного призначення залежить від природи і важкості стану, віку і статі тварини або пацієнта і способу введення. Існують відомі аналізи і тести у vivo, які дозволяють визначити корисність сполуки у лікуванні, розладів, зазначених вище і, зокрема, як антагоністів рецептора VR-1. Сполуку формули І або її фармацевтично прийнятну сіль, сольват або її естер, здатний до гідролізу у vivo, або фармацевтичну композицію або рецептуру, що містить сполуку формули І можна вводити паралельно, одночасно або окремо у комбінації з іншими сполукою або сполуками, вибраними з групи: 23 (і) терапії нейропатичного болю, включаючи, наприклад, габапентин, лідодерм, прегабін і їх еквіваленти, включаючи (але без обмеження) їх фармацевтично прийнятні солі і фармацевтично активні ізомери і метаболіти. (іі) терапії ноцицептичного болю включаючи, наприклад, целекоксиб, еторикоксиб, луміракоксиб, рофекоксиб, вальдекоксиб, диклофенак, локсопрофен, напроксен, парацетамол і їх еквіваленти, включаючи (без обмеження) їх фармацевтично прийнятні солі, фармацевтично активні ізомери і метаболіти. (ііі) терапії нетримання сечі, включаючи, наприклад, дарифенацин, фальвоксат, оксибутинін, пропіверин, робальзотан, соліфенацин, тиспіум, тольтеродин і їх еквіваленти, включаючи (без обмеження) їх фармацевтично прийнятні солі, фармацевтично активні ізомери і метаболіти. У таких комбінаціях сполуки згідно з винаходом можна застосовувати у дозах, визначених тут, разом з іншим фармацевтично активним агентом у визначених і схвалених для нього дозах і/або у дозах описаних у публікаціях. Способи приготування Інший аспект винаходу стосується способів приготування сполуки формули І або її солей, сольватів або сольватів її солей. У подальшому розгляді таких способів у випадках застосування належних захисних груп і їх подальшого видалення передбачено використання різних реагентів і інтермедіатів у процедурах добре, відомих фахівцям з органічного синтезу. Процедури для використання захисних груп і приклади таких груп можна знайти, наприклад, у "Protective Groups in Organic Synthesis", T.W. Green, P.G.M. Wuts, Wiley-lnterscience, New York, (1999). Посилання і описи для інших придатних реакцій можна знайти у посібниках з органічної хімії, наприклад, у "Advanced Organic Chemistry", th March, 4 ed. McGraw Hill (1992) або "Organic Synthesis", Smith, McGraw Hill, (1994). Типові приклади гетероциклічної хімії можна знайти, наприклад, у "Heterocyclic Chemistry", J. A. Joule, Κ. Mills, rd G. F. Smith, 3 ed. Chapman і Hall (1995), p. 189nd 224 і "Heterocyclic Chemistry", T. L. Gilchrist, 2 ed. Longman Scientific і Technical (1992), p. 248-282. Термін "кімнатна температура" і "зовнішня температура" означають, якщо не зазначено інше, температуру від 16 до 25°С. Абревіатури ДХЕ ДХМ ДМАП ЕДХ HATU дихлоретан ДХМ Ν,Ν-диметиламінопіридин 1-(3-диметиламінопропіл)-3етилкарбодіімід гідрохлорид гексафлуорфосфат О-(7 96764 24 РХВР KHMDS РХ ТФК ТГФ ДМФ ТМЕДА EtOAc ДЕА ДМСО TEMPO MPPX МТБЕ ТШХ MeCN МС МСВР [М+Н] ДІПЕА ЯМР Pd-C EtOH МеОН t-BuOK ТСТ ПЗЗ азабензотріазол-1-іл)-N,N,N',N'тетраметилуронію рідинна хроматографія високого розрізнення гексаметилдисілазан калію рідинна хроматографія трифлуороцтова кислота тетрагідрофуран диметилформамід тетраметилетилендіамін етилацетат діетиламін диметилсульфоксид 2,2,6,6-тетраметил-1-піперидинілокси рідинна хроматографія середнього тиску метилбутилетер тонкошарова хроматографія ацетонітрил мас-спектрографія низького розрізнення мас-спектрографія високого розрізнення молекулярний іон+протон діізопропілетиламін ядерно-магнітний резонанс паладій на карбоні етанол метанол третинний бутоксид калію тиск при стандартній температурі пристрій з зарядовим зв'язком Експериментальні процедури Всі вихідні матеріали є комерційно доступними 1 або описані у літературі. Спектр Н ЯМР реєструють на Variant при 400 МГц. Мас-спектр реєструють на РХ-МС (PX:Agilent 1100, Waters ESI-MC, колонка Phenomenex Synergi Polar (4 мкм) 30x2 мм, потік 1,75 мл/хв мл., мобільна фаза: А=вода (0,05% ТФК); В=MECN (0,05% ТФК), градієнт: 595%, час градієнту: 2,25 хвил.). Кінцеві сполуки аналізують на РХМС Agilent 1100 (МС: Agilent APPI-MCD, потік: 3,5 мл/хвил., колонка: Zorbax SB (1,8 мкм) 4,6x30 мм, температура колонки 70°С, мобільна фаза: А=вода (0,05% ТФК) В=MECN (0,05% ТФК), градієнт: 5-95%, час градієнту 4,5 хвил.). Енантіомери кожного продукт можуть бути розділені на колонках Chiralcel OD або AD від Chiral Technologies inc. Кінцеві продукти іменовані перетворенням рацемічної схеми молекули у назву IUPAC з використанням програм ACD lab. Енантіомерна характеризація кожної назви [(+), (-),(+,-), R, S] додається залежно від поточних відомостей про цю сполуку. Схема 1: синтез (7-хлор-1Н-бензімідазол-1іл)оцтової кислоти 25 Операція а): інтермедіат 1 Синтез 2-[(2-хлор-6-нітрофеніл)аміно]етанол 2,3-дихлорнітроанілін (300 г, 1,56 моль) змішують з етанолом (600 мл) і етаноламіном (282 мл, 4,68 моль). Суміш нагрівають під зворотним холодильником 20 год., потім охолоджують і концентрують у вакуумі. Для видалення етаноламінгідрохлоридної солі сирий продукт розчиняють у 3,5 л AcOEt і 1 л води. Водну фазу відкидають і органічну фазу промивають двічі 700 мл води і розсолом. Після сушіння над безводним сульфатом магнію розчин фільтрують і випаровують у вакуумі, отримуючи бажаний продукт (336 г, 99%) як оранжеве масло. Операція b): інтермедіат 2 Синтез 2-[(2-хлор-6-амінофеніл)аміно]етанолу До розчину 2-[(2-хлор-6нітрофеніл)аміно]етанолу (120 г, 0,554 моль) у метанолу (1,5 л) при 60°С додають розчин Na2S2O4 (85%, 318 г, 1,55 моль) у воді (1,12 л) протягом 20 хвил. Отриману суспензію перемішують при 60°С ще 20 хвил. Знебарвлену суміш залишають охолонути і концентрують у вакуумі. У льодяній ванні додають 800 мл 1,5М розчину NaOH і суміш екстрагують тричі 500 мл AcOEt. Органічну фазу промивають розсолом і сушать над сульфатом магнію. Розчинники випаровують, отримуючи бажаний продукт (72,4 г, 70%). Операція с): інтермедіат 3 Синтез 2-(7-хлор-1H-бензімідазол-1-іл)етанол 2-[(2-хлор-6-амінофеніл)аміно]етанол (72,4 г, 0,388 моль) розчиняють у мурашиній кислоті (350 мл) і перемішують під зворотним холодильником протягом 1 год. Реакційну суміш концентрують до сухості під зниженим тиском, отримуючи темну тверду речовину, потім додають 500 мл НСІ 2N і суміш нагрівають під зворотним холодильником протягом 30 хвил. Розчин охолоджують на льоду і додають 50% розчину NaOH до лужності і отриману суспензію фільтрують у вакуумі і отриману тверду речовину сушать, отримуючи бажаний продукт (70,8 г 93%) Операція d): інтермедіат 4 Синтез 2-(7-хлор-1Н-бензімідазол-1-іл)оцтової кислоти 2-(7-хлор-1Н-бензімідазол-1-іл)етанол (50 г, 0,254 моль) розчиняють у 1 л ацетонітрилу і натрійфосфатному буфері (750 мл рН 6,7) і суміш нагрівають до 40°С, додають TEMPO (2,9 г 18,5 ммоль) і потім твердий NaCIO2 (119 г, 85%, 1,06 96764 26 моль) протягом 3 год. Додають розчин NaOCI (1.65M, 40 мл) до досягнення реакційною сумішшю темнокоричневого кольору. Суміш залишають перемішуватись протягом 16 год. при 45°С. Надлишок окислювального агента гасять (у льодяній ванні) твердим Na2SO3 (100 г), який додають до повного знебарвлення реакційної суміші. На цій стадії утворюється осад, який містить 2-(7-хлор1Н-бензімідазол-1-іл)оцтову кислоту і неорганічний продукт, фільтрують і розчиняють у 500 мл води. Отриманий розчин підкислюють до рН 2 доданням НСІ 6N. Осад фільтрують і промивають водою, отримуючи 3,76 г бажаного продукту. Водну фазу з реакційною сумішшю підкислюють НСІ 6N до рН 2 і утворену тверду речовину фільтрують і промивають водою, отримуючи 41,83 г бажаного продукту. Ацетонітрильний розчин з органічною фазою концентрують, отримуючи суспензію сирого продукту у воді, який очищають розчиненням у 50%-му розчині NaOH. Водний розчин промивають AcOEt і осаджують НСІ 6N до рН 6, отримуючи 1,76 г бажаного продукту для повних 47,35 г (88%) бажаного продукту. Схема 2: синтез (6,7-дифлуор-1Нбензімідазол-1-іл)оцтової кислоти Операція а): інтермедіат 5 Синтез 2-[(2,3-дифлуор-6нітрофеніл)аміно]етанолу Розчин 1,2,3-трифлуор-4-нітробензолу (5,0 г, 28,2 ммоль) і етаноламіну (1,72 г, 28,2 ммоль) у 100 мл етанолу перемішують протягом ночі при кімнатній температурі, потім при 70°С ще 5 год. Реакцію концентрують до сухості і очищають на силікагелі флеш-хроматографією з градієнтом 80/2020/80 гептан/етилацетат і отримують оранжеву тверду речовину. Вихід (3,8 г, 62%). 1 Н ЯМР (400 МГц, CDCI3) м. д. 1,67 (t, J=5,08 Гц, 1Н) 3,77-3,83 (m, 2H) 3,88-3,94 (m, 2H) 6,51 (ddd, J=9,77, 8,59, 7,03 Гц, 1Н) 8,02 (ddd, J=9,77, 5,66, 2,34 Гц, 1H) 8,21 (s, 1H) Операція b): інтермедіат 6 Синтез 2-[(6-аміно-2,3дифлуорфеніл)аміно]етанолу До розчину 2-[(2,3-дифлуор-6нітрофеніл)аміно]етанолу (3,8 г, 17,4 ммоль) у 70 мл етилацетату і 30 мл етанолу додають 10% Pd/C (380 мг). Реакцію струшують при 50 фунт/кв. дюйм (3,5 ат) гідрогену протягом 3 год., періодично підтримуючи цей тиск. Реакцію фільтрують через це 27 96764 28 літ, промивають етанолом і концентрують. Отриманий матеріал використовують без очищення у наступній операції. 1 Н ЯМР (400 МГц, CDCI3) м. д. 3,17-3,27 (m, 2H) 3,68-3,78 (m, 2H) 6,38 (ddd, J=8,89, 4,69, 2,05 Гц, 1Н) 6,61-6,70 (m, 1H). Операція с): інтермедіат 7 Синтез 2-(6,7-дифлуор-1Н-бензімідазол-1іл)етанолу Розчин 2-[(6-аміно-2,3дифлуорфеніл)аміно]етанол у 100 мл мурашиної кислоти нагрівають при 100°С 2 год. Реакцію концентрують до сухості, вносять у 100 мл 2N NH3 в етанолі і перемішують 2,5 год., потім концентрують і вносять в етилацетатом. Отриманий осад збирають фільтруванням і промивають холодним етилацетатом. Материнську рідину концентрують і очищають силікагелевою флеш-хроматографією з етилацетат/гептаном. Повний вихід 3,2 г або 93% з двох операцій, базуючись на 3,8 г 2-[(2,3-дифлуор6-нітрофеніл)аміно]етанолу. Операція с): інтермедіат 8 Синтез (6,7-дифлуор-1Н-бензімідазол-1іл)оцтової кислоти. 2-(6,7-дифлуор-1Н-бензімідазол-1-іл)етанол (2,96 г, 15 ммоль) вносять у 75 мл MeCN і натрій фосфатний буфер (56 мл, 0,67М, рН 6,8) і суміш нагрівають до 42°С. Додають TEMPO (165 мг, 1,05 моль) і потім краплями додають розчин NaCIO2 (3,38 г, 80%-на чистота, 30 ммоль у 15 мл води) і розчин 350 мкл 6%-го NaOCI у 7,5 мл води) протягом1,5 год. Через 48 год. додають таку ж кількість NaCIO2 і NaOCI. Ще через 24 год. додають TEMPO (165 мг, 1,05 моль) і реакцію перемішують 72 год. Потемнішалу реакцію залишають охолонути до кімнатної температури і потім краплями додають 30 мл насиченого розчину Na2SO3 (екзотермія). Реакція стає майже безбарвною. Використовуючи 2N NaOH, доводять рН до 9,2 і реакцію екстрагують 4 рази етилацетатом. рН потім знижують до 3,8 доданням 2N НСІ і розчин залишають відстоюватись на 48 год. і отримують 1,98 г білого кристалічного матеріалу. Материнську рідину доводять до половини об'єму і залишають відстоюватись, отримуючи ще 260 мг (загальний вихід 2,23 г, 70%). 1 Н ЯМР (400 МГц, ДМСО-D6) м. д. 5,19 (s, 2H) 7,25 (ddd, J=11,62, 8,89, 7,62 Гц, 1H) 7,49 (ddd, J=8,94, 3,86, 1,07 Гц, 1H) 8,13-8,28 (m, 1H) 13,38 (s, 1H). Схема 3: синтез (7-ціано-1Н-бензімідазол-1іл)оцтової кислоти Операція а): інтермедіат 9 Синтез 2-хлор-3-нітробензаміду 2-хлор-3-нітробензойну кислоту (100 г, 0,496 г) нагрівають до флегми у чистому тіонілхлориді протягом 2,5 год. з перемішуванням (вивільнення газу). Після охолодження тіоніл-хлорид випаровують до сухості. Отриману тверду речовину розчиняють у 150 мл ДХМ, охолоджують у льодяній ванні і додають 400 мл 28%-го гідроксиду амонію протягом 1 год. (екзотермія). Потім додають 100 мл води, викликаючи осадження. Осад фільтрують, промивають водою і сушать 16 год. над Р2О5 у вакуумі, отримуючи бажаний продукт (83,2 г, 83%) як блідожовту пухнасту тверду речовину. 1 Н ЯМР (300МГц, ДМСО-d6) м. д. 7,61 (t, J=7,93 Гц, 1Н) 7,72 (dd, J=7,63, 1,47 Гц, 1H) 8,04 (dd, J=7,94, 1,47 Гц, 1Н). Операція b): інтермедіат 10 Синтез 2-хлор-3-нітробензонітрилу 2-хлор-3-нітробензамід (83 г, 0,413 моль, добре висушений) додають під зворотним холодильником до розчину дегідратора і суміш залишають при цій температури на 4 год. і при кімнатній температурі ще на 16 год. Суміш гасять льодом, додають 400 мл води для сепарації фаз і водну фазу відкидають. Органічну фазу промивають водою і розсолом і потім сушать над безводним Na2SO4. Розчин фільтрують і концентрують, отримуючи бажаний продукт (74,4 г, 99%) . 1 Н ЯМР (300МГц, ДМСО-d6) м. д. 7,76 (t, J=7,93 Гц, 1Н) 8,27 (dd, J=7,93 1,47 Гц, 1H) 8,36 (dd, J=8,22 1,47 Гц, 1Н). Приготування триметилсиліл поліфосфату (дегідратор): Р2О5 (254 г; 1,79 моль) у 1 л безводного ДХМ перемішують під зворотним холодильником і додають 330 мл гексаметилдисилоксану (1,54 моль) протягом 1 год. через крапельну воронку (екзотермія). Реакційну суміш залишають для перемішування при цій температурі на 1 год. Операція с): інтермедіат 11 Синтез 2-[(2-гідроксиетил)аміно]-3нітробензонітрилу 2-хлор-3-нітробензонітрил (74 г, 0,408 моль) змішують з етанолом (370 мл) і етаноламіном (57 мл). Суміш перемішують 16 год. при кімнатній температурі. Для завершення реакції, суміш витримують під зворотним холодильником протягом 2 год. Після охолодження суміш концентрують у вакуумі; продукт осаджується як червона тверда ре 29 човина. Для видалення етаноламін-гідрохлоридної солі, суспензію перетирають з 500 мл води і фільтрують у вакуумі. Тверду речовину промивають етанолом і етером, потім сушать, отримуючи бажаний продукт (75 г, 89%). 1 Н ЯМР (300МГц, ДМСО-d6) м. д. 3,55-3,60 (m, 2H) 3,69-3,74 (m, 2H) 6,75 (dd, J=7,63, 8,52 Гц, 2H) 7,90 (dd, J=7,63, 1,76 Гц, 2H) 8,27 (dd, J=8,52, 1,76 Гц, 1H) 3,35 (m, 1H) Операція d): інтермедіат 12 Синтез 3-аміно-2-[(2гідроксиетил)аміно]бензонітрилу Метанол (500 мл) і Pd/активоване вугілля 5% (вологе, 3,45 г) додають до 2-[(2гідроксиетил)аміно]-3-нітробензонітрилу (69 г, 0,333 моль). Суспензію струшують в апараті Парра при 20 фунт/кв. дюйм (0, 14 ат) гідрогену протягом 1 год. Суміш фільтрують на целіті і випаровують до сухості, отримуючи бажаний матеріал (62,7 г), який використовують без очищення. 1 Н ЯМР (300МГц, MeOD) м. д. 3,41 (t, J=5,43 Гц, 2Н) 3,70 (t, J=5,43 Гц, 2Н) 6,75 (t, J=7,71 Гц, 1Н) 6,87 (dd, J=7,71, 1,61 Гц, 1Н) 6,92 (dd, J=7,71, 1,61 Гц, 1Н). Операція e): інтермедіат 13 Синтез 1-(2-гідроксиетил)-1H-бензімідазол-7карбонітрилу 3-аміно-2-[(2-гідроксиетил)аміно]бензонітрил (38 г, сирий), розчиняють у мурашиній кислоті (150 мл) і перемішують під зворотним холодильником протягом 1 год. Реакційну суміш концентрують до сухості під зниженим тиском, отримуючи темну тверду речовину, яку розчиняють у 200 мл метанолу з нагріванням, додають 60 мл триетиламіну і витримують під зворотним холодильником протягом 1 год. Суміш концентрують у вакуумі і осад фільтрують і промивають водою, потім сушать, отримуючи бажану сполуку (27 г, 70% з інтермедіату 11). 1 Н ЯМР (300 МГц, ДМСО-d6) м. д. 3,79 (dt, J=5,14 Гц, 2Η) 4,51 (t, J=5,14 Гц, 2Н) 5,04 (t, J=5,14 Гц, 1Н) 7,34 (dd, J=7,63, 0,77 Гц, 1Н) 7,74 (dd, J=7,63, 0,77 Гц) 8,02 (dd, J=7,73, 0,77 Гц) 8,36 (s, 1H). Операція f): інтермедіат 14 Синтез (7-ціано-1Н-бензімідазол-1-іл)оцтової кислоти 1-(2-гідроксиетил)-1Н-бензімідазол-7карбонітрил (61,4 г, 0,328 моль) розчиняють в ацетонітрилі (1,2 л) і натрійфосфатному буфері (930 мл, рН 6,8) і суміш нагрівають при 40°С. Додають TEMPO (3,6 г 22,7 моль) і твердий NaCIO2 (148,3 г 85%, 1,31 моль) протягом 3 год. Додають розчин NaOCI (1,65M, 50 мл) до досягнення реакційною сумішшю темноко-ричневого кольору. Суміш залишають перемішуватись протягом 16 год. при 45°С. Надлишок оксиданту гасять (у льодяній ванні) твердим Na2SO3, додаючи до повного знебарвлення реакційної суміші. На цій стадії утворюється осад, який містить бажані продукти і неорганічні солі. Осад фільтрують і розчиняють у 500 мл води. Отриманий розчин підкислюють до рН 2 доданням НСІ 6N. Осад 96764 30 фільтрують і промивають водою, отримуючи бажаний продукт (12,7 г, 19%). Водну фазу з реакційною сумішшю підкислюють НСІ 6N до рН 2 і утворену тверду речовину фільтрують, промивають водою і сушать, отримуючи бажаний продукт (43,0 г, 65%). Ацетонітрил з органічної фази випаровують, отримуючи суспензію сирого продукту у воді, яку очищають розчиненням розчином NaOH (50%), промивають AcOEt і осаджують НСІ 6N до рН 6, отримуючи бажаний продукт (4,2 г, 6%), (59,9 г, загальний вихід 90%). 1 Н ЯМР (300МГц, ДМСО-d6) м. д. 5,31 (s, 2H) 7,36 (t, J=7,78 Гц, 1Н) 7,74 (dd, J=1,03, 7,78 Гц, 1H) 8,03 (dd, J=1,03, 7,78 Гц, 1H) 8,37(s, 1H) Схема 4 : Синтез 7-ацетил-1Н-бензімідазол-1іл)оцтова кислота Операція а): інтермедіат 15 Синтез 1-[1-(2-гідроксиетил)-1Н-бензімідазол7-іл]етанону Розчин 1-(2-гідроксиетил)-1Н-бензімідазол-7карбонітрилу (0,29 г, 1,5 ммоль) у сухому ТГФ (6,2 мл) охолоджують до -78°С і повільно додають MeLi (5,8 мл. 9,3 ммоль). Після додання реакційну суміш залишають нагрітись до зовнішньої температури і витримують 30 хвил. Температуру знижують до -78°С і повільно додають воду (4 мл). Після нагрівання реакційну суміш підкислюють до рН 4 і гріють при 50°С 30 хвил. Розчинники видаляють під зниженим тиском і залишок розподіляють між ацетатом і водним NaHCO3. Органічний екстракт промивають водою і розсолом, сушать над Na2SO4 і концентрують. Очищення проводять на флешкремнеземній колонці з елюентом етилацетатметанол, отримуючи бажаний продукт (0,25 г, 80%). 1 Н ЯМР (400 МГц, ДМСО-D6) м. д. 2,67 (s, 3H) 3,51 (q, J=5,1 Гц, 2Н) 4,41 (t, J=5,3 Гц, 2H) 4,77 (t, J=5,1 Гц, 1H) 7,29 (t, J=7,8 Гц, 1H) 7,78 (dd, J=7,6, 1,0 Гц, 1H) 7,88 (dd, J=8,1, 1,0 Гц, 1H) 8,20 (s, 1H). Операція b): інтермедіат 16 Синтез (7-ацетил-1Н-бензімідазол-1-іл)оцтової кислоти 1-[1-(2-гідроксиетил)-1Н-бензімідазол-7іл]етанон (0,30 г, 1,47 ммоль) окислюють до бажаної кислоти згідно з процедурою, описаною для синтезу (7-ціано-1Н-бензімідазол-1-іл)оцтової кислоти (операція f, інтермедіат 14), отримуючи бажаний продукт (0,24 г, 75%). 1 Н ЯМР (400 МГц, Метанол-D4) м. д. 2,64 (s, 3H) 5,34 (s, 2Н) 7,46 (t, J=7,81 Гц, 1Н) 7,90-7,99 (m, J=6,84, 6,84 Гц, 2Н) 8,56 (s, 1H). Схема 5: Синтез (7-флуор-1Н-бензімідазол-1іл)оцтової кислоти 31 Операція а): інтермедіат 17 Синтез 2-[(2-флуор-6нітрофеніл)аміно]етанолу 2,3-дифлуорнітробензол (15 г, 94,3 ммоль) розчиняють у 200 мл етанолу. Додають етаноламін (11,4 мл, 188,7 ммоль, 2 екв.) і суміш перемішують при кімнатній температурі протягом ночі (завершення реакції перевіряють ТРХ). Етанол випаровують і отриманий залишок розчиняють в етилацетаті, промивають водою (для видалення надлишку етаноламіну), сушать над сульфатом магнію, фільтрують і випаровують до сухості, отримуючи бажаний продукт оранжеве масло (18,3 г, 97%). Цей сирий матеріал використовують без очищення. 1 Н-ЯМР (400МГц, CD3OD) 3,61-3,68 (m, 2H) 3,69-3,76 (m, 2H) 4,88 (s, 2H) 6,61-6,67 (m, 1Н) 7,27 (ddd, J=14,16, 7,91, 1,56 Гц, 1Н) 7,91 (dt, J=8,69, 1,51 Гц, 1Н). МС [М+Н], обчисл.: 201, отрим.: 201 Операція b): інтермедіат 18 Синтез 2-(7-флуор-1H-бензімідазол-1іл)етанолу 2-[(2-флуор-6-нітрофеніл)аміно]етанол (18,3 г, 91,5 ммоль) розчинений у 90 мл мурашиної кислоти додають до суспензії Pd-C 10% (300 мг) у 10 мл мурашиної кислоти. Суміш струшують в апараті Парра під атмосферним тиском Н2 протягом ночі. Реакційну суміш фільтрують через целіт, розчинник випаровують у вакуумі і отриманий залишок розчиняють у NH3 2M в етанолі. Цей розчин перемішують при кімнатній температурі 1 год. (щоб відщепити адукт мурашиної кислоти). Утворюється осад. Суміш випаровують до сухості і очищають колонною хроматографією (SiO2, ДХМ/МеОН 10:15:1), отримуючи бажаний продукт як білу тверду речовину (10,5 г, 64%) ТРХ: ДХМ/МеОН 5:1, Rf=0,23. 1 Н ЯМР (400 МГц, CD3OD) 3,86-3,95 (m, 2H) 4,46 (t, J=5,27 Гц, 2Н) 7,03 (dd, J=11,72, 8,01 Гц, 1H) 7,21 (td, J=8,11, 4,88 Гц, 1H) 7,47 (d, J=7,81 Гц, 1H) 8,13 (s, 1H). МС [М+Н], обчисл.: 181, отримано: 181. Операція с): інтермедіат 19 Синтез (7-флуор-1Н-бензімідазол-1-іл)оцтової кислоти 2-(7-флуор-1Н-бензімідазол-1-іл)етанол (706 мг, 3,92 ммоль) суспендують у 20 мл ацетонітрилу і 15 мл натрійфосфатного буфера 1М (рН 6,5). Суміш нагрівають до 35°С. Додають TEMPO (43 мг, 0,27 ммоль), потім NaCIO2 (80%, 887 мг, 7,84 ммоль), розчинений у 4 мл води і розріджений від 96764 32 білювач (2 мл 0,4%-го водного розчину). Реакційна суміш стає червоно-коричневою після додання відбілювача. Для завершення реакції, якщо потрібно, додають ще TEMPO (22 мг), NaCIO2 (440 мг у 2 мл води) і розріджений відбілювач (1 мл) і суміш перемішують 6 год. при 35°С. Після охолодження до кімнатної температури реакцію гасять доданням насиченого водного Na2SO3 (5 мл). Червонокоричневий колір зникає. рН доводять до 8-9 доданням NaOH 2M і суміш промивають етилацетатом (2х). Органічний шар відкидають і водну фазу підкислюють НСІ 1М (до рН 3). Бажаний продукт кристалізують у водній фазі як білу тверду речовину (537 мг, 70%). ТРХ: ДХМ/метанол 10:1 + 5% триетиламін, Rf=0,33 (s.m.: Rf=0,56) 1 Н ЯМР (400 МГц, CD3OD) 5,19 (s, 2H); 7,05 (dd, J=11,52, 8,20 Гц, 1Н); 7,24 (td, J=8,15, 4,98 Гц, 1Н); 7,49 (d, J=8,20 Гц, 1Н); 8,19 (s, 1H). МС [М+Н], обчисл.: 196, отримано: 195 Схема 6. Синтез [4-(1-аміноетил)феніл]-2метилпропаннітрил Операція а): інтермедіат 20 Синтез 2-(4-бромфеніл)-2метилпропаннітрилу. "Приготування 2-(4-бромфеніл)-2метилпропаннітрилу виконують, як описано у J. Med. Chem. (1995), no 38, p. 1608-1628. Гідрид натрію (60%-на сусп. у маслі, 6,66 г, 166,3 ммоль) додають порціями протягом 1 год. до 2-(4бромфеніл)-ацетонітрилу (10 г, 51,0 ммоль), розчиняють у безводному ДМФ і метилйодиді (14,838 г, 102,0 ммоль) при 0°С. Цей розчин перетворюється у густу коричнево-оранжеву пасту, яку залишають перемішуватись і повільно нагріватись до кімнатної температури (18 год.). Органічний розчин розподіляють між водою і етилацетатом, відділяють, сушать над безводним сульфатом натрію і фільтрують. Розчин концентрують під зниженим тиском і отриманий сирий продукт очищають на силікагелі з градієнтом 020% етилацетату у гексані, отримуючи бажану сполуку (4,9 г, 42%) як прозоре масло. 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-D) м. д. 1,71 (s, 6H) 7,35 (d, J=8,79 Гц, 2Н) 7,52 (d, J=8,79 Гц, 2Н). Операція b): інтермедіат 21 Синтез 2-(4-ацетилфеніл)-2метилпропаннітрилу 33 2-(4-бромфеніл)-2-метилпропаннітрил (1 г, 4,46 ммоль) розчиняють у безводному ТГФ (75 мл) розчин охолоджують до -100°С у ванні з діетилетером-рідким нітрогеном, додають n-бутиллітій 2М у с-гексані (4,0 мл, 8,0 ммоль) і цю реакційну суміш перемішують 10 хвил., потім додають Nметокси-N-метилацетамід (1,6 г, 15,6 ммоль) і реакцію залишають повільно нагрітись до кімнатної температури. Після обробки (промивання кислим розсолом) і концентрування сиру суміш очищають на силікагелі з градієнтом 050% етилацетату у гексані, отримуючи бажану сполуку (660 мг, 78%) як прозоре масло. 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-D) м. д. 1,76 (s, 6H) 2,62 (s, 3H) 7,59 (d, J=8,79 Гц, 2H) 7,99 (d, J=8,79 Гц, 2Н). Операція с): інтермедіат 22 Синтез 2-[4-(1-аміноетил)феніл]-2метилпропаннітрилу Приготування 2-[4-(1-аміноетил)феніл]-2метилпропаннітрилу виконують згідно з загальною процедурою, описаною у Tetrahedron (2004), nо 60, р. 1463-1471. Ацетофенон, 2-(4-ацетилфеніл)-2метилпропаннітрил (600 мг, 3,21 ммоль) розчиняють у 28%-му амонії в етанольному розчині (20,0 мл). Додають ізопропоксид титану (1,82 г, 6,42 ммоль) і реакційну суміш залишають перемішуватись на 18 год. при кімнатній температурі. Додають боргідрид натрію двома порціями і залишають перемішуватись на 3 год. Прозорий розчин повільно стає сірим, потім білим. Додають воду і оксид титану видаляють фільтруванням. Органічний розчин розподіляють між водою і етилацетатом, сепарують, сушать над безводним сульфатом натрію і фільтрують. Розчин концентрують під зниженим тиском, отриманий залишок розчиняють у діетилетері, фільтрують і додають НСІ в етері. Отриманий осад фільтрують потім сушать, отримуючи бажаний продукт як сіль НСІ (500 мг, 69%) у вигляді жовтої твердої речовини. 1 Н ЯМР (400 МГц, МЕТАНОЛ-D4) м. д. 1,61 (d, J=6,90 Гц, 3H) 1,70 (s, 6H) 4,46 (q, J=6,90 Гц, 1Н) 7,49 (dt, J=8,64, 2,34, 2,10Гц, 2Н) 7,60 (dt, J=8,64, 2,10 Гц, 2Н), МС [М+Н] обчисл.: 189,1, отримано: 189,3 Схема 7: Синтез 2-(4-(1-аміноетил)-2флуорфеніл)-2-метилпропаннітрилу 96764 34 Операція а: інтермедіат 23 Синтез 2-(4-бром-2-флуорфеніл)-2метилпропаннітрилу 2-(4-бром-2-флуорфеніл)-2метилпропаннітрил приготовляють з (4-бром-2флуор-феніл)ацетонітрилу (10 г, 51,0 ммоль) за процедурою, описаною для інтермедіату 20. Вихід бажаного продукту - 11 г (89%) як сирого блідожовтого масла, яке не потребує очищення. 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-D) м. д. 1,77 (d, J=0,78 Гц, 6H) 7,24-7,40 (m, 3H). Операція b: інтермедіат 24 Синтез 2-(4-ацетил-2-флуорфеніл)-2метилпропаннітрилу 2-(4-ацетил-2-флуорфеніл)-2метилпропаннітрил приготовляють з (4-бром-2флуорфеніл)ацетонітрилу (5,0 г, 21,0 ммоль) за процедурою, описаною для інтермедіату 21. Вихід - 4,15 г (99%) як сирого жовтого масла, яке не очищають після обробки. 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-D) м. д. 1,79-1,81 (m, 6H) 2,58 (s, 3H) 7,60 (t, J=7,91 Гц, 1Н) 7,65 (dd, J=12,40, 1,46 Гц, 1Н) 7,72 (dd, J=8,11, 1,86 Гц, 1Н). Операція с: інтермедіат 25 Синтез 2-(4-(1-аміноетил)-2-флуорфеніл)-2метилпропаннітрилу 2-(4-(1-аміноетил)-2-флуорфеніл)-2метилпропаннітрил приготовляють з сирого (4ацетил-2-флуорфеніл)ацетонітрилу (2,4 г, 11,7 ммоль) за процедурою, описаною для інтермедіату 22. Вихід як солі НСІ (2,1 г, 67%) у вигляді сирого блідожовтого масла, яке не потребує очищення після обробки. 1 Н ЯМР (400 МГц, ДМСО-D6) м. д. 1,19 (d, J=6,44 Гц, 3H) 1,67 (s, 6Н) 1,95 (s, 3H) 3,95 (q, J=6,44 Гц, 1Н) 7,19 (dd, J=8,11, 1,66 Гц, 1Н) 7,26 (dd, J=13,48, 1,56 Гц, 1Н) 7,34 (t, J=8,30 Гц, 1Н), МС [М+Н] обчисл.: 207,13, отримано: 207,15 Схема 8: Синтез 2-(4-(амінометил)-2флуорфеніл)-2-метилпропаннітрилу Операція а: інтермедіат 26 Синтез 2-(4-форміл-2-флуорфеніл)-2метилпропаннітрилу 2-(4-форміл-2-флуорфеніл)-2метилпропаннітрил приготовляють з (4-бром-2флуорфеніл)ацетонітрилу (5,2, 21,5 ммоль) і Nметокси-N-метилформаміду (3,8 г, 43,0 ммоль) за процедурою, описаною для інтермедіату 21. Отриманий продукт використовується у наступній операції. 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-D) м. д. 1,82 (s, 3H), 1,81 (s, 3H) 7,59 (dd, J=11,62, 1,07 Гц, 1H) 7,65-7,74 (m, 2H) 9,97 (d, J=1,95 Гц, 1H). Операція b: інтермедіат 27 Синтез 2-(4-(амінометил)-2-флуорфеніл)-2метилпропаннітрилу 35 2-(4-(1-аміноетил)-2-флуорфеніл)-2метилпропаннітрил приготовляють з сирого (4ацетил-2-флуорфеніл)ацетонітрилу (сирий 26) за загальною процедурою, описаною для інтермедіату 22, отримуючи бажаний продукт як сіль НСІ (1,2 г, 16% для операцій а і b) у вигляді сирого блідожовтого масла, яке не потребує очищення після обробки. 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-D) 1,77 (s, 6Н) 4,13 (s, 2Н) 7,31 (d, J=10,55 Гц, 2Н) 7,58 (t, J=8,11 Гц, 1Н) МС [М+Н] обчисл.: 193,1, отримано: 193,3 Схема 9: Синтез 1-[4-(1аміноетил)феніл]циклобутанкарбонітрилу Операція а: інтермедіат 28 Синтез 4-(1-ціаноциклобутил)бензонітрилу Твердий KHMDS (3,48 г, 17,5 ммоль) розчиняють у ТГФ (20,0 мл) і охолоджують 0°С. Додають циклобутанкарбонітрил (1,42 г, 17,5 ммоль) і отриманий розчин перемішують для 40 хвил. Додають розчин 4-флуорбензонітрил (2,12 г, 17,5 ммоль) у ТГФ (10,0 мл) і суміш перемішують 2 год. при 0°С. Додають 1N НСІ (50,0 мл) і реакційний суміш і водну фазу екстрагують EtOAc (4x40,0 мл). Об'єднані органічні фази сушать над MgSO4, фільтрують і концентрують роторним випарювачем. Продукт очищають флеш-хроматографією (CombiFlesh), елюент - суміш гептан і EtOAc (0% EtOAc40% EtOAc). Вихід - 1,76 г (9,67 ммоль, 55%). 1 Н ЯМР (400 МГц, ДМСО-D6) м. д. 1,92-2,12 (m, 1H) 2,19-2,37 (m, 1H) 2,57-2,69 (m, 2Н) 2,712,82 (m, 2Н) 7,67 (d, J=8,59 Гц, 2H) 7,91 (d, J=8,79 Гц, 2Н). Операція b: інтермедіат 29 Синтез 1-[4-(1аміноетил)феніл]циклобутанкарбонітрил 4-(ціаноциклобутил)бензонітрил (335 мг, 1,84 ммоль) змішують з ТГФ (10,0 мл) і охолоджують 78°С під N2. Додають MeLi (1,15 мл, 1,84 ммоль, 1,60М у Et2O) і суміш перемішують при -78°С 15 хвил. Додають суміш NaBH4 (70,0 мг, 1,84 ммоль) у МеОН (10,0 мл) і розчин нагрівають до 0°С протягом 1 год. Додають 1N НСІ (40,0 мл) і розчин концентрують до сухості на роторному випарювачі. Продукт очищають РХВР: насоси Gilson prep, потік: 30 мл/хвил., колонка: Synergi Gemini (5 мкм) 21,2x50 мм (високий рН), мобільна фаз: А=вода (10 мМ NH4CO3) В=MECN, (95,0 мг, 0,475 ммоль, 26%). 1 Н ЯМР (400 МГц, ДМСО-D6) м. д. 1,23 (d, J=6,64 Гц, 3H) 1,90-2,06 (m, 1H) 2,16-2,35 (m, 1H) 2,52-2,64 (m, 2H) 2,64-2,78 (m, 2H) 4,00 (q, J=6,64 Гц, 1Н) 7,36 (d, J=8,59 Гц, 2H) 7,42 (d, J=8,20 Гц, 2Н). 96764 36 Схема 10: Синтез аміноетил)феніл]циклопропілкарбонітрил 1-[4-(1 Операція а: інтермедіат 30 Синтез 4-(1-ціаноциклопропіл)бензонітрил Твердий KHMDS (6,82 г, 34,3 ммоль) розчиняють у ТГФ (60,0 мл) і охолоджують 40°С. Додають циклопропанкарбонітрил (2,30 г, 34,3 ммоль) і отриманий розчин перемішують 30 хвил. Додають розчин 4-флуорбензонітрилу (4,15 г, 34,3 ммоль) у ТГФ (20,0 мл) і суміш перемішують 20 хвил. при 40°С і потім ще 2 год. при кімнатній температурі. Додають насичений розчин NaHCO3 (50,0 мл) і водну фазу екстрагують EtOAc (4x40,0 мл). Об'єднані органічні фази сушать над MgSO4, фільтрують і концентрують на роторному випарювачі. Продукт очищають флеш-хроматографією (CombiFlesh), елюент - суміші гептанів і EtOAc (0%EtOAc70% EtOAc) (743 мг, 4,42 ммоль, 13%). 1 Н ЯМР (400 МГц, ДМСО-D6) м. д. 1,60-1,67 (m, 2H) 1,84-1,90 (m, 2H) 7,49 (d, J=8,59 Гц, 2H) 7,85 (d, J=8,79 Гц, 2Н). Операція b: інтермедіат 31 Синтез 1-[4-(1аміноетил)феніл]циклопропілкарбонітрилу 4-(ціаноциклопропіл)бензонітрил (132 мг, 0,786 ммоль) змішують ТГФ (10,0 мл) і охолоджують до 78°С під N2 (газ). Додають MeLi (0,639 мл, 1,02 ммоль, 1,60М у Et2O) і суміш перемішують при 78°С 60 хвил. Додають суміш NaBH4 (39,0 мг, 1,02 ммоль) у МеОН (10,0 мл) і розчин нагрівають до 0°С протягом 1 год. Додають 1N НСІ (40,0 мл) і розчин концентрують до сухості на роторного випарювача. Продукт очищають РХВР: насоси Gilson prep, потік: 30 мл/хвил., колонка Synergi Gemini (5 мкм) 21,2x50 мм (високий рН), мобільна фаза: А=вода (10 мМ NH4CO3) В=MECN, (23,0 мг, 0,0623 ммоль, 14%). 1 Н ЯМР (400 МГц, ДМСО-D6) м. д. 1,32 (d, J=6,64 Гц, 3H) 1,42-1,51 (m, 2H) 1,66-1,77 (m, 2H) 4,09-4,20 (m, J=6,84 Гц, 1H) 7,30 (d, J=8,59 Гц, 2Н) 7,42 (d, J=8,20 Гц, 1Н). Схема 11: Синтез 1-[4-(1аміноетил)феніл]циклогексилкарбонітрил Операція а: інтермедіат 32 Синтез 4-(1-ціаноциклогексил)бензонітрил 37 96764 38 Твердий KHMDS (4,36 г, 22,0 ммоль) розчиняють у ТГФ (80,0 мл) і охолоджують до 0°С. Додають циклогексанкарбонітрил (2,38 г, 22,0 ммоль) і отриманий розчин перемішують 40 хвил. Додають розчин 4-флуорбензонітрилу (1,33 г, 10,95 ммоль) у ТГФ (10,0 мл) і суміш перемішують 2 год. при 0°С і 10 год. при кімнатній температурі. 1N НСІ (50,0 мл) і водну фазу екстрагують EtOAc (4x50,0 мл). Об'єднані органічні фаз сушать над MgSO4, фільтрують і концентрують на роторному випарювачі. Продукт очищають флеш-хроматографією (CombFlesh), елюент суміш гептанів і EtOAc (0% EtOAc30% EtOAc) (1,55 г, 7,38 ммоль, 67%). 1 Н ЯМР (400 МГц, ДМСО-D6) 1/млн. 1,231,38 (m, 1H) 1,52-1,68 (m, 2Н) 1,68-1,78 (m, 1Н) 1,78-1,93 (m, 4Н) 2,00-2,11 (m, 2Н) 7,75 (d, J=8,79 Гц, 2Н) 7,91 (d, J=8,79 Гц, 2Н). Операція b: інтермедіат 33 Синтез 1-[4-(1аміноетил)феніл]циклогексилкарбонітрилу 4-(ціаноциклогексил)бензонітрил (1,55 г, 7,38 ммоль) змішують з ТГФ (40,0 мл) і охолоджують до -78°С під N2 (газ). Додають MeLi (9,23 мл, 14,8 ммоль, 1,60М у Et2O) і суміш перемішують при 78°С 60 хвил. Додають суміш NaBH4 (558 мг, 14,8 ммоль) у МеОН (40,0 мл) і розчин нагрівають 0°С протягом 2 год. Додають 1N НСІ (50,0 мл) і розчин концентрують до сухості на роторному випарювачі. Продукт очищають РХВР: насоси Gilson prep, потік 30 мл/хвил., колонка Synergi Gemini (5 мкм) 21,2x50 мм (високий рН), мобільна фаза: А=вода (10 мМ NH4CO3) В=MECN, (510 мг, 2,24 ммоль, 30%). 1 Н ЯМР (400 МГц, ДМСО-D6) м. д. 1,22 (d, J=6,64 Гц, 3H) 1,25-1,34 (m, 1H) 1,52-1,68 (m, 2H) 1,69-1,76 (m, 1H) 1,76-1,88 (m, 4H) 1,99-2,07 (m, 2H) 3,96 (q, J=6,51 Гц, 1Н) 7,37-7,45 (m, 4H). Схема 12: Синтез (7-хлор-6-флуор-1Нбензімідазол-1-іл)оцтової кислоти Операція а: інтермедіат 34 2-[(2-хлор-3-флуор-6-нітрофеніл)аміно]етанол 2-хлор-1,3-дифлуор-4-нітробензол (5,37 г, 27,7 ммоль), етаноламін (1,69 г, 27,7 ммоль) і Et3N (2,80 г, 27,7 ммоль) перемішують у EtOH (40,0 мл) при кімнатній температурі 2 год. Розчинник потім випаровують і отриманий залишок суспендують у EtOAc (50,0 мл) і промивають 0,5N NaOH (50,0 мл). Водну фазу екстрагують 4 рази EtOAc (4x50,0 мл). Об'єднані органічні фази сушать MgSO4, фільтрують і концентрують. Продукт очищають флеш-хроматографією на силікагелі, елюент - суміші гептану і EtOAc (5,53 г, 85%). 1 Н ЯМР (400 МГц, ДМСО-D6) м. д. 3,39 (dd, J=10,55, 5,27 Гц, 2Н) 3,53 (t, J=5,47 Гц, 2Н) 4,89 (s, 1Н) 6,89 (dd, J=9,37, 8,01 Гц, 1Н) 7,19 (t, J=4,69 Гц, 1Н) 8,01 (dd, J=9,47, 5,96 Гц, 1Н). Операція b: інтермедіат 35 2-[(6-аміно-2-хлор-3флуорфеніл)аміно]етанол. 2-[(2-хлор-3-флуор-6-нітрофеніл)аміно]етанол (5,52 г, 22,7 ммоль) розчиняють у МеОН (40,0 мл). Додають приготовлений розчин Na2S2O4 (13,8 г, 79,5 ммоль) у воді (40,0 мл) до першого розчин. Отриманий розчин перемішують 5 хвил. при 60°С і потім 2 год. при кімнатній температурі. Розчинники випаровують і отриманий залишок суспендують у насичений розчин NaHCO3 (40,0 мл). водну фаз екстрагують 4 рази EtOAc (4x40,0 мл). Об'єднані органічні фази сушать з MgSO4, фільтрують і кон центрують. Продукт є достатньо чистим згідно з Н ЯМР (2,07 г, 45%). 1 Н ЯМР (400 МГц, ДМСО-D6) м. д. 2,99 (m, 2H) 3,32 (s, 1H) 3,48 (t, J=5,57 Гц, 2Н) 4,09 (s, 1H) 4,73-4,95 (m, 2H) 6,55 (dd, J=8,79, 5,66 Гц, 1H) 6,71 (t, J=8,89 Гц, 1H). Операція с: інтермедіат 36 2-(7-хлор-6-флуор-1Н-бензімідазол-1іл)етанол 2-[(6-аміно-2-хлор-3-флуорфеніл)аміно]етанол (2,07 г, 10,2 ммоль) розчиняють у мурашиній кислоті (50,0 мл), і отриманий розчин нагрівають до 100°С протягом 1 год. Розчин охолоджують до кімнатної температури і потім випаровують до сухості. Залишок суспендують у NH3 (50,0 мл, 2N у EtOH) і перемішують протягом 1 год. Розчин концентрують до сухості і залишок суспендують в EtOAc (50,0 мл). Органічну фазу промивають 2N NaOH (50,0 мл) і отриману водну фаз екстрагують 4 рази EtOAc (4x50,0 мл). Об'єднані органічні фази сушать MgSO4, фільтрують і концентрують. Продукт розчиняють у EtOAc, фільтрують і рекристалізують з EtOAc (895 мг, 41%). 1 Н ЯМР (400 МГц, ДМСО-D6) м. д. 3,74 (t, J=5,27 Гц, 2H) 4,52 (t, J=5,47 Гц, 2Н) 4,99 (s, 1H) 7,25 (dd, J=10,16, 8,79 Гц, 1Н) 7,64 (dd, J=8,79, 4,49 Гц, 1Н) 8,21 (s, 1H). Операція d: інтермедіат 37 (7-хлор-6-флуор-1H-бензімідазол-1-іл)оцтова кислота 1 39 96764 40 1 2-(7-хлор-6-флуор-1Н-бензімідазол-1іл)етанол (550 мг, 2,57 ммоль) розчиняють у АсОН (20,0 мл). Додають краплями реагент Jones (3,31 мл, 3,00 ммоль, 0,907М) і розчин перемішують 1 год. при кімнатній температурі. Розчин розріджують iPrОН (50,0 мл) і розчинник випаровують. Додають 6N NaOH до рН 11. Водну фазу промивають EtOAc (50,0 мл) і органічну фазу екстрагують 3 рази водою (3x50,0 мл). Об'єднані водні фази підкислюють 12N НСІ до рН 3. Водну фазу екстрагують 4 рази EtOAc (4x50,0 мл). Об'єднані органічні фази сушать MgSO4, фільтрують і концентрують. Продукт достатньо чистим (згідно з Н ЯМР) (236 мг, 40%). 1 Н ЯМР (400 МГц, ДМСО-D6) м. д. 5,18 (s, 2H) 7,24 (dd, J=10,16, 8,79 Гц, 1Н) 7,64 (dd, J=8,79, 4,49 Гц, 1Н) 8,13-8,30 (m, 1H). Реагент Джонса приготовляють, змішуючи 997 мг СrО3 у 1,00 мл H2SO4 і 10,0 мл води. В іншому варіанті приготування (7-хлор-6флуор-1Н-бензімідазо-1-іл)оцтової кислоти виконуються такі операції. Операція 1. Синтез N-(2-хлор-3-флуор-6нітрофеніл)-гліцин-метил-естер У тригорлу круглодонну колбу, обладнану нітрогенним барботером і термометром вносять K2СО3 (40,0 г, 289,3 ммоль), гліцин-метил-естергідрохлорид (17,4 г, 138,8 ммоль) і 2-пропанол (200 мл). Отриману суміш перемішують при кімнатній температурі протягом 1 год. Додають 3-хлор-2,4дифлуорнітробензол (22,4 г, 115,7 ммоль, 1 екв.) і реакційна суміш перетворюється у жовтий шлам, який перемішують при кімнатній температурі протягом 18 год. Моніторинг реакційної суміші прово1 дять Н ЯМР-спектроскопією. Після підтвердженого завершення реакції суміш розріджують іРrОАс (560 мл) і 1М НСІ (225 мл) і краплями додають до раніше отриманої суміші (з контролем вивільнення СО2) з енергійним перемішуванням. Темножовтий шлам перетворюється у прозорий безбарвний біфазний розчин. Органічний шар сепарують і промивають 1М НСІ (3x100 мл), потім сушать над MgSO4, фільтрують і фільтрат випаровують до сухості на роторному випарювачі, отримуючи сирий продукт як жовту тверду речови1 ну, (29,1 г), дуже чисту (згідно з Н ЯМР). 1 Н ЯМР (400 МГц, CDCI3) : 8,08 (ddd, 1H), 6,7 (m, 1H), 4,35 (s, 2H), 3,8 (s, 3H). Реакційну суміш спостерігають, відбираючи аліквоту реакційної суміш у iPrОАс, гасячи її 1N НСІ і потім відділяючи і випаровуючи органічний шар до сухості і аналізуючи отриману жовту твер1 ду речовину Н ЯМР. Операція 2. Перетворення N-(2-хлор-3-флуор6-нітрофеніл)-гліцин метил-естеру у у гідрохлорид (7-хлор-6-флуор-1Н-бензімідаго-1-іл)оцтової кислоти У гідрогенувальну колбу Парра вносять N-(2хлор-3-флуор-6-нітрофеніл) гліцин ме-тил-естер (15 г, 60,8 ммоль) з мурашиною кислотою (150 мл). Суміш нагрівають до ~50°С, отримуючи прозорий розчин, який охолоджують до кімнатної температури. До цього розчину додають 5% Pd-C (0,6 г, 4% за масою) і реакційну суміш гідрогенують при 40 фунт/кв. дюйм (0,28 ат) протягом 3 год. Завершен1 ня реакції підтверджується Н ЯМР. Проводять таку ж реакцію, використовуючи 12,3 г (49,8 ммоль) N-(2-хлор-3-флуор-6нітрофеніл) гліцин метил-естеру, 125 мл мурашиної кислоти і 0,5 г каталізатор. Після підтвердження завершення реакції реакційну суміш з наведених вище двох експериментів фільтрують через керамічну воронку і подушку з целіту. Фільтрувальний осад промивають гарячою мурашиною кислотою (60°С) до знебарвлення фільтрату. Фільтрат випаровують до сухості під зниженим тиском і коричневий осад сушать у вакуумній печі при 60°С протягом 3 год., отримуючи коричневу тверду речовину. (24,2 г). Гідрогенування дає суміш продуктів, яку перетворюють у бензімідазол за наступною процедурою: Отриманий сирий матеріал розчиняють у мурашиній кислоті (242 мл) і конц. НСІ (242 мл). Суміш нагрівають до флегми і витримують 2 год. Піс1 ля підтвердження завершення реакції ( Н ЯМР) реакційну суміш випаровують до сухості на роторному випарювачі. Твердий залишок вносять у 300 мл MeCN і отримують шлам, який концентрують до сухості. Коричневий твердий залишок перетирають з 300 мл MeCN при кімнатній температурі протягом 1 год. Тверду речовину збирають фільтруванням і сушать у вакуумній печі при 60°С протягом 18 год., отримуючи бажаний продукт (23,2 г, 79%) як гідрохлоридну сіль. 41 96764 42 Н ЯМР (400 МГц, ДМСО-d6): 9,25 (s, 1H), 7,83 (dd, 1H), 7,52 (t, 1H), 5,5 (s, 2H). Операція 3. Ізолювання бажаної (7-хлор-6флуор-1Н-бензімідазол-1-іл)оцтової кислоти Гідрохлоридну сіль бажаної кислоти (5 г) суспендують у воді (25 мл) з обережним перемішуванням. Краплями додають 2М NaOH до повного розчинення всіх матеріалів, отримуючи прозорий коричневий розчин, який промивають EtOAc (2x25 мл). Водний шар відділяють і підкислюють доданням краплями 1М НСІ до рН реакційної суміші ~4,2. Утворену суспензію охолоджують до 0-5°С зануренням у льодо-водяну ванну і витримують 1 год. з обережним перемішуванням. Тверду речовину збирають фільтруванням і фільтрувальний осад сушать повітрям протягом доби, отримуючи бажаний продукт 37 як світлокоричневу тверду речовину (2,5 г, 60%). Схема 13: Синтез (6-хлор-7-флуор-1Нбензімідазол-1-іл)оцтової кислоти Операція а: інтермедіат 38 2-(6-хлор-7-флуор-1H-бензімідазол-1-іл)етилформат 1,3-дихлор-2-флуор-4-нітробензол (9,70 г, 46,2 ммоль) і етаноламін (7,05 г, 231,0 ммоль) перемішують у EtOH (25,0 мл) при 60°С протягом 24 год. Розчинник випаровують і отриманий залишок розчиняють у МеОН (150,0 мл). Додають приготовлений розчин Na2S2O4 (23,7 г, 136,4 ммоль) у воді (100 мл). Отриманий розчин перемішують протягом 30 хвил. при 60°С. Розчинники випаровують і отриманий залишок суспендують у насиченому розчині NaHCO3 (40,0 мл). Водну фазу екстрагують 4 рази EtOAc (4x100,0 мл). Об'єднані органічні фази фільтрують і концентрують. Отриманий сирий матеріал нагрівають при 100°С у мурашиній кислоті (60,0 мл) протягом 3 год., потім перемішують при кімнатній температурі протягом 18 год. Реакційну суміш концентрують під зниженим тиском до отримання залишку. Додають конц. розчин бікарбонату натрію (10 мл) і екстрагують етилацетатом (3x100 мл). Об'єднані органічні фази сушать над MgSO4, фільтрують і концентрують. Отриману тверду речовину перетирають з метанолом, отримуючи бажаний продукт 2-(6-хлор-7-флуор-1Нбензімідазол-1-іл)-етилформат (2,2 г, 19%). 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-D) м. д. 4,49-4,62 (m, 2H) 4,64-4,77 (m, 2H) 7,31 (dd, J=8,59, 7,03 Гц, 1H) 7,46 (d, J=8,59 Гц, 1H) 8,02 (s, 1H) 8,23 (s, 1H). Операція b: інтермедіат 39 2-(6-хлор-7-флуор-1H-бензімідазол-1іл)етанол. 2-(6-хлор-7-флуор-1Н-бензімідазол-1-іл)етилформат (1,1 г, 4,53 ммоль) розчиняють у МеОН (50,0 мл) з триетиламіном (5,0 мл) і перемішують при кімнатній температурі 18 год. Реакційну суміш концентрують і отримують бажаний продукт 2-(6-хлор-7-флуор-1Н-бензімідазол-1-іл)етанол (0,95 г, 98%) як білий порошок. 1 Н ЯМР (400 МГц, МЕТАНОЛ-D4) м. д. 3,90 (t, J=4,69 Гц, 2H) 4,47 (t, J=5,08 Гц, 2Н) 7,30 (dd, J=8,79, 6,84 Гц, 1Н) 7,45 (dd, J=8,59, 0,78 Гц, 1Н) 8,16-8,19 (m, 1H). Операція с: інтермедіат 40 (6-хлор-7-флуор-1H-бензімідазол-1-іл)оцтова кислота. 2-(6-хлор-7-флуор-1H-бензімідазол-1іл)етанол (800 мг, 3,74 ммоль) вносять у 40 мл MeCN і натрійфосфатний буфер (30 мл, 0,67 М, рН 6,8) і суміш нагрівають до 36°С. Додають TEMPO (174 мг, 1,12 моль) і потім краплями додають розчин NaCIO2 (201 мг, 80%-на чистота, 2,23 ммоль у 15 мл води) і розчин відбілювача (500 мкл 6%-го розчину NaOCI) протягом 2 год. Через 24 год. реакційну суміш залишають охолонути до кімнатної температури і потім краплями додають насичений розчин Na2SO3 . Використовуючи конц. НСІ рН знижують до 1 і білий порошковий осад відфільтровують і промивають декількома краплями дистильованої води. Отриману тверду речовину сушать у вакуумі, отримуючи бажаний продукт (7хлор-6-флуор-1H-бензімідазол-1-іл)оцтову кислоту (540 мг, 63%) як білий порошок. 1 43 Н ЯМР (400 МГц, МЕТАНОЛ-D4) м. д. 4,08 (s, 2Н) 6,50 (dd, J=8,59, 7,03 Гц, 1Н) 6,66 (d, J=8,59 Гц, 1Н) 7,37 (s, 1H). Схема 14: Синтез 4-[4-(1-аміноетил)-3метилфеніл]тетрагідро-2Н-тіопіран-4-карбонітрилу 1 Операція а: інтермедіат 41 Тетрагідро-2Н-тіопіран-4-карбонітрил Суміш тетрагідро-4Н-тіопіран-4-ону (8,0 г, 68,9 ммоль), тозилметилізоціанату (14,76 г, 75,6 ммоль) і 1,2-диметоксиетану (400 мл) перемішують під нітрогеном при 0°С у льодяній ванні, повільно додаючи шприцем розчин t-BuOK у ТГФ (1,0М, 15,1 ммоль). Суміш залишають нагрітись до кімнатної температури, з перемішуванням протягом 5 год., потім охолоджують до 0°С у льодяній ванні і додають воду (10,0 мл) для гасіння реакції. Розчинник видаляють роторним випарювачем і додають EtOAc (100 мл) і насичений водний NaHCO3 (100 мл). Фази розділяють і органіку промивають розсолом, сушать над Na2SO4 і концентрують до отримання залишку, який очищають силікагелевою колонною хроматографією (EtOAc/гексани), отримуючи продукт (3,5 г, 27,6 ммоль, 41%). 1 Н ЯМР (400 МГц, ДМСO-D6) м. д. 1,79-1,94 (m, 2H), 1,97-2,14 (m, 2H), 2,51-2,73 (m,4H), 2,963,10 (m, 1H). Операція b: інтермедіат 42 4-(4-ціано-3-метилфеніл)тетрагідро-2Нтіопіран-4-карбонітрил Розчин тетрагідро-2Н-тіопіран-4-карбонітрилу (197 мг, 1,55 ммоль) у ТГФ (2,0 мл) повільно додають шприцом до суміші KHMDS (324 мг, 1,63 ммоль) у ТГФ (3,0 мл), з перемішуванням при 78°С під нітрогеном. Температуру -78°С підтримують протягом 30 хвил. і потім додають повільно суміш 4-флуор-2-метилбензонітрилу (222 мг, 1,64 ммоль) у ТГФ (1,0 мл). Суміш залишають нагрітись до кімнатної температури і перемішують протягом 3 год., потім гасять насиченим водним NH4CI. Розчинник видаляють на роторному випарювачі і додають EtOAc (10,0 мл) і воду (10,0 мл). Фази розділяють і органіку промивають розсолом, сушать з Na2SO4 і концентрують, отримуючи продукт (252 мг, 1,04 ммоль, 67%). 1 Н ЯМР (400 МГц, ДМСО-D6) м. д. 1,84-1,95 (m, 2H), 2,03-2,14 (m, 2H), 2,51 (s, 3H), 2,57-2,72 (m, 4H), 7,23-7,31 (m, 1H), 7,41 (dd, J=9,96, 1,76 Гц, 1Н), 7,89 (dd, J=8,59, 5,86 Гц, 1Н). Операція с: інтермедіат 43 4-[4-(1-аміноетил)-3-метилфеніл]тетрагідро2Н-тіопіран-4-карбонітрил 96764 44 4-(4-ціано-3-метилфеніл)тетрагідро-2Нтіопіран-4-карбонітрил (983 мг, 4,06 ммоль) перемішують у ТГФ (40,0 мл) при-8°С під нітрогеном і потім додають розчин метиллітію у Et2O, повільно шприцом. Суміш перемішують протягом 3 год. при -20°С, потім гасять МеОН (40,0 мл) і підігрівають до кімнатної температури. Повільно додають NaBH4 (460 мг, 12,2 ммоль) при 0°С у льодяній ванні і суміш нагрівають до кімнатної температури і перемішують протягом 16 год. Додають 1,0N водну НСІ до досягнення рН 3,0 і розчинник видаляють на роторному випарювачі. До залишку додають конц. водну НСІ (3,0 мл) і суміш перемішують протягом 16 год., потім нейтралізують доданням 1,0М водного NaOH і EtOAc (40,0 мл). Шари розділяють і органіку сушать з Na2SO4 і концентрують. Залишок очищають силікаге-левою колонною хроматографією (10% МеОН у ДХМ) (253 мг, 1,05 ммоль, 26%). Схема 15: Синтез 2-[4-(1-аміноетил)-3метилфеніл]-2-метилпропаннітрилу Операція а: інтермедіат 44 (4-бром-3-метилфеніл)метанол Метил 4-бром-3-метилбензоат (17,0 г, 74,2 ммоль) розчиняють у безводному ТГФ (100 мл). Розчин охолоджують до 0°С і додають 2М розчин алюмогідриду літію у ТГФ (40 мл). Розчин залишають перемішуватись на 30 хвил. при цій температурі. Додають краплями холодний розчин НСІ до розчинення алюмінієвого комплексу. Бажаний продукт екстрагують етилацетатом, органічну фазу промивають розсолом (200 мл), сушать з MgSO4 і концентрують у вакуумі, отримуючи (4бром-3-метилфеніл)метанол (14,4 г, 97%) як прозоре жовте масло, чисте, згідно з протонним ЯМР, і використовують його у наступній операції. 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-D) м. д. 2,40 (s, 3H) 4,61 (s, 2H) 6,89-7,10 (m, J=8,20, 1,56, 0,59 Гц, 1Н) 7,23 (d, J=2,34 Гц, 1Н) 7,50 (d, J=8,20 Гц, 1Н). Операція b: інтермедіат 45 1-бром-4-(бромметил)-2-метилбензол (4-бром-3-метилфеніл)метанол (14,4 г, 71,6 ммоль) розчиняють у безводному СН2СІ2 (150 мл) і додають СBr4 (26,1 г, 79,0 ммоль). Реакційну суміш охолоджують до 0°С і додають порціями PPh3 (20,7 г, 79,0 ммоль). Реакційну суміш перемішують 2 год. і утворений трифенілфосфін відфільтровують і розчинник видаляють у вакуумі. Отриману напівтверду речовину фільтрують на силікагелевій 45 подушці і промивають гексаном/EtOAc (9:1), отримуючи бажаний продукт 1-бром-4-(бромметил)-2метилбензол як прозоре масло з домішком бромоформу, яке використовують у наступній операції. 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-D) м. д. 4,39-4,44 (m, 3H) 7,07 (dd, J=8,20, 2,34 Гц, 1Н) 7,26 (t, J=1,17 Гц, 1Н) 7,49 (d, J=8,20 Гц, 1Н) Операція с: інтермедіат 46 2-(4-бром-3-метилфеніл)ацетонітрил 1-бром-4-(бромметил)-2-метилбензол (45, сирий з операції b, 68,2 ммоль) розчиняють у СН2СІ2 (500 мл) змішують з перемішуванням з ціанідом калію (24 г, 364 ммоль) і бромідом N-тетра(nбутил)амонію (1,2 г, 3,64 ммоль) у дистильованій воді (500 мл). Цю реакційну суміш перемішують енергійно протягом 6 год. Органічну фазу відділяють, сушать над MgSO4, фільтрують і концентрують. Отриманий залишок очищають на силікагелі використовуючи градієнт 030% етилацетату у гептані і отримуючи бажаний продукт 2-(4-бром-3метилфеніл)ацетонітрил (12,4 г, 87% у двох операціях) як прозоре жовте масло. 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-D) м. д. 2,41 (s, 3H) 3,68 (s, 2H) 7,01 (dd, J=8,50, 2,05 Гц, 1Н) 7,21 (d, J=1,37 Гц, 1Н) 7,53 (d, J=8,20 Гц, 1Н). Операція d: інтермедіат 47 2-(4-бром-3-метилфеніл)-2-метилпропаннітрил З перемішуванням до розчину 2-(4-бром-3метилфеніл)ацетонітрилу (11,2 г, 53,3 ммоль) у безводному ДМФ (125 мл) додають метилйодид (13,2 мл, 213 ммоль). Розчин охолоджують до 0°С і малими порціями додають гідрид натрію (60%-на сусп. у маслі, 3,84 г, 160 ммоль) протягом 20 хвил. Реакційну суміш залишають для перемішування і повільного нагрівання до кімнатної температури протягом 18 год. при 0°С повільно додають воду (500 мл), потім екстрагують етилацетатом з 10% гексанів. Органічний шар відділяють, сушать з MgSO4, фільтрують і концентрують під зниженим тиском, отримуючи бажаний продукт 2-(4-бром-3метилфеніл)-2-метилпропаннітрил (12,6 г, 99%) як прозоре жовте масло, яке використовують у наступній операції без очищення. 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-D) м. д. 1,71 (s, 6H) 2,43 (s, 3H) 7,14 (dd, J=8,40, 2,34 Гц, 1Н) 7,34 (d, J=2,54 Гц, 1Н) 7,53 (d, J=8,40 Гц, 1Н). Операція e: інтермедіат 48 2-(4-ацетил-3-метилфеніл)-2метилпропаннітрил З перемішуванням до розчину 2-(4-бром-3метилфеніл)-2-метилпропаннітрилу (5,0 г, 21,0 ммоль) у безводному ТГФ (75 мл) при -100°С додають n-бутиллітій (2М у с-гексані, 21 мл, 42 ммоль). Реакційну суміш перемішують при цій температурі 5 хвил., потім додають N-метокси-Nметил-ацетамід (4,33 г, 42 ммоль). Розчин нагрівають до кімнатної температури протягом 1 год. Повільно додають кислий розсіл (30 мл, 15 мл 3%ї водної НСІ) і розчин екстрагують EtOAc (3x100 мл). Органічний шар сушать над MgSO4, фільтрують і концентрують під зниженим тиском. Сирий продукт очищають на силікагелі, використовуючи градієнт 030% EtOAc у гептані, отримуючи ба 96764 46 жаний продукт 2-(4-ацетил-2-метилфеніл)-2метилпропаннітрил (1,0 г, 24%). 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-D) м. д. 1,71 (s, 6Н) 2,53 (s, 3H) 2,56 (s, 3H) 7,30-7,38 (m, 2Н) 7,70 (d, J=8,01 Гц, 1Н). Операція f: інтермедіат 49 2-[4-(1-аміноетил)-3-метилфеніл]-2метилпропаннітрил З перемішуванням до розчин у 2-(4-ацетил-3метилфеніл)-2-метилпропаннітрилу (1,0 г, 4,97 ммоль) у 7М амонію у МеОН (40 мл) додають ізопропоксид титану (IV) (3,0 г, 9,95 ммоль). Реакційну суміш залишають перемішуватись 24 год. при кімнатній температурі. Після охолодження до 0°С, додають боргідрид натрію (1,0 г, 19,9 ммоль) і реакційну суміш перемішують і залишають нагрітись до кімнатної температури протягом 1 год. Додають конц. гідроксид амонію (15 мл), потім оксид титану видаляють фільтруванням і промивають етилацетатом. Фільтрат екстрагують EtOAc (2x100 мл) і об'єднані органічні шари сушать над MgSO4, фільтрують і концентрують під зниженим тиском, отримуючи бажаний продукт 2-[4-(1-аміноетил)-3метилфеніл]-2 метилпропаннітрил (1,0 г, 99%) як прозоре жовте масло. 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-D) м. д. 1,33 (d, J=6,64 Гц, 3H) 1,44 (s, 2H) 1,70 (s, 6H) 2,36 (s, 3H) 4,34 (q, J=6,44 Гц, 1Н) 7,22 (d, J=1,95 Гц, 1Н) 7,28 (dd, J=8,20, 2,15 Гц, 1H) 7,48 (d, J=8,20 Гц, 1H). Схема 16: Синтез 2-[4-(1-аміноетил)-2метилфеніл]-2-метилпропаннітрилу Операція а: інтермедіат 50 (4-бром-2-метилфеніл)метанол 4-бром-2-метилбензойну кислоту (11,1 г, 51,6 ммоль) розчиняють у безводному ТГФ (11,2 мл). Розчин охолоджують до 0-5°С і додають 1М розчин ВН3 і потім ТГФ (103 мл). Розчин залишають перемішуватись 3 год. при кімнатній температурі. Додають холодну воду (20 мл) і реакційну суміш промивають насиченим розчином NaHCO3 (120 мл). Водну фазу екстрагують діетилетером (3x300 мл) і об'єднані органічні фази промивають розсолом (200 мл), сушать з MgSO4 і концентрують у вакуумі. Отримане масло очищають флешхроматографією з елюентом гексан/EtOAc з 95:570:30, отримуючи бажаний продукт (4-бром2-метилфеніл)метанол (10,4 г, 100%) як прозоре масло. 47 Н ЯМР (300 МГц, ХЛОРОФОРМ-D): 7,367,30 (2Н, m), 7,25-7,21 (1Н, m), 4,65 (2H, s) 2,32 (3H, s). Операція b: інтермедіат 51 1-бром-4-(бромметил)-3-метилбензол (4-бром-2-метилфеніл) метанол (10,4 г, 51,6 ммоль) розчиняють у безводному СН2СІ2 (150 мл) і додають СBr4 (18,8 г, 56,8 ммоль). Реакційну суміш охолоджують до 0-5°С і додають PPh3 (14,9 г, 56,8 ммоль). Реакційну суміш перемішують протягом ночі, потім додають гексан/EtOAc (9:1) (250 мл) з енергійним перемішуванням. Трифенілфосфіноксид, що утворюється під час реакції, відфільтровують і фільтрат концентрують у вакуумі. Отримане масло очищають на силікагелевій подушці гексаном/EtOAc (8:2). Розчинник видаляють на роторному випарювачі і вакуумною дистиляцією видаляють бромоформ (15 мм Hg, 40-50°С), отримуючи бажаний продукт 1-бром-4-(бромметил)-3метилбензол (13,23 г, 97%) як жовте масло. 1 Н ЯМР (300 МГц, ХЛОРОФОРМ-D): 7,377,27 (2Н, m), 7,17 (1Н, d, J= 8,1 Гц), 4,45 (2Н, s), 2,39 (3H, s). Операція с: інтермедіат 52 2-(4-бром-2-метилфеніл)ацетонітрил 1-бром-4-(бромметил)-3-метилбензол (13,2 г, 50,1 ммоль) розчиняють у ДМФ (65 мл). Реакційну суміш охолоджують до 0-5°С і додають NaCN (3,66 г, 74,6 ммоль) і потім воду (8 мл). Реакцію перемішують протягом ночі при кімнатній температурі і додають воду (170 мл) і потім насич. NaHCO3 (130 мл) і гексан/Et2О (2:1) (150 мл). Органічну фазу відділяють і водну фазу екстрагують гексаном/Et2О (2:1) (3x150 мл). Об'єднані органічні фази промивають водою (170 мл), сушать над MgSO4, фільтрують і концентрують під зниженим тиском, отримуючи бажаний продукт 2-(4-бром-2метилфеніл)ацетонітрил (9,76 г, 93%) як оранжеве масло. 1 Н ЯМР (300 МГц, ХЛОРОФОРМ-D): 7,407,32 (2Н, m), 7,23 (2Н, d, J=8,2 Гц), 3,61 (2Н, s), 2,32 (3H, s). Операція d: інтермедіат 53 2-(4-бром-2-метилфеніл)-2-метилпропаннітрил З перемішуванням до розчину 2-(4-бром-2метилфеніл)ацетонітрилу (3,93 г, 18,8 ммоль) у безводному ДМФ (35 мл) додають метилйодид (2,45 мл, 39,4 ммоль). Розчин охолоджують 0°С і додають гідрид натрію (60%-на сусп. у маслі, 1,47 г, 61,1 ммоль) трьома рівними порціями протягом 20 хвил. Реакційну суміш залишають для перемішування і повільно нагрівають до кімнатної температури протягом 18 год. Розчин перетворюється у густу коричнево-оранжеву пасту при 0°С Повільно додають воду (50 мл) і розчин екстрагують 2:1 розчином гексан/Et2O (3x50 мл). Органічний шар промивають розсолом, сушать з MgSO4, фільтрують і концентрують під зниженим тиском. Сирий продукт очищають флеш-хроматографією з елюентом гексан/EtOAc (9:1), отримуючи бажаний продукт 2-(4-бром-2-метилфеніл)-2метилпропаннітрил (3,1 г, 66%) як прозоре жовтувате масло. 1 96764 48 Н ЯМР (300 МГц, ХЛОРОФОРМ-D): 7,407,30 (2Н, m), 7,16 (2Н, d, J=8,5 Гц), 2,63 (3H, s), 1,77 (6H, s). 49 Операція e: інтермедіат 54 2-(4-ацетил-2-метилфеніл)-2метилпропаннітрил З перемішуванням до розчину 2-(4-бром-2метилфеніл)-2-метилпропаннітрилу (3,1 г, 13,0 ммоль) у безводному ТГФ (75 мл) при -78°С додають n-бутиллітій (2М у с-гексані) (7,16 мл, 14,3 ммоль). Реакційну суміш перемішують при цій температурі 10 хвил., потім додають N-метокси-Nметил-ацетамід (2,77 мл, 26,0 ммоль) і розчин нагрівають до кімнатної температури протягом 1 год. Повільно додають кислий розсіл (30 мл розсолу, 15 мл 3%-ї водної НСІ) і розчин екстрагують EtOAc (3x100 мл). Органічний шар сушать з MgSO4, фільтрують і концентрують під зниженим тиском. Сирий продукт очищають флеш-хроматографією, використовуючи градієнт 520% EtOAc у гексані і отримують бажаний продукт 2-(4-ацетил-2метилфеніл)-2-метилпропаннітрил (1,77 г, 68%) як жовтувате масло. 1 Н ЯМР (300 МГц, ХЛОРОФОРМ-D): 7,847,74 (2Н, m), 7,43-7,40 (1Н, m), 2,70 (3H, s), 2,60 (3H,s), 1,81 (6Н, s). Операція f: інтермедіат 55 2-[4-(1-аміноетил)-2-метилфеніл]-2метилпропаннітрил З перемішуванням до розчину 2-(4-ацетил-2метилфеніл)-2-метилпропаннітрилу (1,77 г, 8,80 ммоль) у 7М амонію у МеОН (45 мл) додають щойно дистильований ізопропоксид титану (IV) (5,20 мл, 17,6 ммоль). Реакційну суміш залишають перемішуватись 18 год. при кімнатній температурі. Після охолодження до 0°С додають боргідрид натрію (500 мг, 13,2 ммоль) і реакційну суміш перемішують при 0°С до припинення виходу газу і потім при кімнатній температурі ще 3 год. Додають воду (25 мл) і оксид титану видаляють фільтруванням на воронці Бухнера. Фільтрат екстрагують EtOAc (3x100 мл) і додають розсіл (10 мл) для сприяння розділенню шарів) і об'єднані органічні шари концентрують під зниженим тиском. Отриманий сирий продукт (що містить воду) розчиняють у Et2O (75 мл), промивають розсолом, сушать над MgSO4 і фільтрують. До фільтрату повільно додають 5-6N НСІ у 2-пропанол (2,2 мл) з енергійним перемішуванням. Отриманий білий осад фільтрують на воронці Бухнера і сушать у вакуумі, отримуючи бажаний продукт 2-[4-(1-аміноетил)-2метилфеніл]-2-метилпропаннітрил (1,58 г, 75%) як білу тверду речовину. 1 Н ЯМР (300 МГц, CD3OD): 7,55 (1Н, d, J=8,0 Гц), 7,44-7,37 (2Н, m), 4,97 (3H, s), 4,52 (1Н, q, J=6,9 Гц), 2,75 (3H, s), 1,86 (6Н, s), 1,69 (3H, d, J=6,9 Гц). Схема 17. Синтез 2-[4-(1-аміноетил)-2хлорфеніл]-2-метилпропаннітрилу 1 49 Операція а: інтермедіат 56 (4-бром-2-хлорфеніл)метанол З перемішуванням до розчину 4-бром-2хлорбензойної кислот (4,27 г, 18,1 ммоль) у ТГФ (39 мл) при 0°С додають борантетрагідрофурановий комплекс (1М у ТГФ) (36,3 мл, 36,3 ммоль). Реакційну суміш перемішують 16 год при кімнатній температурі, при 0°С повільно додають воду, потім водний насичений NaHCO3. Отриманий розчин екстрагують EtOAc (3x50 мл). Об'єднані органічні шари промивають розсолом, сушать над безводним MgSO4, фільтрують і концентрують під зниженим тиском. Сирий продукт очищають флеш-хроматографією (елюент гексани/EtOAc 85:1570:30), отримуючи бажаний продукт (4-бром-2-хлорфеніл)метанол (4,34 г, 108%). 1 Н ЯМР (300 МГц, ХЛОРОФОРМ-D) 7,53 (1Н, d, J=1,8 Гц), 7,43 (1Н, dd, J=8,2,1,8 Гц), 7,38 (1Н, d, J=8,2 Гц), 4,74 (2Н, d, J=6,2 Гц), 1,90 (1Н, t, J=6,3 Гц). Операція b: інтермедіат 57 4-бром-1-(бромметил)-2-хлорбензол З перемішуванням до розчину (4-бром-2хлорфеніл)метанолу (4,34 г, 19,6 ммоль) у ДХМ (98 мл) при 0°С додають карбон-тетрабромід (6,5 г, 19,6 ммоль) і трифенілфосфін (5,14 г, 19,6 ммоль) Реакційну суміш перемішують 16 год. при кімнатній температурі, потім, розчинник видаляють і сиру тверду речовину суспендують у гексанах/EtOAc 9:1 (100 мл) і фільтрують на силікагелевій подушці. Подушку промивають гексанами/EtOAc 9:1 (100 мл) і фільтрат концентрують у вакуумі, отримуючи бажаний продукт 4-бром-1(бромметил)-2-хлорбензол (7,19 г, 129%) з домішком бромоформу. 1 Н ЯМР (300 МГц, ХЛОРОФОРМ-D): 7,57 (1Н, d, J=2,0 Гц), 7,39 (1Н, dd, J=8,2, 2,0 Гц), 7,30 (1H, d, J=8,2 Гц), 4,53 (2H, s). Операція с: інтермедіат 58 2-(4-бром-2-хлорфеніл)ацетонітрил З перемішуванням до розчину 4-бром-1(бромметил)-2-хлорбензолу (7,19 г, 25,3 ммоль) у ДХМ (60 мл) і воді (60 мл) додають бромід тетрабутиламонію (0,82 г, 2,53 ммоль). і потім ціанід калію (4,94 г, 75,8 ммоль) у воді (60 мл). Отриманий розчин перемішують 4 год. При кімнатній температурі і він швидко стає оранжевим. Додають насичений розчин NaHCO3 і суміш екстрагують СН2СІ2 (3x100 мл). Об'єднані органічні шари промивають розсолом, сушать над безводним MgSO4 і фільтрують на силікагелевій подушці. Подушку 96764 50 промивають СН2СІ2 і фільтрат концентрують під зниженим тиском, отримуючи бажаний продукт 2(4-бром-2-хлорфеніл)ацетонітрил (5,38 г, 92%) з домішком бромоформу. 1 Н ЯМР (300 МГц, ХЛОРОФОРМ-D): 7,60 (1Н, d, J=1,9 Гц), 7,47 (1Н, dd, J=8,3, 1,9 Гц), 7,39 (1Н, d, J=8,3 Гц), 3,79 (2Н, s). Операція d: інтермедіат 59 2-(4-бром-2-хлорфеніл)-2-метилпропаннітрил З перемішуванням до розчину 2-(4-бром-2хлорфеніл)ацетонітрилу (1,11 г, 4,82 ммоль) у безводному ДМФ (7,6 мл) додають метилйодид (0,63 мл, 10,1 ммоль). Розчин охолоджують до 0°С і додають гідрид натрію (60%-на сусп. у маслі, 0,63 г, 15,7 ммоль) п'ятьма порціями протягом 1 год. Реакційну суміш залишають для перемішування і повільного нагрівання до кімнатної температури на 18 год. Розчин перетворюється на густу коричнево-оранжеву пасту. Повільно додають воду (20 мл) і розчин екстрагують 3:1 розчином гексану/Et2O (3x25 мл). Органічний шар промивають розсолом, сушать над MgSO4, фільтрують і концентрують під зниженим тиском. Сирий продукт очищають флешхроматографією (елюент Нех/EtOAc 9:18:2), отримуючи бажаний продукт 2-(4-бром-2хлорфеніл)-2-метилпропаннітрил (0,79 г, 63%). 1 Н ЯМР (300 МГц, ХЛОРОФОРМ-D): 7,61 (1Н, d, J=2,1 Гц), 7,43 (1Н, dd, J=8,5, 2,1 Гц), 7,34 (1Н, d, J=8,6 Гц), 1,85 (6Н, s). Операція e: інтермедіат 60 2-(4-ацетил-2-хлорфеніл)-2метилпропаннітрил З перемішуванням до розчину 2-(4-бром-2хлорфеніл)-2-метилпропаннітрилу (2,85 г, 11,0 ммоль) у безводному ТГФ (60 мл) при -78°С додають n-бутиллітій (2М у с-гексані) (6,1 мл, 12,1 ммоль). Реакційну суміш перемішують при цій температурі 10 хвил., потім додають N-метокси-Nметил-ацетамід (2,34 мл, 22,0 ммоль) і розчин перемішують 10 хвил. при -78°С і потім нагрівають до кімнатної температури протягом ще 1 год. Повільно додають кислий розсіл (60 мл) і розчин екстрагують EtOAc (3x60 мл). Органічний шар сушать над MgSO4, фільтрують і концентрують під зниженим тиском. Сирий продукт очищають флешхроматографією (елюент Hex/EtOAc 1:07:3), отримуючи бажаний продукт 2-(4-ацетил-2хлорфеніл)-2-метилпропаннітрил (1,57 г, 64%) як жовте масло. 1 Н ЯМР (300 МГц, ХЛОРОФОРМ-D): 7,96 (1Н, d, J=1,9 Гц), 7,81 (1Н, dd, J=8,3, 1,9 Гц), 7,55 (1Н, d, J=8,3 Гц), 2,56 (3H, s), 1,85 (6H, s). Операція f: інтермедіат 61 2-(4-(1-аміноетил)-2-хлорфеніл)-2метилпропаннітрил гідрохлорид З перемішуванням до розчину 2-(4-ацетил-2хлорфеніл)-2-метилпропаннітрил (1,57 г, 7,08 ммоль) у розчині 7М амонію у метанолі (35 мл) додають щойно дистильований ізопропоксид титану (IV) (4,2 мл, 14,2 ммоль). Реакційну суміш залишають перемішуватись 18 год. при кімнатній температурі. Після охолодження до 0°С, додають боргідрид натрію (0,40 г, 10,6 ммоль) і реакційну суміш перемішують при 0°С до припинення виходу газу і потім при кімнатній температурі протягом ще 51 96764 52 4 год. Додають воду (40 мл) і оксид титану видаляють фільтруванням на воронці Бухнера. Фільтрат екстрагують EtOAc (3x50 мл) і об'єднані органічні шари концентрують під зниженим тиском. Отриманий залишок розчиняють у Et2O (200 мл), промивають розсолом, сушать над безводним MgSO4 і фільтрують. До цього розчин додають 5N НСІ у 2-пропанолі (1,8 мл, 8,85 ммоль). Отриманий осад фільтрують на воронці Бухнера і сушать, отримуючи бажаний 2-(4-(1-аміноетил)-2 хлорфеніл)-2-метилпропаннітрил-гідрохлорид (1,17 г, 64%) як білу тверду речовину. 1 Н ЯМР (300 МГц, CD3OD): 7,69 (1Н, d, J=10,7 Гц), 7,68 (1H, s), 7,52 (1H, dd, J=8,3, 2,0 Гц), 4,53 (1H, q, J=6,8 Гц), 1,90 (6H, s), 1,66 (3H, d, J=6,9 Гц). 13С ЯМР (75 МГц, CD3OD): 142,5, 140,2, 136,0, 132,0, 130,1, 127,9, 52,0, 37,8, 28,4, 21,3. Схема 18. Синтез 2-[4-(амінометил)феніл]-2метилпропаннітрилу Операція а: інтермедіат 62 4-(1-ціано-1-метилетил)бензонітрил*** 2-метил-2-(4-метилфеніл)пропаннітрил (3,51 г, 15,7 ммоль) розчиняють у сухому ДМФ (10 мл). Додають Zn(CN)2 (2,02 г, 17,2 ммоль) і Pd(PPh3)4 (906 мг, 5 моль-%) і суміш гріють при 100°С протягом 3 год. Реакційну суміш розріджують водою і тверду речовину отримують фільтруванням. Твердий залишок розчиняють у метанолі, фільтрують для видалення нерозчинних домішків, концентрують у вакуумі і очищають нормально-фазною МРРХ (SiO2, гексанEtOAc), отримуючи 4-(1ціано-1-метилетил)бензонітрил (2,28 г, 13,4 ммоль, 85%) як білу тверду речовину. 1 Н ЯМР (400 МГц, ДМСО-D6) м. д. 1,70 (s, 6Н) 7,73 (dt, J=8,64, 2,03 Гц, 2Н) 7,92 (dt, J=8,69, 2,00 Гц, 2Н). Операція b: інтермедіат 63 2-[4-(амінометил)феніл]-2-метилпропаннітрил 4-(1-ціано-1-метилетил)бензонітрил (2,28 г, 13,41 ммоль) розчиняють у сухому ТГФ і розчин охолоджують до 0°С. Додають Red-AI (85%-й роз чин у толуолі, 2,62 мл, 13,41 ммоль гідриду) і реакцію перемішують при 0°С протягом 4 год. Суміш гасять метанолом і концентрують у вакуумі. Залишок розчиняють у СН2СІ2, промивають 2 порціями води, сушать над сульфатом магнію, фільтрують і випаровують до сухості. Сирий продукт очищають нормально-фазною МРРХ (SiO2, ДХМ ДХМ/МеОН 3:1), отримуючи 2-[4(амінометил)феніл]-2-метилпропаннітрил (900 мг, 5,17 ммоль, 39%) як безбарвне масло. 1 Н ЯМР (400 МГц, ДМСО-D6) м. д. 1,68 (s, 6H) 4,00-4,05 (m, 2H) 7,55 (q, J=8,59 Гц, 4H) 8,35 (broad s, 2H). Схема 19. Синтез 2-[4-(амінометил)-3метилфеніл]-2-метилпропаннітрил Операція а: інтермедіат 64 2-(4-форміл-3-метилфеніл)-2метилпропаннітрил 2-(4-бром-3-метилфеніл)-2-метилпропаннітрил (3,31 г, 13,9 ммоль) розчиняють у сухому ТГФ (80 мл). Суміш охолоджують до -78°С і додають третBuLi (1,7М у пентані, 18 мл, 30,6 ммоль). Через 30 хвил. реакцію гасять ДМФ (10 мл), леткі компоненти випаровують і залишок очищають нормальнофазною МРРХ (SiO2, гептангептан/EtOAc 3:1), отримуючи 2-(4-форміл-3-метилфеніл)-2метилпропаннітрил (1,89 г, 10,2 ммоль, 73%) як безбарвну рідину. Н ЯМР (400 МГц, ДМСО-D6) м. д. 1,70 (s, 6Н) 2,64 (s, 3H) 7,49 (s, 1H) 7,55 (dd, J=8,01, 2,15 Гц, 1Н) 7,86 (d, J=7,81 Гц, 1Н) 10,22 (s, 1H). Операція b: інтермедіат 65 2-[4-(амінометил)-3-метилфеніл]-2метилпропаннітрил 2-(4-форміл-3-метилфеніл)-2метилпропаннітрил 1,89 г, 10,2 ммоль) розчиняють у 50 мл 7М NH3 у МеОН. Додають Ті(ОіPr)4 (6 ммоль, 20 ммоль) і суміш перемішують протягом3 год. при кімнатній температурі. Додають NaBH4 (0,6 г, 15 ммоль) і реакцію залишають при кімнатній температурі на ніч. Суміш гасять доданням 25 мл NH4OH 2M. Отриманий осад відфільтровують і промивають EtOAc. Фази розділяють, органічну 1 53 96764 54 фазу сушать над сульфатом магнію, фільтрують і випаровують до сухості, отримуючи 2-[4(амінометил)-3-метилфеніл]-2-метилпропаннітрил (1,325 г, 7,09 ммоль, 87%). Сирий продукт використовують без очищення. 1 Н ЯМР (400 МГц, ДМСО-D6) 1,64 (s, 6H, перший ротамер) 1,65 (s, 6H, другий ротамер) 2,28 (s, 3H, перший ротамер) 2,29 (s, 3H, другий рота мер) 3,32 (broad s, 2H) 3,67 (s, 2Н, перший ротамер) 3,68 (s, 2H, другий ротамер) 7,24-7,27 (m, 1H) 7,28 (s, 1H) 7,36-7,40 (m, 1Н). Схема 20. Сепарація (S)-(-)-2-[4-(амінометил)3-метилфеніл]-2-метилпропаннітрилу з (R)-(+)-2-[4(амінометил)-3-метилфеніл]-2метилпропаннітрилу Операція а: інтермедіати 66, 67 і 68. Трет-бутил N-[1-[4-(2-ціанопропан-2іл)феніл]етил]карбамат З перемішуванням до розчину рацемічного 2[4-(1-аміноетил)феніл]-2-метилпропаннітрилгідрохлориду (1 г, 3,97 ммоль) у ТГФ (12 мл) додають Et3N (2,22 мл, 15,9 ммоль). Краплями додають ди-трет-бутил дикарбонат (0,87 г, 3,97 ммоль) у ТГФ (2 мл) і реакційну суміш перемішують при кімнатній температурі 18 год. Отриману суміш фільтрують на силікагелевій подушці і промивають 1:1 розчином EtOAc і гексану. Фільтрат концентрують під зниженим тиском, і сирий продукт залишають відстоюватись до затвердіння, потім очищають рекристалізацією у 30 мл гексану, отримуючи бажану сполуку трет-бутил N-[1-[4-(2ціанопропан-2-іл)феніл]етил]карбамат (0,87 г, 68%) як білу тверду речовину. 1 Н ЯМР (300 МГц, ХЛОРОФОРМ-D): 7,447,41 (2Н, m), 7,33-7,30 (2Н, m), 4,80 (2Н, s), 1,71 (6Н, s), 1,44 (3H, s) 1,42 (9Н, s). Два енантіомери 67 і 68 розділяють на хіральній колонці CHIRALPAK AY, використовуючи 9:1 суміш гексан:ІРА як елюент при 25°С з УФ детектором на 220 нм. Ці енантіомери мають значення оптичного повертання []D=-76,2° (1,36, МеОН) для ізомеру 67 і []D=+78,7° (с=1,20, МеОН) для ізомеру 68. Операція b: інтермедіат 69 (подібно до процедури отримання 70 з 68). S(-)2-[4-(1-аміноетил)феніл]-2-метилпропаннітрил Гідрогенхлорид (34,7 мл, 138,70 ммоль) 4М у діоксані додають до розчину (-)трет-бутил-N-[1-[4 (2-ціанопропан-2-іл)феніл]етил]карбамату 67 (8,00 г, 27,74 ммоль) у ТГФ (45 мл) при зовнішній температурі. Реакційну суміш перемішують протягом 2 год. і розчинник концентрують до сухості. Залишок суспендують у EtOAc (45 мл) і перемішують протягом 1 год. Тверду речовину збирають і сушать повітрям, отримуючи сіль НСІ (S)-2-(4-(1аміноетил)феніл)-2-метилпропаннітрилу (6,08 г, 97%) як білу тверду речовину. Матеріал суспендують у МТВЕ (80 мл) і додають NaOH 2M (40 мл). Суміш обережно перемішують протягом 1 год. і органічну фазу відділяють. Водну фазу екстрагують МТВЕ (40 мл), об'єднані органічні шари сушать над безводним MgSO4 і розчинник концентрують, отримуючи бажаний продукт S(-)-2-[4-(1аміноетил)феніл]-2-метил-пропаннітрил (4,88 г, 93%) як безбарвне масло. 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-D) 1/млн. 1,39 (d, J=6,64 Гц, 3H) 1,53-1,63 (m, 2H) 1,68-1,76 (m, 6Н) 4,14 (q, J=6,64 Гц, 1Н) 7,34-7,40 (m, 2H) + 7,41-7,46 (m, 2H) МС (ESI) (М+Н) 188,9. []D=21,0° (1,44, EtOH) Для іншого ізомеру 70, отриманого за процедурою, описаною вище []D=+19,0° (c=0,39, EtOH). Для підтвердження абсолютної конфігурації інтермедіатів 69 і 70 використовують ви-браційний круговий дихроїзм (VCD). Короткий опис: Цей спосіб включає обчислення спектрів VCD чистих енантіомерів, яким має бути визначена абсолютна конфігурація. Обчислені спектри потім порівнюють з експериментальними VCDспектрами, отриманими з хіральних речовин. Збіг 55 96764 56 конкретних спектральних характеристик дає підтвердження абсолютної конфігурації енантіомерів. Обчислювальні спектральні моделювання Для 69 з використанням молекулярної механіки Монте Карло був проведений пошук низькоенергетичних конформерів за допомогою MacroModel у графічному інтерфейсі Maestro (Schrodinger Inc.). 12 ідентифікованих конформерів найнижчої енергії були використані як початкові точки і були мінімізовані з використанням теорії функціональної щільності (DFT) у Gaussian03. Для кожного з конформерів були визначені оптимальні структури, гармонічні вібраційні частоти/інтенсивності, обертальні сили VCD і вільні енергії при ТСТ (включаючи енергії нульової точки. У цих обчисленнях був використаний обміннокореляційний функціонал щільності для апроксимації узагальненого градієнта B3LYP (GGA). Зокрема, був використаний комбінаційний функціонал GGA обміну Беке (3-параметричний гібридний обмінний функціонал HF/DFT [В3]) {Becke, A. D. J. Chem. Phys. 93, 98, 5648} з динамічним кореляційним функціоналом Лі, Янга і Парра (LYP) {Lee, С; Yang, W.; Parr, R. G. Phys. Rev. В 1988, 37, 785}. 631 G basis set {Hariharan, P.C.; Pople, J.A. Theor. Chirm. Acta, 1973, 28, 213}. ІЧ і VCD спектри для кожного конформера отримували з виходу файлів Gaussian 03, використовуючи одну з програм для пристосування до -1 лінійних форм Лоренца (шириною 5 см ) для об числення спектрів. Це дозволяє безпосередньо порівнювати модельовані і експериментальні спектри. Експериментальні спектри 30 мг 69 і 70, відповідно розчиняють 0,28 мл d6-ДМСО. Розчини індивідуально вносять у 0,1міліметрові ІЧ комірки BaF2 для аналізу з розріз-1 ненням 4 см використовуючи 5-годинне подвійне джерело (згідно з протоколом сканування VCD). Всі аналізи проводять, використовуючи BioTools, Inc. інструмент ChirallR з вбудованим одиночним фотоеласти-ковим модуляторним вузлом для поляризаційної модуляції на 37,024 кГц з затриманням /4 (оптимізованим для отримання централь-1 ної області спектру поблизу 1400 см ). Використовують синхронний підсилювач з часовою константою 30 мкс і фільтром з верхньою частотою 20 кГц і нижньою частотою 4 кГц. Результати Порівняння вібраційного кругового дихроїзму (VCD) ІЧ спектрів з прогнозованими спектрами VCD (отриманими за допомогою молекулярної механіки і теорії функціональної щільності) показує, що структура відповідає припущенню про Sконфігурацію для інтерме-діату 69 і Rконфігурацію для інтермедіату 70. Схема 21. Енантіоселективний синтез S(-)2-[4(амінометил)-3-метилфеніл]-2метилпропаннітрилу Операція а: інтермедіат 71 N-{(S,S)-1-[4-(1-ціано-1метилетил)феніл]етил}-2-метилпропан-2сульфінамід. У 500-мілілітрову 3-горлу круглодонну колбу, обладнану термометром, входом для нітрогену, гумовою перегородкою і магнітним стрижневим перемішувачем, вносять 8,13 г (36,93 ммоль, з вмістом 85% (за масою) лише кетону) арилметилкетону і (S)-(-)-t-бутилсульфінамід (4,47 г, 1 екв.). Систему продувають нітрогеном, додають безводний ТГФ (82 мл, 10 частин вагових від сирої ваги) і отриманий розчин перемішують помірно під нітрогеном. До цього розчину шприцом додають Ti(OEt)4 (15,32 мл, 2 екв.). Отриманий глибокожовтий розчин нагрівають під нітрогеном до м'якої флегми з помірним перемішуванням і витримують протягом ~24 год. (незначне спінювання 1 реакційної суміші). Н ЯМР підтверджує завершення реакції. Реакційну суміш спочатку охолоджують до зовнішньої температури і потім до 0-5°С зануренням у льодо-водяну ванну. До суміш додають боргідрид натрію (2,1 г, 1,5 екв.) (можливе помірне піноутворення і екзотермія 3-10°С). Отриману реакційну суміш перемішують при 0-5°С протягом ще 5 год. і потім залишають нагрітись до зовнішньої температури і перемішують протягом ночі (~14 год.). Ана1 ліз зразка, відібраного ІPC для Н ЯМР і показує повне поглинання кетиміну. Суміш охолоджують до 0-5°С. Додають ацетон (16,3 мл, ~6 екв.) повільно протягом 15-20 хвил. для споживання залишку гідриду (можлива екзотермія від ~3 до 15°С). Після додання реакційну суміш перемішують протягом 15 хвил. Додання МеОН (2 мл) для перевірки присутності залишку гідриду показує відсутність виходу гідрогену. Суміш залишають нагрітись до зовнішньої температури і переносять у 500-мілілітрову колбу Ерленмейера. Цю круглодонну колбу промивають уперед 160 мл МТВЕ. Отриману суміш перемішують енергійно протягом 5 хвил. Додають порціями розсіл (10 мл) протягом 2-3 хвил. для ініціювання осадження титанового реагенту. Суспензію перемішують енергійно протягом 30 хвил. і потім фільтрують через щільну подушку піску. Піщану подушку промивають 3x30 мл МТВЕ. Об'єднаний фільтрат перемішують з 150 мл розсолу протягом 1 год. і отримують мутну біфазну суміш, яку переносять у сепараційну воронку. Нижній водний шар видаляють і верхній органічний шар фільтрують через подушку целіту. Фільтрат випаровують до 57 сухості, отримуючи бажаний продукт N-{(S,S)-1-[4(1-ціано-1-метилетил)феніл]етил}-2-метилпропан2-сульфінамід (11,1 г) як жовтий сироп. Цей матеріал є 100%-но чистим і використовується у наступній операції без очищення Як показано у Ellman & співробітники, Tetrahedron, 40 (1999) 6709-6712, сирий продукт складається з суміші двох діастереомерів з перевагою одного. Співвідношення цих ізомерів репрезентує рівень асиметрії, породженої хіральною сульфінільною групою. Звичайно це співвідношення у цьому відновленні становить від 92:8 до 95:5 1 згідно з РХВР і аналізом НЯМР суміші сирих продуктів. 1 Н ЯМР 400 МГц (ХЛОРОФОРМ-D) 1,26 (s, 9Н), 1,53 (d, 3H, J=8 Гц), 1,75.(s, 6H), 4,52-4,62 (m, 1H), 7,40 (d, 2H, J=8 Гц), 7,48 (d, 2H, J=8 Гц). Операція b: інтермедіат 72 До 250-мілілітрової круглодонної колби, обладнаної магнітним стрижневим перемішувачем, з заміщеним сульфінамідом (11,1 г, 1 екв., вважається 100%-но чистим) приготовленим у попередній операції, додають діоксан (28,3 мл). Отриманий розчин охолоджують до 0-5°С у льодо-водяній ванні з перемішуванням. До цього розчину шприцом додають НСІ у діоксані (28,3 мл, 3 екв.). Негайно починається осадження білої твердої речовини. Отриману суспензію перемішують при 0-5°С (температура ванни) протягом 10 хвил. і отримують густий білий шлам. Охолоджувальну ванн видаляють і відбирають зразок реакційної суміші для аналізу ТШХ, який показує повне споживання сульфінаміду. Суміш розріджують EtOAc (28,3 мл) і перемішують протягом 5 хвил. при зовнішній температурі. Білу тверду речовину збирають всмоктувальним фільтруванням. Колбу промивають 2x10 мл EtOAc. Фільтрувальний осад промивають ще 2x10 мл EtOAc і потім висмоктують досуха під потоком нітрогену, далі сушать при 40-45°С у вакуумній печі протягом ночі, отримуючи 4,28 г кристалічної білої твердої речовини. Аналіз матеріалу спектро1 скопією Н ЯМР показує присутність лише бажаного амінгідрохлориду. Згідно з спостереженнями, оптична чистота цього хірального аміну, що корелюється з співвідношенням двох заміщених діастереомерних попередників сульфінаміду, становить від 84% до 90% (виключаючи похибку). Ці значення показують, що кінцева обробка НСІ не впливає на оптичну чистоту аміну. 1 Н ЯМР 400 МГц (ХЛОРОФОРМ-D) 1,20 (d, 3H, J=8 Гц), 1,70 (s, 3H), 1,71 (s, 3H), 3,73 (АВ q, 96764 58 1H, J=14, 6 Гц), 4,50 (br. s, 1H), 7,17 (d, 2H, J=8 Гц), 7,21-7,31 (m, 5H), 7,41 (d, 2Н, J=8 Гц). Амінну сіль НСІ (3,12 г, 13,89 ммоль, 1 екв.) розчиняють у 26 мл води у 100-мілілітровій круглодонній колбі з обережним магнітним перемішуванням. Додають водний 2М гідроксид натрію (7,6 мл, 1,1 екв.) для доведення рН до13-14 і отримують світлу емульсію. Додають МТВЕ (26 мл) і отриману суміш енергійно перемішують. Верхній органічний шар збирають і водний шар розріджують розсолом (15 мл) і потім екстрагують 26 мл МТВЕ. Органічні шари об'єднують, промивають розсолом (15 мл) і сушать над безводним сульфатом натрію. Видалення висушувача фільтруванням і випарювання фільтрату до сухості дають амін як блідожовте легке масло. Отримане масло розчиняють і ацетоні (26 мл) і перемішують під нітрогеном. Додають розчин (+)міндальної кислоти (2 г, 0,95 екв. відносно амінової солі НСІ) в ацетоні (15 мл) приготовленої в окремій посудині. Посудину промивають ацетоном (5 мл). Осадження кристалічної твердої речовини (міль) відбувається швидко і дає важку білу суспензію, яку перемішують протягом 15 хвил. і потім охолоджують до 0-5°С і перемішують протягом ще 30 хвил. Білу тверду речовину збирають всмоктувальним фільтруванням і промивають ацетоном (2x10 мл). Фільтрувальний осад сушать у вакуумній печі при 40-45°С протягом ночі (~16 год.) і отримують 3,67 г (77%) солі (+)-міндальної кислоти як кристалічної білої твердої речовини. 1 Н ЯМР цього продукт у дейтерованому хлороформі показує наявність лише одного енантіомеру аміну. У 2-літрову круглодонну колбу з верхнім відбором з перемішуванням вносять сіль міндальної кислоти (50,8 г, 149,3 ммоль, 1 екв.) і МТВЕ (1 л, 6,5 частин) для отримання суспензії. До цієї суспензії з помірним перемішуванням додають розчин NaOH (1M, 672 мл, 672 ммоль, 4,5 екв.). Отриману біфазну суміш добре перемішують при кімнатній температурі протягом 30 хвил. і потім переносять у сепараторну воронку. Шари розділяють, водний шар розріджують 500 мл розсолу і екстрагують МТВЕ (2x250 мл). Об'єднані органічні фази сушать над MgSO4. Видалення висушувача і випарювання фільтрату до сухості дають вільний амін як легке жовте масло (27,7 г, 99%). 1 Н ЯМР 400 МГц (ХЛОРОФОРМ-D) 1,20 (d, 3H, J=8 Гц), 1,70 (s, 3H), 1,71 (s, 3H), 3,73 (АВ quartet, 1H, J=14, 6 Гц), 4,50 (br. s, 1H), 7,17 (d, 2H, J=8 Гц), 7,21-7,31 (m, 5H), 7,41 (d, 2H, J=8 Гц). Схема 22. Енантіоселективний синтез (-)1-[4[1-аміноетил]феніл]циклобутан-1-карбонітрилу 59 Операція а: інтермедіат 73 1-(4-бромфеніл)циклобутанкарбонітрил З перемішуванням до суспензії гідриду натрію (60%-а сусп. у маслі, 12,24 г, 255 ммоль) у безводному ДМСО (240 мл) краплями додають 2-(4бромфеніл)ацетонітрил (20,0 г, 102 ммоль), розчинений у безводному ДМСО (40 мл). Через 45 хвил. реакційну суміш охолоджують до 0°С і повільно додають 1,3-дибромпропан (30,9 г, 15,5 мл, 153 ммоль) розчинений у безводному ДМСО (40 мл) для підтримання температури нижче 45°С. Реакційну суміш перемішують протягом ночі при кімнатній температурі і вливають у холодну воду (1,2 л). Продукт екстрагують СН2СІ2 (6x100 мл), сушать на MgSO4, фільтрують і концентрують під зниженим тиском. Продукт очищають флеш-хроматографією з елюентом гексан:EtOAc (100%95:5), отримуючи бажаний продукт 1-(4-бромфеніл)-циклобутанкарбонітрил (9,9 г, 41%) як жовтувате масло. 1 Н ЯМР (300 МГц, ХЛОРОФОРМ-D): 7,577,49 (2Н, m), 7,33-7,24 (2Н, m), 2,89-2,77 (2Н, m), 2,66-2,34 (3H, m), 2,15-1,99 (1Н, m). Операція b: інтермедіат 74 1-(4-ацетилфеніл)циклобутанкарбонітрил З перемішуванням до розчину 1-(4бромфеніл)циклобутанкарбонітрилу (2,8 г, 11,9 ммоль) у безводному ТГФ (70 мл) при -78°С додають n-бутиллітій (2М у с-гексані) (7,44 мл, 14,9 ммоль). Реакційну суміш перемішують при цій температурі 10 хвил., потім додають N-метокси-Nметил-ацетамід (2,50 мл, 23,8 ммоль) і розчин залишають нагрітись до кімнатної температури на 1 год. Повільно додають суміш розсолу (30 мл) і 1N НСІ (15 мл) і розчин екстрагують EtOAc (3x100 мл). Органічний шар сушать над MgSO4, фільтрують і концентрують під зниженим тиском. Сирий продукт очищають флеш-хроматографією, використовуючи градієнт 020% EtOAc у гексані, і отримують 1-(4ацетилфеніл)-циклобутанкарбонітрил (1,35 г, 57%) як жовтувате масло. 1 Н ЯМР (300 МГц, ХЛОРОФОРМ-D) 8,03 (2Н, m), 7,56-7,50 (2Н, m), 2,94-2,81 (2Н, m), 2,71-2,57 (2Н, m), 2,62 (3H, s), 2,57-2,40 (1Н, m), 2,18-2,05 (1Н, m). Операція с: інтермедіат 75 (-)-1-[4-[1-аміноетил]феніл]циклобутан-1карбонітрил 96764 60 До 1-(4-ацетилфеніл)циклобутанкарбонітрилу (8,6 г, 43,2 ммоль) і безводного ТГФ (85 мл) (S)-(-)трет-бутилсульфінамідом (5,7 г, 1,1 екв.) додають тетраетоксид титану (18 мл, 2 екв.). Отриману суміш нагрівають до флегми під нітрогеном і витримують під зворотним холодильником протягом 18 год. Відбирають аліквоту і аналізують на завершення реакції. Суміш охолоджують до кімнатної температури і потім до 0-5°С. Додають боргідрид натрію (2,4 г, 1,5 екв.) малими порціями протягом 10 хвил. Отриману суміш залишають нагрітись до кімнатної температури на 1 год. і потім перемішують при кімнатній температурі протягом 3 год. Реакцію гасять доданням ацетону (19 мл , 6 екв.) і отриману суміш розріджують розсолом (25 мл). З помірним перемішуванням додають МТВЕ (80 мл) і перемішування продовжують протягом ~15 хвил. Отриману двошарову суміш фільтрують через керамічну воронку, напаковану целітом. Органічний шар збирають і сушать над безводним сульфатом магнію. Випарювання цього органічного розчину до сухості під зниженим тиском дає бажаний заміщений хіральний сульфінамід як в'язкий сироп (13,3 г), який використовують без очищення. Сирий хіральний сульфінамід (13,3 г) розчиняють у діоксані (130 мл) з помірним перемішуванням у круглодонній колбі. До отриманою суміші додають 4М НСІ у діоксані (32,8 мл, 3 екв.) і перемішування продовжують при кімнатній температурі протягом ночі (~16 год.). Реакційну суміш випаровують до сухості на роторному випарювачі і залишок перетирають з EtOAc (100 мл) протягом 1 год. Білу тверду речовину фільтрують і промивають. Сушіння фільтрувального осаду у вакуумній печі протягом ночі дає бажаний хіральний амін (-)-1-[4[1-аміноетил]феніл]циклобутан-1-карбонітрил (5,0 г) у формі гідрохлориду як білу тверду речовину. 1 Н ЯМР (400 МГц, ДМСО-d6) 1,52 (3H, d, J=8 Гц), 1,94-2,07 (1Н, m), 2,20-2,35 (1Н, m), 2,55-2,67 (2Н, m), 2,70-2,80 (2Н, m), 4,44 (1Н, q, J=6,8 Гц), 7,52 (2Н, J=8,4 Гц), 7,61 (2Н, d, J=8,4 Гц), 8,40-8,90 (3H, m).
ДивитисяДодаткова інформація
Назва патенту англійськоюBenzimidazole derivatives useful in treatment of vanilloid receptor trpv1 related disorders
Автори англійськоюBrown William, Johnstone Shawn, Labrecque, Denis
Назва патенту російськоюПроизводные бензимидазола, полезные в лечении расстройств, связанных с рецептором trpvl
Автори російськоюБраун Вильям, Джонстон Шаун, Лабрекью Денис
МПК / Мітки
МПК: A61P 1/04, A61P 19/02, C07D 235/06, A61K 31/4184, A61P 29/00, A61P 25/00, A61P 13/10
Мітки: корисні, похідні, бензимідазолу, trpvl, лікуванні, розладів, рецептором, пов'язаних
Код посилання
<a href="https://ua.patents.su/47-96764-pokhidni-benzimidazolu-korisni-u-likuvanni-rozladiv-povyazanikh-z-receptorom-trpvl.html" target="_blank" rel="follow" title="База патентів України">Похідні бензімідазолу, корисні у лікуванні розладів, пов’язаних з рецептором trpvl</a>
Попередній патент: Бурошнекова машина
Випадковий патент: Захисна рукавичка