Спосіб одержання піролідиноксимів
Формула / Реферат
1. Спосіб одержання сполуки формули (І):

де
А - карбоніл -(С=О)-.
В вибраний з групи, яку складають оксадіазоловий цикл, амідогрупа формули -(C=O)-NR3R4 та -(CH2)n-X-R8,
де згаданий оксадіазоловий цикл відповідає будь-якій з формул:
 ,
, ,
,
R1 - Н або С1-С6-алкіл;
R2 вибраний з групи, яку складають арил, гетероарил та насичений або ненасичений 3-8-членний циклоалкіл;
R3 та R4 незалежно один від одного вибрані з групи, яку складають водень, С1-С6-алкіл, С2-С6-алкеніл, С2-С6-алкініл, алкоксигрупа, сульфаніл, ацил, алкоксикарбоніл, амінокарбоніл, насичений або ненасичений 3-8-членний циклоалкіл, який може містити від 1 гетероатома до 3 гетероатомів, вибраних із групи, до якої входять N, О, S, арил, гетероарил, С1-С6-алкіларил і С1-С6-алкілгетероарил;
X - О або NR9;
R8 вибраний з групи, яку складають водень, С1-С6-алкіл, С1-С6-алкіларил, гетероарил, С1-С6-алкілгетероарил, С2-С6-алкеніл, С2-С6-алкеніларил, С2-С6-алкенілгетероарил, С2-С6-алкініл, С2-С6-алкініларил, С2-С6-алкінілгетероарил, С3-С8-циклоалкіл, гетероциклоалкіл, С1-С6-алкілциклоалкіл, С1-С6-алкілгетероциклоалкіл, С1-С6-алкілкарбоксил, ацил, С1-С6-алкілацил, С1-С6-алкілацилоксигрупа, С1-С6-алкілалкоксигрупа, алкоксикарбоніл, С1-С6-алкілалкоксикарбоніл, амінокарбоніл, С1-С6-алкіламінокарбоніл, С1-С6-алкілациламіногрупа, С1-С6-алкілуреїдогрупа, аміногрупа, С1-С6-алкіламіногрупа, сульфонілоксигрупа, С1-С6-алкілсульфонілоксигрупа, сульфоніл, С1-С6-алкілсульфоніл, сульфініл, С1-С6-алкілсульфініл, С1-С6-алкілсульфаніл та С1-С6-алкілсульфоніламіногрупа;
R7 вибраний з групи, яку складають водень, сульфоніл, аміногрупа, С1-С6-алкіл, С2-С6-алкеніл, С2-С6-алкініл, де згадані алкільні, алкенільні, алкінільні ланцюги можуть бути перервані гетероатомом, вибраним з групи, до якої входять N, О та S, арил, гетероарил, насичений або ненасичений 3-8-членний циклоалкіл, гетероциклоалкіл, де згадані циклоалкіл, гетероциклоалкіл, арил або гетероарил можуть бути факультативно конденсованими з 1-2 додатковими циклоалкілом, гетероциклоалкілом, арилом або гетероарилом, ацил, С1-С6-алкіларил, С1-С6-алкілгетероарил, С1-С6-алкеніларил, С1-С6-алкенілгетероарил, С1-С6-алкініларил, С1-С6-алкінілгетероарил, С1-С6-алкілциклоалкіл, С1-С6-алкілгетероциклоалкіл, С1-С6-алкенілциклоалкіл, С1-С6-алкенілгетероциклоалкіл, С1-С6-алкінілциклоалкіл, С1-С6-алкінілгетероциклоалкіл, алкоксикарбоніл, амінокарбоніл, С1-С6-алкілкарбоксил, С1-С6-алкілацил, С1-С6-алкілацилоксигрупа, С1-С6-алкілалкоксигрупа, С1-С6-алкілалкоксикарбоніл, С1-С6-алкіламінокарбоніл, С1-С6-алкілациламіногрупа, С1-С6-алкілуреїдогрупа, С1-С6-алкіламіногрупа, С1-С6-алкіламоній, С1-С6-алкілсульфонілоксигрупа, С1-С6-алкілсульфоніл, С1-С6-алкілсульфініл, С1-С6-алкілсульфаніл, С1-С6-алкілсульфоніламіногрупа, С1-С6-алкіламіносульфоніл, гідроксил, галоген та ціаногрупа;
R9 вибраний з групи, яку складають водень, С1-С6-алкіл, С1-С6-алкіларил, С1-С6-алкілгетероарил, арил та гетероарил;
R8 та R9 спільно з атомом N, до якого вони приєднані, можуть утворювати 5-8-членний насичений або ненасичений гетероциклоалкіл; і
n є ціле число від 1 до 3;
причому у згаданому способі здійснюють такі стадії:
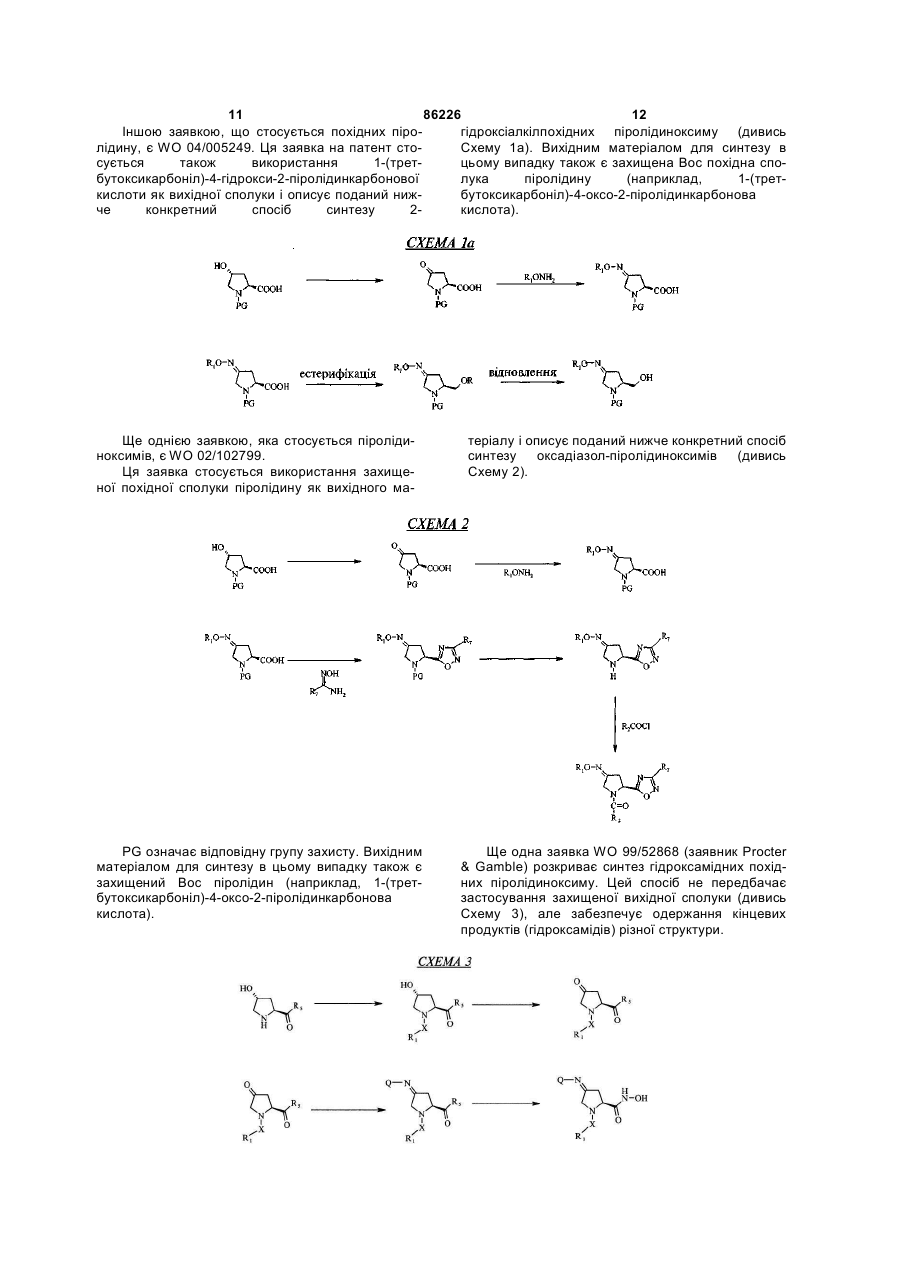
стадія 1: перетворення піролідину формули (II) в ацильну похідну формули (IV) з використанням ацилювального агента (III):
 ;
;
стадія 2: окиснення ацильного похідного (IV) окиснювальним агентом з одержанням піролідону формули (V):
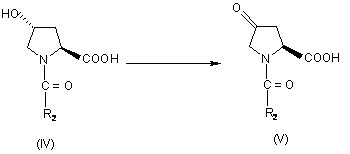 ;
;
стадія 3: перетворення піролідону формули (V) у сполуку (VII) з використанням відповідного алкоксиламіну, арилоксиламіну або гідроксиламіну загальної формули (VI):
 ;
;
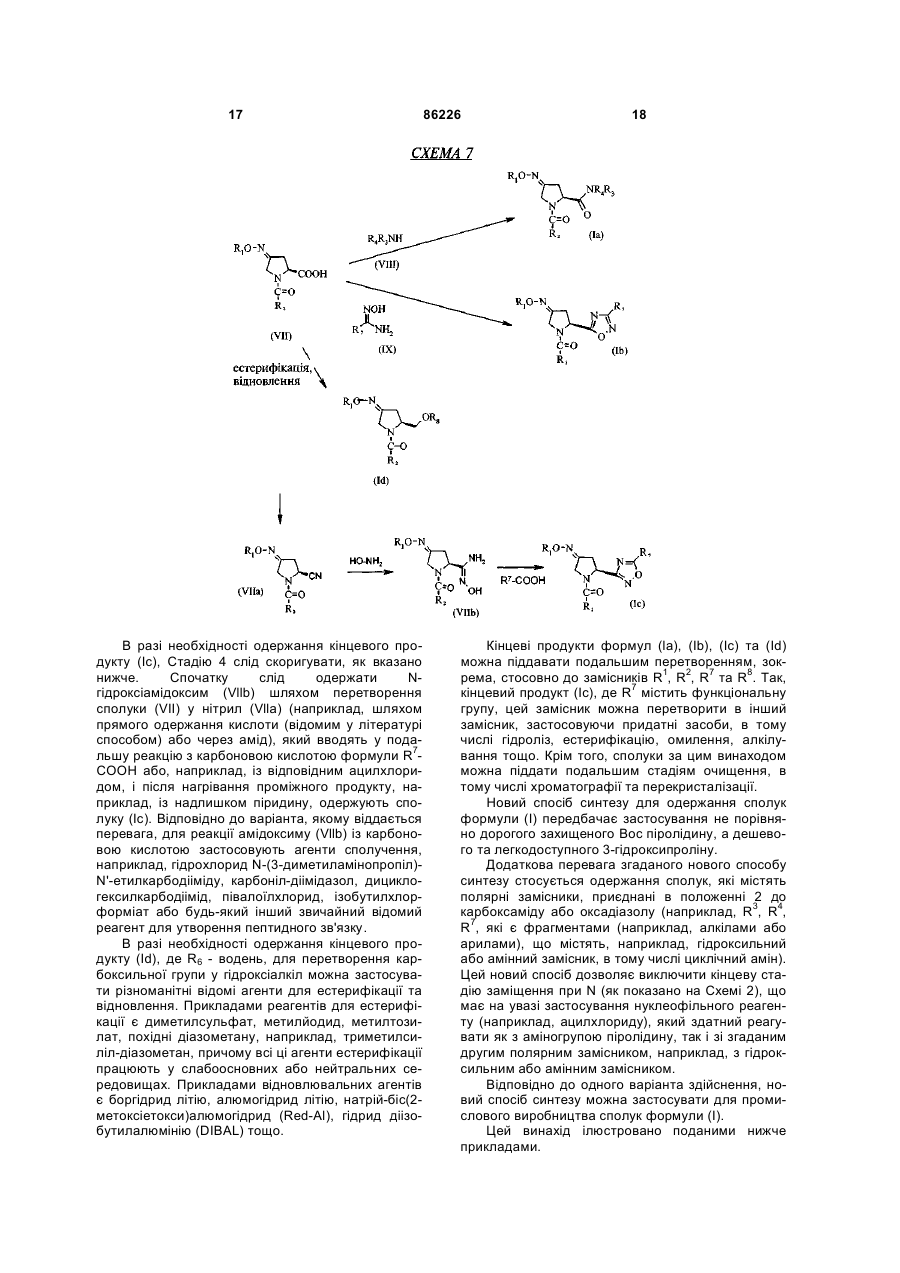
стадія 4: перетворення сполуки (VII) із застосуванням аміну загальної формули (VIII) або N-гідроксіамідину загальної формули (IX) з одержанням сполуки (Іа) та сполуки (Іb), або перетворення сполуки (VII) спочатку у нітрил (VIIa), який потім перетворюють у гідроксіамідин (VIIb), який потім вводять у реакцію з карбоновою кислотою R7-COOH, одержуючи сполуку (Іс), або спочатку піддають естерифікації, а потім відновлюють сполуку (VII) із використанням відповідно естерифікувального або відновлювального агента, і одержують сполуку (Id):
 .
.
2. Спосіб одержання сполуки формули (І) за п. 1:
 , (І)
, (І)
де
А - карбоніл -(С=О)-;
В - амідогрупа формули -(C=O)-NR3R4 або оксадіазоловий цикл будь-якої з формул:
 ,
, ,
,
R7 вибраний з групи, яку складають водень, сульфоніл, аміногрупа, С1-С6-алкіл, С2-С6-алкеніл, С2-С6-алкініл, де згадані алкільні, алкенільні, алкінільні ланцюги можуть бути перервані гетероатомом, вибраним із групи, до якої входять N, О та S, арил, гетероарил, насичений або ненасичений 3-8-членний циклоалкіл, гетероциклоалкіл, де згадані циклоалкіл, гетероциклоалкіл, арил або гетероарил можуть бути факультативно конденсованими з 1-2 додатковими циклоалкілом, гетероциклоалкілом, арилом або гетероарилом, ацил, С1-С6-алкіларил, С1-С6-алкілгетероарил, С1-С6-алкеніларил, С1-С6-алкенілгетероарил, С1-С6-алкініларил, С1-С6-алкінілгетероарил, С1-С6-алкілциклоалкіл, С1-С6-алкілгетероциклоалкіл, С1-С6-алкенілциклоалкіл, С1-С6-алкенілгетероциклоалкіл, С1-С6-алкініл циклоалкіл, С1-С6-алкінілгетероциклоалкіл, алкоксикарбоніл, амінокарбоніл, С1-С6-алкілкарбоксил, С1-С6-алкілацил, С1-С6-алкілацилоксигрупа, С1-С6-алкілалкоксигрупа, С1-С6-алкілалкоксикарбоніл, С1-С6-алкіламінокарбоніл, С1-С6-алкілациламіногрупа, С1-С6-алкілуреїдогрупа, С1-С6-алкіламіногрупа, С1-С6-алкіламоній, С1-С6-алкілсульфонілоксигрупа, С1-С6-алкілсульфоніл, С1-С6-алкілсульфініл, С1-С6-алкілсульфаніл, С1-С6-алкілсульфоніламіногрупа, С1-С6-алкіламіносульфоніл, гідроксил, галоген та ціаногрупа;
R1 - Н або С1-С6-алкіл;
R2 вибраний з групи, яку складають арил, гетероарил та насичений або ненасичений 3-8-членний циклоалкіл;
R3 та R4 незалежно один від одного вибрані з групи, яку складають водень, С1-С6-алкіл, С2-С6-алкеніл, С2-С6-алкініл, алкоксигрупа, сульфаніл, ацил, алкоксикарбоніл, амінокарбоніл, насичений або ненасичений 3-8-членний циклоалкіл, який може містити 1-3 гетероатоми, вибрані із групи, до якої входять N, О, S, арил, гетероарил, С1-С6-алкіларил і С1-С6-алкілгетероарил;
причому в згаданому способі здійснюють такі стадії:
стадія 1: перетворення піролідину формули (ІІ) в ацильну похідну формули (IV) з використанням ацилювального агента (III):
 ;
;
стадія 2: окиснення ацильної похідної (IV) окиснювальним агентом з одержанням піролідону формули (V):
 ;
;
стадія 3: перетворення піролідону формули (V) у сполуку (VII) із використанням придатного алкоксиламіну, арилоксиламіну чи гідроксиламіну загальної формули (VI)
 ;
;
стадія 4: перетворення сполуки (VII) із застосуванням аміну загальної формули (VIII) або N-гідроксіамідину загальної формули (IX) з одержанням сполук (Іа) та (Іb), або перетворення сполуки (VII) спочатку у нітрил (VIIa), який потім перетворюють у гідроксіамідин (VIIb), який потім вводять у реакцію з карбоновою кислотою R7-COOH, одержуючи сполуку (Іс):
 .
.
3. Спосіб за п. 1 або п. 2, який відрізняється тим, що згаданим ацилхлоридом на стадії 1 є 1'1-біфеніл-4-карбонілхлорид або 2'-метил-1'1-біфеніл-4-карбонілхлорид.
4. Спосіб за будь-яким із пп. 1-3, який відрізняється тим, що згаданим окиснювальним агентом на стадії 2 є комплекс піридину з триоксидом сірки (Py-SO3) у комбінації з ДМСО.
5. Спосіб за будь-яким із пп. 2-4, який відрізняється тим, що реакцію проводять у присутності триетиламіну.
6. Спосіб за будь-яким із пп. 1-5, який відрізняється тим, що алкоксиламіном, що застосовують на стадії 3, є гідрохлорид О-метилгідроксиламіну.
7. Спосіб за будь-яким із пп. 1-6, який відрізняється тим, що R1 - метил, R2 - біфеніл.
8. Спосіб за будь-яким із пп. 1-7, який відрізняється тим, що В -амідогрупа формули -(C=O)NHR5, де R5 - С1-С6-алкіларил.
9. Спосіб за п. 8, який відрізняється тим, що R5 - фенілетил, заміщений аміногрупою або гідроксилом.
10. Спосіб за будь-яким із пп. 1-7, який відрізняється тим, що В - 1,2,4-оксадіазоловий замісник
 ,
, ,
,
де R7 - С1-С6-алкіл або циклоалкіл, який факультативно містить 1 гетероатом або 2 гетероатоми.
11. Спосіб за будь-яким із пп. 1, 3, 4 або 6, 7, де В є -(CH2)n-X-R8, де X - О, R8 - водень; і n=1.
12. Спосіб за будь-яким із пп. 1-11, який відрізняється тим, що згадана сполука вибрана з групи, яку складають:
(2S,4E та 4Z)-N-[(2S)-2-гідрокси-2-фенілетил]-4-(метоксііміно)-1-[(2'-метил[1,1'-біфеніл]-4-іл)карбоніл]-2-піролідинкарбоксамід;
(3E,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(2-гідроксіетил)-1,2,4-оксадіазол-5-іл]-3-піролідинон-О-метилоксим,
(3Z,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(2-гідроксіетил)-1,2,4-оксадіазол-5-іл]-3-піролідинон-О-метилоксим,
(3E,5S)-5-[3-(2-гідроксіетил)-1,2,4-оксадіазол-5-іл]-1-[(2'-метилбіфеніл-4-іл)карбоніл]піролідин-3-он-О-метилоксим,
(3Z,5S)-5-[3-(2-гідроксіетил)-1,2,4-оксадіазол-5-іл]-1-[(2'-метилбіфеніл-4-іл)карбоніл]піролідин-3-он-О-метилоксим,
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[(диметиламіно)метил]-1,2,4-оксадіазол-3-іл}-3-піролідинон-О-метилоксим,
(3Z,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[(диметиламіно)метил]-1,2,4-оксадіазол-3-іл}-3-піролідинон-О-метилоксим,
(3E,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[(диметиламіно)метил]-1,2,4-оксадіазол-3-іл}-3-піролідинон-О-метилоксим,
(3EZ,5S)-5-{5-[(диметиламіно)метил]-1,2,4-оксадіазол-3-іл}-1-[(2'-метилбіфеніл-4-іл)карбоніл]-піролідин-3-он-О-метилоксим,
(3Z,5S)-5-{5-[(диметиламіно)метил]-1,2,4-оксадіазол-3-іл}-1-[(2'-метилбіфеніл-4-іл)карбоніл]-піролідин-3-он-О-метилоксим,
(3E,5S)-5-{5-[(диметиламіно)метил]-1,2,4-оксадіазол-3-іл}-1-[(2'-метилбіфеніл-4-іл)карбоніл]-піролідин-3-он-О-метилоксим і
(3Z/E, 5S)-1-((біфеніл-4-ілкарбоніл)-5-гідроксиметил)-піролідин-3-он-О-метилоксим.
Текст
1. Спосіб одержання сполуки формули (І): R1O N C2 2 (19) 1 3 86226 С6-алкіламіногрупа, С1-С6-алкіламоній, С1-С6алкілсульфонілоксигрупа, С1-С6-алкілсульфоніл, С1-С6-алкілсульфініл, С1-С6-алкілсульфаніл, С1-С6алкілсульфоніламіногрупа, С1-С6R O N алкіламіносульфоніл, гідроксил, галоген та ціаногрупа; COOH N R9 вибраний з групи, яку складають водень, С1-С6C=O алкіл, С1-С6-алкіларил, С1-С6-алкілгетероарил, R арил та гетероарил; (VII) R8 та R9 спільно з атомом N, до якого вони приєдестерифікація нані, можуть утворювати 5-8-членний насичений відновлення або ненасичений гетероциклоалкіл; і n є ціле число від 1 до 3; причому у згаданому способі здійснюють такі стадії: стадія 1: перетворення піролідину формули (II) в ацильну похідну формули (IV) з використанням R O N ацилювального агента (III): 4 R1O N NR4R3 N O C= O R4R3NH R2 (Ia) 1 (VIII) R1O N R7 NOH 2 N N NH2 R7 O C=O (IX) (Ib) R2 R1 O N OR8 N C= O R2 (Id) R1 O N R1O 1 C=O C=O COOH N COOH N H (VIIa) C=O + R2COCl (II) (IV) N C=O C=O R2 R2 ; (V) (IV) ; стадія 3: перетворення піролідону формули (V) у сполуку (VII) з використанням відповідного алкоксиламіну, арилоксиламіну або гідроксиламіну загальної формули (VI): , (І) де А - карбоніл -(С=О)-; В - амідогрупа формули -(C=O)-NR3R4 або оксадіазоловий цикл будь-якої з формул: 2 4 5 O N 1 2 N COOH + R1ONH2 (V) COOH C=O C=O R2 N (VI) R2 (VII) ; стадія 4: перетворення сполуки (VII) із застосуванням аміну загальної формули (VIII) або Nгідроксіамідину загальної формули (IX) з одержанням сполуки (Іа) та сполуки (Іb), або перетворення сполуки (VII) спочатку у нітрил (VIIa), який потім перетворюють у гідроксіамідин (VIIb), який потім вводять у реакцію з карбоновою кислотою R7COOH, одержуючи сполуку (Іс), або спочатку піддають естерифікації, а потім відновлюють сполуку (VII) із використанням відповідно естерифікувального або відновлювального агента, і одержують сполуку (Id): N N 3 R7 O 3 1 N 4 5 R7 ( Xb ) , , R7 вибраний з групи, яку складають водень, сульфоніл, аміногрупа, С1-С6-алкіл, С2-С6-алкеніл, С2С6-алкініл, де згадані алкільні, алкенільні, алкінільні ланцюги можуть бути перервані гетероатомом, вибраним із групи, до якої входять N, О та S, арил, гетероарил, насичений або ненасичений 3-8членний циклоалкіл, гетероциклоалкіл, де згадані циклоалкіл, гетероциклоалкіл, арил або гетероарил можуть бути факультативно конденсованими з 1-2 додатковими циклоалкілом, гетероциклоалкілом, арилом або гетероарилом, ацил, С1-С6алкіларил, С1-С6-алкілгетероарил, С1-С6алкеніларил, С1-С6-алкенілгетероарил, С1-С6алкініларил, С1-С6-алкінілгетероарил, С1-С6алкілциклоалкіл, С1-С6-алкілгетероциклоалкіл, С1С6-алкенілциклоалкіл, С1-С6алкенілгетероциклоалкіл, С1-С6-алкініл циклоалкіл, С1-С6-алкінілгетероциклоалкіл, алкоксикарбоніл, амінокарбоніл, С1-С6-алкілкарбоксил, С1-С6( Xa ) N B R2 COOH N R1O (Ic) A COOH O R2 (VIIb) O N N O C= O OH R2 R2 ; стадія 2: окиснення ацильного похідного (IV) окиснювальним агентом з одержанням піролідону формули (V): HO R7 - COOH N N . 2. Спосіб одержання сполуки формули (І) за п. 1: R1O N R2 (III) R7 N N CN N N NH2 HO - NH2 HO HO N 5 86226 6 алкілацил, С1-С6-алкілацилоксигрупа, С1-С6ням сполук (Іа) та (Іb), або перетворення сполуки алкілалкоксигрупа, С1-С6-алкілалкоксикарбоніл, (VII) спочатку у нітрил (VIIa), який потім перетвоС1-С6-алкіламінокарбоніл, С1-С6рюють у гідроксіамідин (VIIb), який потім вводять у алкілациламіногрупа, С1-С6-алкілуреїдогрупа, С1реакцію з карбоновою кислотою R7-COOH, одерС6-алкіламіногрупа, С1-С6-алкіламоній, С1-С6жуючи сполуку (Іс): R O N алкілсульфонілоксигрупа, С1-С6-алкілсульфоніл, NR R С1-С6-алкілсульфініл, С1-С6-алкілсульфаніл, С1-С6N O алкілсульфоніламіногрупа, С1-С6C=O алкіламіносульфоніл, гідроксил, галоген та ціаногR R NH R (Ia) R O N рупа; (VIII) R1 - Н або С1-С6-алкіл; COOH N R2 вибраний з групи, яку складають арил, гетероаRO N C=O R рил та насичений або ненасичений 3-8-членний NOH N R циклоалкіл; N N O NH (VII) R R3 та R4 незалежно один від одного вибрані з груC=O (IX) (Ib) пи, яку складають водень, С1-С6-алкіл, С2-С6R алкеніл, С2-С6-алкініл, алкоксигрупа, сульфаніл, ацил, алкоксикарбоніл, амінокарбоніл, насичений R O N R O N або ненасичений 3-8-членний циклоалкіл, який RO N R N NH HO - NH може містити 1-3 гетероатоми, вибрані із групи, до O N N N CN N R - COOH N якої входять N, О, S, арил, гетероарил, С1-С6C=O C=O OH C=O алкіларил і С1-С6-алкілгетероарил; R R R (VIIa) причому в згаданому способі здійснюють такі ста(VIIb) (Ic) дії: . стадія 1: перетворення піролідину формули (ІІ) в 3. Спосіб за п. 1 або п. 2, який відрізняється тим, ацильну похідну формули (IV) з використанням що згаданим ацилхлоридом на стадії 1 є 1'1ацилювального агента (III): біфеніл-4-карбонілхлорид або 2'-метил-1'1HO біфеніл-4-карбонілхлорид. 4. Спосіб за будь-яким із пп. 1-3, який відрізняHO COOH N ється тим, що згаданим окиснювальним агентом на стадії 2 є комплекс піридину з триоксидом сірки C=O COOH + R2COCl N (Py-SO3) у комбінації з ДМСО. H R2 5. Спосіб за будь-яким із пп. 2-4, який відрізня(III) ється тим, що реакцію проводять у присутності (IV) (II) триетиламіну. ; 6. Спосіб за будь-яким із пп. 1-5, який відрізнястадія 2: окиснення ацильної похідної (IV) окиснюється тим, що алкоксиламіном, що застосовують вальним агентом з одержанням піролідону форна стадії 3, є гідрохлорид О-метилгідроксиламіну. мули (V): 7. Спосіб за будь-яким із пп. 1-6, який відрізняO HO ється тим, що R1 - метил, R2 - біфеніл. 8. Спосіб за будь-яким із пп. 1-7, який відрізняється тим, що В -амідогрупа формули COOH N COOH N (C=O)NHR5, де R5 - С1-С6-алкіларил. 9. Спосіб за п. 8, який відрізняється тим, що R5 C=O C=O фенілетил, заміщений аміногрупою або гідроксиR2 R2 лом. ; 10. Спосіб за будь-яким із пп. 1-7, який відрізня(V) (IV) ється тим, що В - 1,2,4-оксадіазоловий замісник ; 2 4 стадія 3: перетворення піролідону формули (V) у N 5 N сполуку (VII) із використанням придатного алкок3 O R7 3 1 силаміну, арилоксиламіну чи гідроксиламіну загаN O N льної формули (VI) 1 4 4 3 3 2 1 1 7 2 2 7 2 1 1 1 7 2 2 7 2 2 2 R1O O COOH + R1ONH2 N (V) N COOH C=O C=O R2 1 N (VI) R2 (VII) ; стадія 4: перетворення сполуки (VII) із застосуванням аміну загальної формули (VIII) або Nгідроксіамідину загальної формули (IX) з одержан 2 4 5 R7 ( Xb ) , , де R7 - С1-С6-алкіл або циклоалкіл, який факультативно містить 1 гетероатом або 2 гетероатоми. 11. Спосіб за будь-яким із пп. 1, 3, 4 або 6, 7, де В є -(CH2)n-X-R8, де X - О, R8 - водень; і n=1. 12. Спосіб за будь-яким із пп. 1-11, який відрізняється тим, що згадана сполука вибрана з групи, яку складають: ( Xa ) 7 86226 8 (2S,4E та 4Z)-N-[(2S)-2-гідрокси-2-фенілетил]-4(3Z,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5(метоксііміно)-1-[(2'-метил[1,1'-біфеніл]-4[(диметиламіно)метил]-1,2,4-оксадіазол-3-іл}-3іл)карбоніл]-2-піролідинкарбоксамід; піролідинон-О-метилоксим, (3E,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(2(3E,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5гідроксіетил)-1,2,4-оксадіазол-5-іл]-3-піролідинон[(диметиламіно)метил]-1,2,4-оксадіазол-3-іл}-3О-метилоксим, піролідинон-О-метилоксим, (3Z,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(2(3EZ,5S)-5-{5-[(диметиламіно)метил]-1,2,4гідроксіетил)-1,2,4-оксадіазол-5-іл]-3-піролідиноноксадіазол-3-іл}-1-[(2'-метилбіфеніл-4-іл)карбоніл]О-метилоксим, піролідин-3-он-О-метилоксим, (3E,5S)-5-[3-(2-гідроксіетил)-1,2,4-оксадіазол-5-іл](3Z,5S)-5-{5-[(диметиламіно)метил]-1,2,41-[(2'-метилбіфеніл-4-іл)карбоніл]піролідин-3-он-Ооксадіазол-3-іл}-1-[(2'-метилбіфеніл-4-іл)карбоніл]метилоксим, піролідин-3-он-О-метилоксим, (3Z,5S)-5-[3-(2-гідроксіетил)-1,2,4-оксадіазол-5-іл](3E,5S)-5-{5-[(диметиламіно)метил]-1,2,41-[(2'-метилбіфеніл-4-іл)карбоніл]піролідин-3-он-Ооксадіазол-3-іл}-1-[(2'-метилбіфеніл-4-іл)карбоніл]метилоксим, піролідин-3-он-О-метилоксим і (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5(3Z/E, 5S)-1-((біфеніл-4-ілкарбоніл)-5[(диметиламіно)метил]-1,2,4-оксадіазол-3-іл}-3гідроксиметил)-піролідин-3-он-О-метилоксим. піролідинон-О-метилоксим, Цей винахід стосується нового способу синтезу для одержання піролідиноксимів загальної формули (І). Ці сполуки є корисними при лікуванні та/або профілактиці передчасних пологів, передчасного народження життєздатного, але недоношеного, плода та дисменореї. Галузь, якої стосується винахід Цей винахід стосується нового способу синтезу для одержання піролідиноксимів загальної формули (І): де А - карбоніл -(С=О)-. В вибраний з групи, яку складають заміщений або незаміщений оксадіазоловий цикл, амідогрупа формули -(C=O)-NR3R4 та -(CH2)n-X-R8, R1 - Η або заміщений або незаміщений С1-С6алкіл. Відповідно до варіанта, якому віддається перевага, R1 - метил. R2 вибраний з групи, до якої входять або яку складають заміщений або незаміщений арил, заміщений або незаміщений гетероарил, заміщений або незаміщений насичений або ненасичений 3-8членний циклоалкіл. Більша перевага віддається арилу, зокрема, фенілу, факультативно заміщеному, наприклад, додатковою фенільною групою (з утворенням, таким чином, біфенільної групи). R3 та R4 незалежно один від одного вибрані з групи, до якої входять або яку складають водень, заміщений або незаміщений С1-С6-алкіл, заміщений або незаміщений С2-С6-алкеніл, заміщений або незаміщений С2-С6-алкініл, заміщена або незаміщена алкоксигрупа, заміщений або незаміщений сульфаніл, ацил, алкоксикарбоніл, амінокарбоніл, заміщений або незаміщений насичений або ненасичений 3-8-членний циклоалкіл, який може містити від 1 гетероатому до 3 гетероатомів, вибраних із групи, до якої входять N, О, S, заміщений або незаміщений арил, заміщений або незаміщений гетероарил, заміщений або незаміщений С1С6-алкіларил, заміщений або незаміщений С1-С6алкіл-гетероарил. R8 вибраний з групи, яку складають водень, С1-С6-алкіл, С1-С6-алкіл-арил, гетероарил, С1-С6алкілгетероарил, С2-С6-алкеніл, С2-С6алкеніларил, С2-С6-алкенілгетероарил, С2-С6алкініл, С2-С6-алкініларил, С2-С6-алкінілгетероарил, С3-С8-циклоалкіл, гетероциклоалкіл, С1-С6-алкілциклоалкіл, С1-С6алкілгетероциклоалкіл, С1-С6-алкілкарбоксил, ацил, С1-С6-алкілацил, С1-С6-алкілацилоксигрупа, С1-С6-алкілалкоксигрупа, алкоксикарбоніл, C1-C6алкілалкоксикарбоніл, амінокарбоніл, С1-С6алкіламінокарбоніл, С1-С6-алкіл-ациламіногрупа, С1-С6-алкілуреїдогрупа, аміногрупа, С1-С6алкіламіногрупа, сульфонілоксигрупа, С1-С6алкілсульфонілоксигрупа, сульфоніл, С1-С6-алкілсульфоніл, сульфініл, С1-С6-алкілсульфініл, С1-С6алкілсульфаніл та С1-С6алкілсульфоніламіногрупа; X вибраний з групи, яку складають О та NR9; R9 вибраний з групи, яку складають Н, С1-С6алкіл, С1-С6-алкіларил, С1-С6-алкілгетероарил, арил та гетероарил; R8 та R9 спільно з атомом N, до якого вони приєднані, можуть утворювати 5-8-членний насичений або ненасичений гетероциклоалкіл; n є ціле число від 1 до 3. Похідними піролідину, яким віддається перевага, є сполуки формули І, де R1 - метил, R2 - заміщений або незаміщений біфеніл. Відповідно до одного конкретного варіанта здійснення винаходу, В є амідогрупа формули (C=O)NHR5, де R5 - заміщений або незаміщений C1-C6-алкіларил, наприклад, фенілетил, факультативно заміщений гідрофільними групами, в тому числі аміногрупою або гідроксилом. Відповідно до іншого конкретного варіанта здійснення винаходу, замісник В є 1,2,4оксадіазольний замісник, який може бути приєднаний до піролідинового циклу відповідно до нижчезазначених схем (Ха) або (Хb): 9 86226 10 ний С1-С6-алкілацил, заміщена або незаміщена С1С6-алкілацилоксигрупа, заміщена або незаміщена С1-С6-алкіл-алкоксигрупа, заміщений або незаміщений С1-С6-алкілалкоксикарбоніл, заміщений або незаміщений С1-С6-алкіламінокарбоніл, заміщена або незаміщена С1-С6-алкілациламіногрупа, заміщена або незаміщена С1-С6-алкіл-уреїдогрупа, У згаданих формулах (Ха) та (Xb), R7 вибразаміщена або незаміщена С1-С6-алкіламіногрупа, ний з групи, до якої входять або яку складають заміщений або незаміщений С1-С6-алкіламоній, водень, сульфоніл, аміногрупа, заміщений або заміщена або незаміщена С1-С6-алкілнезаміщений С1-С6-алкіл, заміщений або незамісульфонілоксигрупа, заміщений або незаміщений щений С2-С6-алкеніл, заміщений або незаміщений С1-С6-алкілсульфоніл, заміщений або незаміщений С2-С6-алкініл, де згадані алкільні, алкенільні, алкіС1-С6-алкілсульфініл, заміщений або незаміщений нільні ланцюги можуть бути перервані гетероатоС1-С6-алкілсульфаніл, заміщена або незаміщена мом, вибраним з групи, до якої входять Ν, Ο та S, С1-С6-алкіл-сульфоніламіногрупа, заміщений або заміщений або незаміщений арил, заміщений або незаміщений С1-С6-алкіламіносульфоніл, гідрокнезаміщений гетероарил, заміщений або незамісил, галоген, ціаногрупа. щений насичений або ненасичений 3-8-членний Відповідно до одного конкретного варіанта циклоалкіл, заміщений або незаміщений гетероциздійснення винаходу, R7 є заміщений або незаміклоалкіл, де згадані циклоалкіл, гетероциклоалкіл, щений C1-С6-алкіл, наприклад, метил або етил, арил або гетероарил можуть бути конденсованими який може бути факультативно заміщений гідроз 1-2 додатковими циклоалкілом, гетероциклоалкіфільними групами, в тому числі аміногрупою або лом, арилом або гетероарилом, ацил, заміщений гідроксилом, або R7 є 3-8-членний циклоалкіл, або незаміщений С1-С6-алкіларил, заміщений або який факультативно містить 1 гетероатом або 2 незаміщений С1-С6-алкілгетероарил, заміщений гетероатоми, наприклад, піролідин, фураніл, тієабо незаміщений С1-С6-алкеніларил, заміщений ніл, піперидин, морфолін або піперазин. або незаміщений С1-С6-алкеніл-гетероарил, заміВідповідно до подальшого конкретного варіанщений або незаміщений С1-С6-алкініларил, заміта здійснення винаходу, замісник В є група форщений або незаміщений С1-С6-алкінілгетероарил, мули -(CH2)n-X-R8, де X - О, R8 - водень та n=1. заміщений або незаміщений С1-С6У способі застосовуються наявні на ринку або алкілциклоалкіл, заміщений або незаміщений С1легко одержувані вихідні сполуки. С6-алкілгетероциклоалкіл, заміщений або незаміПередумови створення винаходу щений С1-С6-алкенілциклоалкіл, заміщений або Принципи синтезу для одержання піролідинокнезаміщений С1-С6-алкенілгетероциклоалкіл, засимів формули (І) добре відомі. Синтез цих сполук міщений або незаміщений С1-С6розкрито у кількох документах. алкінілциклоалкіл, заміщений або незаміщений С1Наприклад, у WO 01/72705 описано синтез С6-алкініл-гетероциклоалкіл, заміщений або незаамідних похідних піролідиноксиму, показаних нижміщений алкоксикарбоніл, заміщений або незаміче (Схема 1). щений амінокарбоніл, заміщений або незаміщений С1-С6-алкіл-карбоксил, заміщений або незаміще PG означає групу захисту. Типовою вихідною сполукою, яка застосовується у WO 01/72705, є захищена Вос похідна сполука піролідину (наприклад, 1-(трет-бутоксикарбоніл)-4-гідрокси-2 піролідинкарбонова кислота або продукт її подальшого перетворення 1-(трет-бутоксикарбоніл)-4оксо-2-піролідинкарбонова кислота; дивись синтез проміжної сполуки 7). 11 86226 12 Іншою заявкою, що стосується похідних пірогідроксіалкілпохідних піролідиноксиму (дивись лідину, є WO 04/005249. Ця заявка на патент стоСхему 1а). Вихідним матеріалом для синтезу в сується також використання 1-(третцьому випадку також є захищена Вос похідна спобутоксикарбоніл)-4-гідрокси-2-піролідинкарбонової лука піролідину (наприклад, 1-(треткислоти як вихідної сполуки і описує поданий нижбутоксикарбоніл)-4-оксо-2-піролідинкарбонова че конкретний спосіб синтезу 2кислота). Ще однією заявкою, яка стосується піролідиноксимів, є WO 02/102799. Ця заявка стосується використання захищеної похідної сполуки піролідину як вихідного ма теріалу і описує поданий нижче конкретний спосіб синтезу оксадіазол-піролідиноксимів (дивись Схему 2). PG означає відповідну групу захисту. Вихідним матеріалом для синтезу в цьому випадку також є захищений Вос піролідин (наприклад, 1-(третбутоксикарбоніл)-4-оксо-2-піролідинкарбонова кислота). Ще одна заявка WO 99/52868 (заявник Procter & Gamble) розкриває синтез гідроксамідних похідних піролідиноксиму. Цей спосіб не передбачає застосування захищеної вихідної сполуки (дивись Схему 3), але забезпечує одержання кінцевих продуктів (гідроксамідів) різної структури. 13 Цей винахід пропонує новий спосіб синтезу піролідиноксимів формули (І), який не вимагає використання захищеного Вос піролідину. Опис винаходу Цей винахід дозволяє подолати вищезазначені утруднення шляхом застосування схеми синтезу, яка включає чотири стадії і, крім того, передбачає використання як вихідні матеріали сполук, які можуть бути легко синтезовані або є наявними на ринку. Нижче подано визначення термінів для позначення різноманітних хімічних груп, які складають сполуки за цим винаходом; ці визначення зберігають незмінну чинність в описі винаходу та у пунктах формули винаходу за винятком випадків, коли подане відкритим текстом інше визначення є більш широким. Термін "С1-С6-алкіл" стосується одновалентних алкільних груп, що містять від 1 атому до 6 атомів вуглецю. Прикладами значень цього терміну є метил, етил, «-пропіл, ізопропіл, н-бутил, ізобутил, трет-бутил, н-гексил тощо. Термін "арил" означає ненасичену ароматичну карбоциклічну групу, яка містить від 6 атомів до 14 атомів вуглецю і включає один цикл (наприклад, феніл) або кілька конденсованих циклів (наприклад, нафтил). До арилів, яким віддається перевага, належать феніл, нафтил, фенантрил тощо. Термін "гетероарил" означає моноциклічну гетероароматичну групу або біциклічну чи трициклічну гетероароматичну групу з конденсованими циклами. До конкретних прикладів гетероароматичних груп належать факультативно заміщені піридил, піроліл, фурил, тієніл, імідазоліл, оксазоліл, ізоксазоліл, тіазоліл, ізотіазоліл, піразоліл, 1,2,3триазоліл, 1,2,4-триазоліл, 1,2,3-оксадіазоліл, 1,2,4-оксадіазоліл, 1,2,5-оксадіазоліл, 1,3,4оксадіазоліл, 1,3,4-триазиніл, 1,2,3-триазиніл, бензофурил, [2,3-дігідро]бензофурил, ізобензофурил, бензотієніл, бензотриазоліл, ізобензотієніл, індоліл, ізоіндоліл, 3Н-індоліл, бензимідазоліл, імідазо[1,2-а]піридил, бензотіазоліл, бензоксазоліл, хінолізиніл, хіназолініл, фталазиніл, хіноксалініл, цинолініл, нафтиридиніл, піридо[3,4-b]піридил, піридо[3,2-b]піридил, піридо[4,3-b]піридил, хіноліл, ізохіноліл, тетразоліл, 5,6,7,8-тетрагідрохіноліл, 5,6,7,8-тетрагідроізохіноліл, пуриніл, фтеридиніл, карбазоліл, ксантеніл та бензохіноліл. Термін "С3-С8-циклоалкіл" означає насичену карбоциклічну групу, яка містить від 3 атомів до 8 атомів вуглецю і включає один цикл (наприклад, циклогексил) або кілька конденсованих циклів (наприклад, норборніл). До циклоалкілів, яким віддається перевага, належать циклопентан, циклогексил, норборніл тощо. Термін "С1-С6-алкілциклоалкіл" означає С1-С6алкіл, що має циклоалкільний замісник, в тому числі циклогексилметил, циклопентилпропіл тощо. Термін "гетероциклоалкіл" означає С3-С8циклоалкіл за поданим вище визначенням, у якому до 3 атомів вуглецю замінено гетероатомами, вибраними з групи, яку складають О, S, NR, де R водень або метил. До гетероциклоалкілів, яким віддається перевага, належать піролідин, піперидин, піперазин, 1-метилпіперазин, морфолін тощо. 86226 14 Термін "С1-С6-алкілгетероциклоалкіл" означає С1-С6-алкіл, що має гетероциклоалкільний замісник, в тому числі 2-(1-піролідиніл)етил, 4морфолінілметил, (1-метил-4-піперидиніл)метил тощо. Термін "С2-С6-алкеніл" означає алкеніл, який відповідно до варіанта, якому віддається перевага, містить від 2 атомів до 6 атомів вуглецю і має один або кілька алкенільних ненасичених зв'язків. До алкенілів, яким віддається перевага, належать етеніл (-СН=СН2), н-2-пропеніл (аліл, -СН2СН=СН2) тощо. Термін "С2-С6-алкініл" означає алкініл, який відповідно до варіанта, якому віддається перевага, містить від 2 атомів до 6 атомів вуглецю і має один або кілька алкінільних ненасичених зв'язків. До алкінілів, яким віддається перевага, належать етиніл (-СºСН), пропініл (-СН2СºСН) тощо. Термін "ацил" означає групу -C(O)R, де R охоплює С1-С6-алкіл, арил, гетероарил, С3-С8циклоалкіл, гетероциклоалкіл, С1-С6-алкіларил та С1-С6-алкілгетероарил. Термін "С1-С6-алкіламінокарбоніл" означає групу -C(O)NRR', де кожний з R, R' незалежно від іншого охоплює водень та С1-С6-алкіл. Термін "С1-С6-алкілациламіно(група)" означає групу -NR(CO)R', де кожний з R, R' незалежно від іншого є водень або С1-С6-алкіл. Термін "галоген" означає атом фтору, хлору, брому або йоду. Термін "сульфоніл" означає групу -SO2-R, де R вибраний з групи, до якої входять Н, С1-С6-алкіл, С1-С6-алкіл, факультативно заміщений галогенами, наприклад, група -SO2-CF3, арил, гетероарил, С1-С6-алкіларил та С1-С6-алкілгетероарил. Термін "сульфокси(л)" означає групу -S(O)-R, де R вибраний з групи, до якої входять Н, С1-С6алкіл, С1-С6-алкіл, факультативно заміщений галогенами, наприклад, група -SO-CF3, арил, гетероарил, С1-С6-алкіларил та С1-С6-алкілгетероарил. Термін "сульфініл" означає групу -SO-R'R", де R вибраний з групи, до якої входять Н, С1-С6-алкіл, С1-С6-алкіл, факультативно заміщений галогенами, наприклад, група -SO-CF3, арил, гетероарил, С1-С6-алкіларил та С1-С6-алкілгетероарил. Термін "аміно(група)" означає групу -NRR', де кожний з R, R' незалежно від іншого є водень, С1С6-алкіл, С2-С6-алкеніл, С2-С6-алкініл, С3-С8циклоалкіл, гетероциклоалкіл, арил, гетероарил, С1-С6-алкіларил або C1-C6-алкілгетероарил, С2-С6алкеніларил, С2-С6-алкенілгетероарил, С2-С6алкініларил, С2-С6-алкініл-гетероарил, С1-С6алкілциклоалкіл, С1-С6-алкіл-гетероциклоалкіл, і де R та R' спільно з атомом азоту, до якого вони приєднані, можуть факультативно утворювати 3-8членний гетероциклоалкіл. Термін "уреїдо(група)" означає групу NRC(O)NR'R", де кожний з R, R', R" незалежно від інших є водень, С1-С6-алкіл, С2-С6-алкеніл, С2-С6алкініл, С3-С8-циклоалкіл, гетероциклоалкіл, арил, гетероарил, С1-С6-алкіларил або С1-С6алкілгетероарил, С2-С6-алкеніларил, С2-С6алкенілгетероарил, С2-С6-алкініларил, С2-С6алкінілгетероарил, С1-С6-алкілциклоалкіл, С1-С6алкіл-гетероциклоалкіл, і де R' та R" спільно з ато 15 86226 16 мом азоту, до якого вони приєднані, можуть факуСтадія 2: Ацильну похідну сполуку (IV) потім льтативно утворювати 3-8-членний гетероциклоаокиснюють придатним окиснювальним агентом, лкіл. одержуючи сполуку формули (V). Придатним окиТермін "заміщений або незаміщений": в разі снювачем є комплекс піридину з триоксидом сірки відсутності інших обмежень, визначених вказівка(Ру-SО3) при застосуванні ДМСО як розчинник. ми на індивідуальний замісник, вищезазначені Відповідно до варіантів, яким віддається перевага, групи, наприклад, алкіл, арил та гетероарил тощо, цю реакцію проводять у присутності триетиламіну. можуть бути факультативно заміщені замісниками Додатковими прикладами придатних окиснюв кількості від 1 до 5, вибраними з групи, яку склавачів є, наприклад, оксалілхлорид/ДМСО, трифтодають С1-С6-алкіл, аміногрупа, арил, гетероарил, роцтовий ангідрид/ДМСО, дициклогексилсульфініл, сульфоніл, алкоксигрупа, сульфаніл, карбодіімід/ДМСО, дихромат піридинію, хлорхрогалоген, карбокси(л), ціаногрупа, гідрокси(л), мермат піридинію, окиснювач Джона (Jone's) або реакаптогрупа, нітрогрупа тощо. ктив Десса-Мартіна (Dess-Martin) 1,1,1Спосіб за цим винаходом включає описані нитрис(ацетилокси)-1-l5,2-бензйодоксол-3(1Н)-он. жче 4 стадії. Згідно з цим винаходом, сполуки формули (І) одержують, використовуючи як вихідний матеріал незахищену 4-гідроксипіролідинкарбонову кислоту формули (II). Сполука (II) є наявною на ринку або може бути одержана відомими способами. Стадія 1: На першій стадії (дивись Схему 4) піролідин формули (II) перетворюють в ацильну похідну сполуку формули (IV), застосовуючи придатний ацилювальний агент (III), наприклад, Стадія 3: Потім сполуку формули (V) перетвоацилхлорид, ангідрид, карбонову кислоту або рюють у сполуку (VII), застосовуючи придатний складний ефір. Серед ацилювальних агентів пеалкоксиламін, арилоксиламін або гідроксиламін ревага віддається 1,1¢-біфеніл-4-карбонілхлориду загальної формули (VI), наприклад, Оабо 2'-метил-1,1¢-біфеніл-4-карбонілхлориду. Одеметилгідроксиламін-гідрохлорид (ця сполука є наржання такої сполуки описано, наприклад, у WO явною на ринку) у присутності органічної основи, 01/72705. наприклад, триетиламіну або Ν,Νдіізопропілетиламіну. Відповідно до варіанта, якому віддається перевага, цю реакцію проводять у присутності основи, наприклад, гідроксиду натрію або гідроксиду калію (умови Шоттен-Баумана - SchottenBaumann) або із застосуванням органічної основи, в тому числі триетиламіну, Ν,Νдіізопропілетиламіну або піридину. Стадія 4: Сполуку (VII) потім перетворюють у сполуку (Іа) або (Іb), застосовуючи або амін загальної формули (VIII) або N-гідроксіамідоксим загальної формули (IX). Одержання Nгідроксіамідоксимів загальної формули (IX) описано, наприклад, у WO 02/102799. 17 В разі необхідності одержання кінцевого продукту (Іс), Стадію 4 слід скоригувати, як вказано нижче. Спочатку слід одержати Nгідроксіамідоксим (Vllb) шляхом перетворення сполуки (VII) у нітрил (Vlla) (наприклад, шляхом прямого одержання кислоти (відомим у літературі способом) або через амід), який вводять у подальшу реакцію з карбоновою кислотою формули R7COOH або, наприклад, із відповідним ацилхлоридом, і після нагрівання проміжного продукту, наприклад, із надлишком піридину, одержують сполуку (Іс). Відповідно до варіанта, якому віддається перевага, для реакції амідоксиму (Vllb) із карбоновою кислотою застосовують агенти сполучення, наприклад, гідрохлорид N-(3-диметиламінопропіл)N'-етилкарбодііміду, карбоніл-діімідазол, дициклогексилкарбодіімід, півалоїлхлорид, ізобутилхлорформіат або будь-який інший звичайний відомий реагент для утворення пептидного зв'язку. В разі необхідності одержання кінцевого продукту (Id), де R6 - водень, для перетворення карбоксильної групи у гідроксіалкіл можна застосувати різноманітні відомі агенти для естерифікації та відновлення. Прикладами реагентів для естерифікації є диметилсульфат, метилйодид, метилтозилат, похідні діазометану, наприклад, триметилсиліл-діазометан, причому всі ці агенти естерифікації працюють у слабоосновних або нейтральних середовищах. Прикладами відновлювальних агентів є боргідрид літію, алюмогідрид літію, натрій-біс(2метоксіетокси)алюмогідрид (Red-Al), гідрид діізобутилалюмінію (DIBAL) тощо. 86226 18 Кінцеві продукти формул (la), (Ib), (Іс) та (Id) можна піддавати подальшим перетворенням, зокрема, стосовно до замісників R1, R2, R7 та R8. Так, кінцевий продукт (Іс), де R7 містить функціональну групу, цей замісник можна перетворити в інший замісник, застосовуючи придатні засоби, в тому числі гідроліз, естерифікацію, омилення, алкілування тощо. Крім того, сполуки за цим винаходом можна піддати подальшим стадіям очищення, в тому числі хроматографії та перекристалізації. Новий спосіб синтезу для одержання сполук формули (І) передбачає застосування не порівняно дорогого захищеного Вос піролідину, а дешевого та легкодоступного 3-гідроксипроліну. Додаткова перевага згаданого нового способу синтезу стосується одержання сполук, які містять полярні замісники, приєднані в положенні 2 до карбоксаміду або оксадіазолу (наприклад, R3, R4, R7, які є фрагментами (наприклад, алкілами або арилами), що містять, наприклад, гідроксильний або амінний замісник, в тому числі циклічний амін). Цей новий спосіб дозволяє виключити кінцеву стадію заміщення при N (як показано на Схемі 2), що має на увазі застосування нуклеофільного реагенту (наприклад, ацилхлориду), який здатний реагувати як з аміногрупою піролідину, так і зі згаданим другим полярним замісником, наприклад, з гідроксильним або амінним замісником. Відповідно до одного варіанта здійснення, новий спосіб синтезу можна застосувати для промислового виробництва сполук формули (І). Цей винахід ілюстровано поданими нижче прикладами. 19 86226 20 тилсульфоксид (4,9об.од.), перемішували протяПриклад 1: Одержання (2S,4E та 4Z)-N-[(2S)-2гом 5-10хв і додавали до реакційної суміші, забезгідрокси-2-фенілетил]-4-(метоксііміно)-1-[(2'-метил печуючи підтримання температури в межах від [1,1¢-біфеніл]-4-іл)карбоніл]-215°С до 25°С. Реакційну суміш перемішували при піролідинкарбоксаміду 15-25°С до завершення реакції за даними РХВЕ Стадія 1: Одержання (4R)-4-гідрокси-1-[(2'аналізу (як правило, 1-3год). Охолоджували вміст метил-1,1¢-біфеніл-4-іл)-карбоніл]-L-проліну (споапарата до 0-10°С і гасили водним розчином хлолука (IV) за Схемою 4) ристоводневої кислоти (3М, 8об.од.), підтримуючи 4-гідрокси-L-пролін (0,625 масових одиниць, температуру нижче 30°С. Потім додавали тетрагідалі "мас.од.") та воду (3,3 об'ємних одиниць, далі дрофуран (5,0об.од.) та гептан (1,0об.од.), розді"об.од.") завантажували у скляний апарат із фланляли шари, екстрагували водну фазу тетрагідроцем місткістю 20л. Додавали до суміші краплями фураном (2x5,0об.од.), об'єднані органічні фази триетиламін (2,42 об.од.) з такою швидкістю, щоб промивали водним розчином хлористоводневої температура підтримувалася в межах від 10°С до кислоти (1М, 2x2,0об.од.) та насиченим сольовим 20°С. Додавали тетрагідрофуран (5,0 об.од.), і розчином (2x2,0об.од.). Водні промивні розчини реакційну суміш охолоджували до 0-5°С. В окреоб'єднували і піддавали зворотній екстракції тетмий скляний апарат завантажували хлорангідрид рагідрофураном (2x1,0об.од.), органічні фази об'є2'-метил-1,1¢-біфеніл-4-карбонової кислоти (1,0 днували, сушили над сульфатом магнію (3мас.од.) мас.од.) та тетрагідрофуран (5,0 об.од.), переміі фільтрували. Осад на фільтрі промивали тетрагішували протягом 5-10хв і додавали до реакційної дрофураном (1,0об.од.), і фільтрати концентрувасуміші, забезпечуючи підтримання температури в ли у вакуумі при 40-45°С, одержуючи світломежах від 0°С до 10°С. Підігрівали реакційну суміш коричневу піну. До цього залишку додавали етидо 15-25°С протягом 60-120хв і підтримували її лацетат (10,0об.од.), суміш перемішували протятемпературу в межах від 15°С до 25°С до завергом 5-10хв, і розчинник видаляли у вакуумі при 40шення реакції за даними ТШХ аналізу. Одержану 45°С. Залишок переносили у скляний апарат, досуміш концентрували у вакуумі при 35-40°С, додадавали етилацетат (8,0об.од.), і суміш нагрівали зі вали до залишку воду (10,0 об.од.) та етилацетат зворотним холодильником до кипіння. Додавали (5,0 об.од.), і перемішували суміш протягом 5до суміші суспензію активного вугілля 10хв. Розділяли шари, водну фазу підкислювали (0,14мас.од.) в етилацетаті (5,0об.од.), відновлюдо рН 1 водним розчином хлористоводневої кисвали умови кипіння зі зворотним холодильником і лоти (6 М, приблизно 3,0 об.од.), одержану сувитримували суміш у цих умовах протягом 20спензію охолоджували до 0-10°С і витримували 30хв. Охолоджували суміш до 40-45°С, фільтрувапри цій температурі для визрівання протягом 25ли, промивали осад на фільтрі етилацетатом 40хв. Відділяли осад фільтруванням, переносили (2,5об.од.), і фільтрати концентрували до об'єму тверду речовину у придатний скляний апарат із 2,5-3,0об.од. у вакуумі при 0-45°С. Одержану суфланцем і суспендували у нагрітій (35-60°С) воді спензію розводили етилацетатом (0,5об.од.) і на(5,0 об.од.) протягом 10-25хв. Відділяли тверду грівали зі зворотним холодильником. Додавали фазу фільтруванням і ще раз повторювали операгептан (3,0об.од.), і суміші давали охолоджуватися цію суспендування у гарячій воді, як описано видо 15-25°С протягом 1-2год. Одержану суспензію ще. Після другої операції суспендування твердий додатково охолоджували до 0-5°С протягом 2продукт сушили азеотропним способом із толуо3год, фільтрували і осад на фільтрі промивали лом (2x5,0 об.од.) при 40-50°С. Додавали до запопередньо охолодженою (0-5°С) сумішшю етилалишку етилацетат (2,5 об.од.) та гептан (2,5 цетату з гептаном (1:1, 1,0об.од.), а потім гептаном об.од.), одержану суспензію охолоджували до 0(5,0об.од.). Виділену тверду речовину сушили у 5°С і витримували при цій температурі для визрівакуумі при 40-45°С, і одержували 1-[(2'-метилвання протягом 30-40хв, фільтрували, відділену 1,1¢-біфеніл-4-іл)карбоніл]-4-оксо-L-пролін у виглятверду речовину промивали попередньо охолоді злегка забарвленої твердої речовини. Вихід: дженою (0-5°С) сумішшю етилацетату з гептаном 60,3%. (1:1, 2,0 об.од.) і сушили у вакуумі при 30-40°С до Стадія 3: Одержання 4-метоксііміно-1-[(2'незмінної маси, одержуючи (4R)-4-гідрокси-1-[(2'метил-1,1¢-біфеніл-4-іл)-карбоніл]-L-проліну (спометил-1,1¢-біфеніл-4-іл)карбоніл]-L-пролін у виглялука (VII) за Схемою 6) ді білої твердої речовини. Вихід: 85,9%. 1-[(2'-метил-1,1¢-біфеніл-4-іл)карбоніл]-4-оксоСтадія 2: Одержання 1-[(2'-метил-1,1¢-біфеніл1-пролін (продукт зі Стадії 2, 1,0 мас.од.), гідрох4-іл)карбоніл]-4-оксо-L-проліну (сполука (V) за лорид О-метил-гідроксиламіну (0,285мас.од.) та Схемою 5) дихлорметан (20об. од.) завантажували у скляний (4R)-4-гідрокси-1-[(2'-метил-1,1'-біфеніл-4апарат із фланцем місткістю 20л і охолоджували іл)карбоніл]-L-пролін (продукт зі Стадії 1, до 0-5°С. Додавали в апарат триетиламін 1,0мас.од.) та диметилсульфоксид (2,5 об.од.) (0,91об.од.) із такою швидкістю, щоб температура завантажували у скляний апарат із фланцем містзалишалася в межах від 0°С до 10°С, підігрівали кістю 20л. Суміш нагрівали до 35-40°С і витримуреакційну суміш до 15-25°С і витримували при вали при цій температурі до досягнення повного температурі в цьому діапазоні протягом 16-20год. розчинення. Одержаний розчин охолоджували до Концентрували реакційну суміш у вакуумі при 405-10°С в атмосфері азоту і додавали до нього три45°С, залишок розчиняли в етилацетаті етиламін (3,0 об.од.) з такою швидкістю, щоб тем(10,0об.од.) і промивали водним розчином хлориспература залишалася в межах від 5°С до 20°С. В товодневої кислоти (1М, 2x5,0об.од.). Водні проокремий скляний апарат завантажували комплекс мивні розчини об'єднували і піддавали зворотній піридину з триоксидом сірки (1,47мас.од.) та диме 21 86226 22 екстракції етилацетатом (5,0об.од.), органічні екслася в межах від 10°С до 15°С, і охолоджували тракти об'єднували і промивали насиченим розсоодержану суміш до 0-5°С. В окремий скляний апалом (10,0об.од.), сушили над сульфатом магнію рат завантажували 1,1¢-біфеніл-4-карбонілхлорид (0,5мас.од.), фільтрували, і осад на фільтрі про(1,00кг, 3,78моль, 1,0мас.од.) та тетрагідрофуран мивали етилацетатом (5,0об.од.). Фільтрати кон(5,00л, 5,0об.од.), перемішували одержану суспенцентрували у вакуумі при 40-45°С, і одержували 4зію протягом 5-10хв і додавали її до реакційної метоксііміно-1-[(2'-метил-1,1¢-біфеніл-4суміші протягом 40-50хв, забезпечуючи підтриіл)карбоніл]-L-пролін у вигляді очікуваної суміші мання температури в межах від 0°С до 10°С. ПідігE:Z ізомерів. Вихід: 95,6%. рівали реакційну суміш до 15-25°С протягом 60Стадія 4: Одержання N-[2-гідрокси-2120хв, і підтримували її температуру в межах від 15°С до 25°С до завершення реакції за даними фенілетил]4-(метоксііміно)-1-[(2'-метил[1,1¢ТШХ аналізу (дихлорметан:метанол:оцтова кислобіфеніл]-4-іл)карбоніл]-2-піролідин-карбоксаміду та, 90:10:1; візуалізація в УФ світлі; Rf продукту (сполука (Іа) за Схемою 7) 0,13). Реакційну суміш концентрували під зниже4-метоксііміно-1-[(2' -метил-1,1'-біфеніл]-4ним тиском при 35-40°С, додавали до залишку іл)карбоніл]-L-пролін (продукт зі Стадії 3, воду (8,00л, 8,0об.од.) та етилацетат (5,00л, 1,0мас.од.) та дихлорметан (10,0об.од.) заванта5,0об.од.) і перемішували суміш протягом 5-10хв. жували у скляний апарат із фланцем місткістю 20л Розділяли шари, водну фазу підкислювали до рН 1 і охолоджували до 0-5°С в атмосфері азоту. Додашляхом швидкого додавання водного розчину вали N-метилморфолін (0,78об.од.) при 0-5°С, а хлористоводневої кислоти (6М, приблизно 900мл, потім півалоїл-хлорид (0,37об.од.) при 0-5°С. Вміст 0,9об.од.), і одержану суспензію охолоджували до апарата перемішували при 0-5°С до завершення 0-10°С протягом 40-50хв. Відділяли осад фільтруутворення змішаного ангідриду (як правило, 30ванням, суспендували виділену тверду речовину у 60хв). В окремий скляний апарат із фланцем місттеплій воді (35-60°С, 5,00л, 5,0об.од.) протягом 10кістю 20л завантажували (S)-2-аміно-125хв і відділяли тверду фазу фільтруванням. Ще фенілетанол (0,47мас.од., 1,2екв.) та дихлорметан раз повторювали операцію суспендування у гаря(3,0об.од.), і одержану суміш перемішували протячій воді, як описано вище. Одержану тверду речогом 5-25хв. Потім цей розчин охолоджували до 10вину об'єднували з відповідним продуктом, одер15°С і завантажували в апарат зі змішаним ангіджаним із другої операції синтезу, проведеної з ридом так, щоб температура залишалася в межах тими самими кількостями реагентів, завантажувавід 5°С до 15°С. Підігрівали реакційну суміш до 15ли у скляний апарат із фланцем місткістю 20л, 25°С і витримували при температурі в цьому діадодавали ацетон (10,00л, 5,0об.од.), нагрівали пазоні до завершення реакції за даними РХВЕ реакційну суміш зі зворотним холодильником до аналізу. Одержану суміш концентрували у вакуумі кипіння і витримували при кипінні (приблизно при при 35-45°С, залишок розподіляли між mpem65°С) протягом 10-20хв. Давали суміші охолодитибутилметиловим простим ефіром (ТВМЕ, ся до 15-25°С, перемішували при 15-25°С протя10,0об.од.) та водним розчином лимонної кислоти гом 12-18год, охолоджували до 0-5°С і витримува(0,1М, 5,0об.од.), розділяли шари, і органічну фазу ли при цій температурі для визрівання протягом додатково промивали водним розчином лимонної 60хв. Відділяли осад фільтруванням і промивали кислоти (0,1М, 2x5,0об.од.), насиченим водним сумішшю етилацетату з ацетоном (1:1, 4,00л, розчином бікарбонату натрію (2x5,0об.од.) та на2об.од.). Осад на фільтрі сушили досуха просмоксиченим розсолом (5,0об.од.). Органічну фазу сутуванням повітря і додатково сушили у вакуумі при шили над сульфатом магнію (1мас.од.), фільтру40-45°С до незмінної маси, одержуючи (2S,4R)-1вали, і осад на фільтрі промивали ТВМЕ (біфеніл-4-ілкарбоніл)-4-гідрокси-піролідин-2(2,0об.од.). Фільтрати концентрували у вакуумі при карбонову кислоту у вигляді бежевої твердої речо40-45°С, і одержували коричневу напівтверду ревини. Фільтрати концентрували під зниженим тисчовину. Додавали до цього залишку дихлорметан ком до об'єму приблизно 3,00л і одержували дода(5,0об.од.), і одержану суміш концентрували у ваткову кількість матеріалу, який відділяли куумі при 40-45°С, одержуючи гумоподібну речофільтруванням, промивали сумішшю етилацетату вину. Повторювали цей процес із застосуванням з гептаном (1:1, 2x4,00л, 2x2об.од.) і сушили на додаткової кількості дихлорметану (1,0об.од.), і фільтрі просмоктуванням повітря. Після висушуодержували неочищений кінцевий продукт у вивання у вакуумі при 40-45°С до незмінної маси гляді очікуваної суміші E:Z ізомерів. Вихід: 84,4%. одержували вказану в заголовку сполуку у вигляді Приклад 2: (3E,5S)-1-([1,1'-біфеніл]-4бежевої твердої речовини. Загальна кількість: ілкарбоніл)-5-[3-(2-гідроксіетил)-1,2,4-оксадіазол-52,616кг, вихід: 91,9%. іл]-3-піролідинон-О-метилоксим; (3Ζ,5S)-1-([1,1¢Стадія 2: Одержання (2S)-1-(біфеніл-4біфеніл]-4-ілкарбоніл)-5-[3-(2-гідроксіетил)-1,2,4ілкарбоніл)-4-оксо-піролідин-2-карбонової кислоти оксадіазол-5-іл]-3-піролідинон-О-метилоксим (сполука (V) за Схемою 5) Стадія 1: Одержання (2S,4R)-1-(біфеніл-4(2S,4R)-1-(біфеніл-4-ілкарбоніл)-4ілкарбоніл)-4-гідрокси-піролідин-2-карбонової кисгідроксипіролідин-2-карбонову кислоту (0,806кг, лоти (сполука (IV) за Схемою 4) 1,0мас.од.) та диметилсульфоксид (5,00л, 4-гідрокси-L-пролін (0,670кг, 5,11моль, 6,25об.од.) завантажували у скляний апарат із 0,67мас.од.), тетрагідрофуран (5,00л, 5,0об.од.) та фланцем місткістю 20л і перемішували в атмосводу (3,30л, 3,3об.од.) завантажували у скляний фері азоту до досягнення повного розчинення. апарат із фланцем місткістю 20л. Додавали до Одержаний розчин охолоджували до 10-15°С і суміші краплями триетиламін (2,570л, 2,57об.од.) додавали до нього триетиламін (2,40л, 3,0об.од.) із такою швидкістю, щоб температура підтримува 23 86226 24 із такою швидкістю, щоб внутрішня температура бежеву тверду речовину. Цей неочищений продукт суміші залишалася в межах від 10°С до 20°С. Досуспендували в етилацетаті (3,10л, 2,0об.од.) при давали до реакційної суміші частинами комплекс 15-20°С, протягом 15хв додавали циклогексан піридину з триоксидом сірки (1,224кг, 1,53мас.од.) (12,40л, 8,0об.од.), і одержану суспензію охолотак, щоб внутрішня температура суміші залишаладжували до 0-5°С і витримували при цій темперася в межах від 10°С до 25°С. Перемішували суміш турі протягом 1год для визрівання. Осад відділяли при 15-25°С до завершення реакції за даними фільтруванням, промивали сумішшю етилацетату ТШХ аналізу (дихлорметан:метанол:оцтова кислоз циклогексаном (1:2; 4,650л, 3,0об.од.) і сушили у та 90:10:1; Rf продукту 0,28), як правило, протягом вакуумі при 40-45°С до незмінної маси, одержуючи 1-3год. Охолоджували реакційну суміш до 0-10°С і вказаний у заголовку продукт у вигляді бежевої гасили водним розчином хлористоводневої кислотвердої речовини (1,132кг, вихід: 66,8%). ти (3М, 6,460л, 8,0об.од.), підтримуючи темпераФільтрати після виділення (з 9 операцій протуру нижче 30°С. Додавали тетрагідрофуран ведення вищевказаної реакції) об'єднували і кон(2,00л, 2,5об.од.) та етилацетат (2,00л, 2,5об.од.), центрували під зниженим тиском при 40-45°С. Зарозділяли шари, екстрагували водну фазу сумішлишок (приблизно 1,00кг) суспендували в шю тетрагідрофурану з етилацетатом (1:1, 4,00л, гарячому (70-75°С) етилацетаті (7,00л), охолоджу5,0об.од.). Об'єднані органічні фази промивали вали до 0-5°С і витримували при цій температурі водним розчином хлористоводневої кислоти (1М, протягом 2год для визрівання, фільтрували, і від2x1,60л, 2x2,0об.од.) та насиченим розсолом ділену тверду речовину сушили у вакуумі при 40(1,60л, 2,0об.од.). До органічної фази додавали 45°С до незмінної маси, одержуючи додаткову активне вугілля (160г, 0,2мас.од.), одержану сукількість (2S)-1-(біфеніл-4-ілкарбоніл)-4спензію нагрівали зі зворотним холодильником до (метоксііміно)піролідин-2-карбонової кислоти кипіння і витримували при кипінні (65-70°С) протя(0,732кг, 4,9% теоретичної кількості). гом 0,5год. Охолоджували реакційну суміш до 20Стадія 4а: Одержання (2S)-1-(біфеніл-430°С, додавали сульфат магнію (375г, 0,5мас.од.), карбоніл)-5-[3-(2-триетилсиланіл-оксіетил)-1,2,4перемішували протягом 10хв і фільтрували суміш оксадіазол-5-іл]-піролідин-3-он-О-метилоксиму через целіт. Твердий залишок промивали етила(сполука (Іb) за Схемою 7) цетатом (2x0,800л, 2x1,0об.од.), і об'єднані фільт(2S)-1-(біфеніл-4-ілкарбоніл)-4рати концентрували під зниженим тиском при 40(метоксііміно)піролідин-2-карбонову кислоту 45°С, одержуючи вказану в заголовку сполуку (0,560кг, 1,0мас.од.) та тетрагідрофуран (8,40л, (2S)-1-(біфеніл-4-ілкарбоніл)-4-оксо-піролідин-215,0об.од.) завантажували у скляний апарат із карбонову кислоту у вигляді в'язкого оранжевого фланцем місткістю 20л і охолоджували до 0-5°С. масла (0,769кг, вихід: 96,0%). Цей матеріал викоДодавали частинами карбонілдіімідазол (0,280кг, ристовували на наступній стадії без додаткового 0,5мас.од.) так, щоб внутрішня температура суміші очищення. залишалася в межах від 0°С до 10°С. Реакційну Стадія 3: Одержання (2S)-1-(біфеніл-4суміш підігрівали до 15-20°С і перемішували до ілкарбоніл)-4-(метоксііміно)-піролідин-2-карбонової завершення реакції (1-2год) за даними ТШХ аналікислоти (сполука (VII) за Схемою 6) зу (етилацетат, візуалізація в УФ світлі). Потім Неочищений (2S)-1-(біфеніл-4-ілкарбоніл)-4додавали однією порцією N-гідрокси-3охопіролідин-2-карбонова кислота (1,550кг, триетилсиланіл-оксипропіонамідин (0,381кг, 5,01моль, 1,0мас.од.), гідрохлорид О0,68мас.од., 1,0екв., скореговано на вміст силанометилгідроксиламіну (0,620кг, 7,42моль, лу) у вигляді розчину в тетрагідрофурані (2,80л, 0,40мас.од.) та дихлорметан (12,40л, 8,0об.од.) 5,0об.од.), і продовжували перемішування при 15завантажували у скляний апарат із фланцем міст25°С при контролі протікання реакції методом ТШХ кістю 20л і охолоджували до 0-5°С. Додавали до (етилацетат, візуалізація в УФ світлі). Завершення реакційної суміші триетиламін (1,752л, 1,13об.од.) реакції було виявлено через 1год. Реакційну суміш на протязі 45-60хв так, щоб внутрішня температуконцентрували під зниженим тиском при 40-45°С, і ра залишалася в межах від 0°С до 10°С. Підігрівазалишок об'єднували з відповідними продуктами з ли реакційну суміш до 15-25°С і витримували при двох операцій синтезу, проведених із тими самими температурі в цьому діапазоні до завершення реакількостями реагентів. До об'єднаного матеріалу кції (як правило, 12-18год) за даними ТШХ аналізу додавали піридин (5,040л, 3об.од.), одержану су(дихлорметан:метанол:оцтова кислота 90:10:1, міш нагрівали до 85-90°С і витримували при цій візуалізація в УФ світлі; Rf продукту 0,27 та 0,35 температурі до завершення циклізації за даними відповідно для Z- та E-ізомерів). Реакційну суміш аналізу РХВЕ. Реакційну суміш концентрували під концентрували під зниженим тиском при 40-45°С, зниженим тиском при 40-45°С, темний маслянисзалишок розчиняли в етилацетаті (12,40л, тий залишок обробляли етилацетатом (16,80л, 8,0об.од.) і промивали водним розчином хлорис10об.од.) і промивали 25% водним розчином литоводневої кислоти (2М, 2x4,650л, 2x3,0об.од.). монної кислоти (3x5,00л, 3x3,0об.од.). Водні екстВодні промивні розчини об'єднували і піддавали ракти об'єднували і піддавали зворотній екстракції зворотній екстракції етилацетатом (4,650л, етилацетатом (5,00л, 3об.од.), об'єднані органічні 3,0об.од.). Органічні екстракти об'єднували і профази промивали розсолом (5,00л, 3,0об.од.), сумивали насиченим розсолом (4,650л, 3,0об.од.), шили над сульфатом магнію (1,680кг, 1мас.од.), сушили над сульфатом магнію (770г, 0,5мас.од.), фільтрували, і осад на фільтрі промивали етилафільтрували, і осад на фільтрі промивали етилацетатом (1,70л). Об'єднані фільтрати концентруцетатом (4,650л, 3,0об.од.). Фільтрати концентрували під зниженим тиском при 40-45°С, і одержували під зниженим тиском при 40-45°С, одержуючи вали неочищений (2S)-1-(біфеніл-4-карбоніл)-5-[3 25 86226 26 вали до реакційної суміші, забезпечуючи підтри(2-триетилсиланілоксіетил)-1,2,4-оксадіазол-5мання температури в межах від 0°С до 10°С. Підігіл]піролідин-3-он-О-метилоксим у вигляді коричнерівали реакційну суміш до 15-25°С протягом 60вого масла, яке використовували без додаткового 120хв і підтримували її температуру в межах від очищення (2,796кг, 108%). 15°С до 25°С до завершення реакції за даними Стадія 4b: Одержання (2S)-1-(біфеніл-4ТШХ аналізу. Одержану суміш концентрували у карбоніл)-5-[3-(2-гідроксіетил)-1,2,4-оксадіазол-5вакуумі при 35-40°С, додавали до залишку воду іл]піролідин-3-он-О-метилоксиму (10,0об.од.) та етилацетат (5,0об.од.), і перемішуНеочищений (2S)-1-(біфеніл-4-карбоніл)-5-[3вали суміш протягом 5-10хв. Розділяли шари, вод(2-триетилсиланіл-оксіетил)-1,2,4-оксадіазол-5-іл]ну фазу підкислювали до рН 1 водним розчином піролідин-3-он-О-метилоксим (1,398кг, 1,0мас.од.) хлористоводневої кислоти (6М, приблизно у вигляді розчину в тетрагідрофурані (6,990л, 3,0об.од.), одержану суспензію охолоджували до 5,0об.од.) обробляли 1% водним розчином три0-10°С і витримували при цій температурі для визфтороцтової кислоти (3,495л, 2,5об.од.). Аналіз рівання протягом 25-40хв. Відділяли осад фільтТШХ (етилацетат; візуалізація в УФ світлі; Rf проруванням, переносили тверду речовину у придатдукту 0,35 та 0,48 відповідно для Z- та E-ізомеру) ний скляний апарат із фланцем і суспендували у посвідчив завершення реакції через 30 хв. Довонагрітій (35-60°С) воді (5,0об.од.) протягом 10дили реакційну суміш до рН 7 насиченим водним 25хв. Відділяли тверду фазу фільтруванням і ще розчином бікарбонату натрію (1,00, 0,72об.од.) і раз повторювали операцію суспендування у гарядодавали етилацетат (6,990л, 5об.од.). Розділяли чій воді, як описано вище. Після другої операції шари, органічну фазу промивали насиченим водсуспендування твердий продукт сушили азеотропним розчином бікарбонату натрію (2,796л, ним способом із толуолом (2x5,0об.од.) при 402,0об.од.), водні промивні розчини об'єднували і 50°С. Додавали до залишку етилацетат (2,5об.од.) піддавали зворотній екстракції етилацетатом та гептан (2,5об.од.), одержану суспензію охоло(2,796л, 2,0об.од.). Органічні екстракти об'єднуваджували до 0-5°С і витримували при цій темперали, промивали розсолом (4,794л, 3об.од.), сушили турі для визрівання протягом 30-40хв, фільтруванад сульфатом магнію (1,164кг, 0,75мас.од.), фільли, відділену тверду речовину промивали трували, і осад на фільтрі промивали етилацетапопередньо охолодженою (0-5°С) сумішшю етилатом (2x0,699L, 2x0,5об.од.). Об'єднані фільтрати цетату з гептаном (1:1, 2,0об.од.) і сушили у вакуконцентрували під зниженим тиском при 40-45°С, і умі при 30-40°С до незмінної маси, одержуючи одержували маслянистий залишок, який об'єднували з відповідним залишком, одержаним із другої (4R)-4-гідрокси-1-[(2'-метил-1,1¢-біфеніл-4операції синтезу з тими самими кількостями реаіл)карбоніл]-L-пролін у вигляді білої твердої речогентів. Загальна кількість неочищеного продукту: вини. Вихід: 85,9%. 2,592кг. Неочищений матеріал розчиняли в ацетоСтадія 2: Одержання 1-[(2'-метил-1,1¢-біфенілнітрилі (2,592л, 1об.од.), додавали гептан (26,00л, 4-іл)карбоніл]-4-оксо-L-проліну (сполука (V) за 10об.од.), одержаний розчин нагрівали до 45-55°С Схемою 5) і витримували при цій температурі протягом 30хв. (4R)-4-гідрокси-1-[(2'-метил-1,1'-біфеніл-4Нижній ацетонітрильний шар відділяли, додавали іл)карбоніл]-1-пролін (продукт зі Стадії 1, при інтенсивному перемішуванні до трет1,0мас.од.) та диметилсульфоксид (2,5об.од.) забутилметилового простого ефіру (56,00л, вантажували у скляний апарат із фланцем місткіс22об.од.), охолоджували суміш до 0-5°С і витритю 20л. Суміш нагрівали до 35-40°С і витримували мували для визрівання при цій температурі 1-2год, при цій температурі до досягнення повного розчифільтрували і концентрували під зниженим тиском нення. Одержаний розчин охолоджували до 5при 40-45°С, одержуючи вказану в заголовку спо10°С в атмосфері азоту і додавали до нього триелуку у вигляді блідо-жовтої твердої речовини тиламін (3,0об.од.) з такою швидкістю, щоб темпе(2,037кг, 93,3%). ратура залишалася в межах від 5°С до 20°С. В Приклад 2а: (3E,5S)-5-[3-(2-гідрокгіетил)-1,2,4окремий скляний апарат завантажували комплекс оксадіазол-5-іл]-1-[(2'-метилбіфеніл-4піридину з триоксидом сірки (1,47мас.од.) та димеіл)карбоніл]піролідин-3-он-О-метилоксим; (3Z,5S)тилсульфоксид (4,9об.од.), перемішували протя5-[3-(2-гідроксіетил)1,2,4-оксадіазол-5-іл]-1-[(2'гом 5-10хв і додавали до реакційної суміші, забезметилбіфеніл-4-іл)карбоніл]піролідин-3-он-Oпечуючи підтримання температури в межах від метилоксим 15°С до 25°С. Реакційну суміш перемішували при Стадія 1: Одержання (4R)-4-гідрокси-1-[(2'15-25°С до завершення реакції за даними РХВЕ метил-1,1¢-біфеніл-4-іл)-карбоніл]-L-проліну (споаналізу (як правило, 1-3год). Охолоджували вміст лука (IV) за Схемою 4) апарата до 0-10°С і гасили водним розчином хло4-гідрокси-Х-пролін (0,625мас.од.) та воду ристоводневої кислоти (3М, 8об.од.), підтримуючи (3,3об.од.) завантажували у скляний апарат із температуру нижче 30°С. Потім додавали тетрагіфланцем місткістю 20л. Додавали до суміші крапдрофуран (5,0об.од.) та гептан (1,0об.од.), розділями триетиламін (2,42об.од.) з такою швидкістю, ляли шари, екстрагували водну фазу тетрагідрощоб температура підтримувалася в межах від фураном (2x5,0 об.од.), об'єднані органічні фази 10°С до 20°С. Додавали тетрагідрофуран промивали водним розчином хлористоводневої (5,0об.од.), і реакційну суміш охолоджували до 0кислоти (1М, 2x2,0об.од.) та насиченим сольовим 5°С. В окремий скляний апарат завантажували розчином (2x2,0об.од.). Водні промивні розчини хлорангідрид 2'-метил-1,1¢-біфеніл-4-карбонової об'єднували, і піддавали зворотній екстракції теткислоти (1,0мас.од.) та тетрагідрофуран рагідрофураном (2x1,0об.од.), органічні фази об'є(5,0об.од.), перемішували протягом 5-10хв і додаднували, сушили над сульфатом магнію (3мас.од.) 27 86226 28 і фільтрували. Осад на фільтрі промивали тетрагівали частинами карбонілдіімідазол (38,65г, дрофураном (1,0об.од.), і фільтрати концентрува238,37ммоль, 1,05екв.) так, щоб внутрішня темпели у вакуумі при 40-45°С, одержуючи світлоратура суміші залишалася в межах від 0°С до 5°С. коричневу піну. До цього залишку додавали етиРеакційну суміш підігрівали і перемішували при 20лацетат (10,0об.од.), суміш перемішували протя25°С (2-3год) за даними аналізу РХВЕ (гасіння гом 5-10хв, і розчинник видаляли у вакуумі при 402,0Μ метанольним розчином аміаку). Потім дода45°С. Залишок переносили у скляний апарат, довали краплями N-гідрокси-3-триетилсиланілдавали етилацетат (8,0об.од.), і суміш нагрівали зі оксипропіонамідин (81,25г, 238,37ммоль, 1,05екв., зворотним холодильником до кипіння. Додавали скореговано на вміст силанолу) у вигляді розчину до суміші суспензію активного вугілля в тетрагідрофурані (330мл) так, щоб внутрішня (0,14мас.од.) в етилацетаті (5,0об.од.), відновлютемпература суміші залишалася в межах від 20°С вали умови кипіння зі зворотним холодильником і до 25°С, і продовжували перемішування при 20витримували суміш у цих умовах протягом 2025°С при контролі протікання реакції методом 30хв. Охолоджували суміш до 40-45°С, фільтруваРХВЕ. Завершення реакції було виявлено через ли, промивали осад на фільтрі етилацетатом 18год. Реакційну суміш концентрували під зниже(2,5об.од.), і фільтрати концентрували до об'єму ним тиском при 40-45°С. До одержаного матеріалу 2,5-3,0об.од. у вакуумі при 0-45°С. Одержану судодавали піридин (500мл), і одержаний розчин спензію розводили етилацетатом (0,5об.од.) і нанагрівали до 85-90°С і витримували при цій темпегрівали зі зворотним холодильником. Додавали ратурі до завершення циклізації за даними аналізу гептан (3,0об.од.), і суміші давали охолоджуватися РХВЕ (2-3год). Реакційну суміш концентрували під до 15-25°С протягом 1-2год. Одержану суспензію зниженим тиском при 40-45°С, темний маслянисдодатково охолоджували до 0-5°С протягом 2тий залишок обробляли етилацетатом (1,00л) і 3год, фільтрували і осад на фільтрі промивали промивали 25% водним розчином лимонної кислопопередньо охолодженою (0-5°С) сумішшю етилати (3x400мл). Водні екстракти об'єднували і піддацетату з гептаном (1:1, 1,0об.од.), а потім гептаном вали зворотній екстракції етилацетатом (250мл), (5,0об.од.). Виділену тверду речовину сушили у об'єднані органічні фази промивали розсолом вакуумі при 40-45°С, і одержували 1-[(2'-метил(1,00л), сушили над сульфатом магнію, фільтрували, і осад на фільтрі промивали етилацетатом. 1,1¢-біфеніл-4-іл)карбоніл]-4-оксо-L-пролін у вигляОб'єднані фільтрати концентрували під зниженим ді злегка забарвленої твердої речовини. Вихід: тиском при 40-45С, і одержували неочищений 60,3%. (3EZ,5S)-1-[1-[(2'-метилбіфеніл-4-іл)карбоніл]-5-(3Стадія 3: Одержання 4-метоксііміно-1-[(2'{2-[триетил-силіл)оксі]етил}-1,2,4-оксадіазол-5метил-1,1¢-біфеніл-4-іл)-карбоніл]-L-проліну (споіл)піролідин-3-он-О-метилоксим у вигляді коричнелука (VII) за Схемою 6) вого масла, яке використовували без додаткового 1-[(2'-метил-1,1¢-біфеніл-4-іл)карбоніл]-4-оксоочищення (126,04г, 104%). L-пролін (продукт зі Стадії 2, 1,0мас.од.), гідрохлоСтадія 4b: Одержання (3Z,5S)-5-[3-(2рид О-метил-гідроксиламіну (0,285мас.од.) та дихгідроксіетил)-1,2,4-оксадіазол-5-іл]-1-[(2'лорметан (20об. од.) завантажували у скляний метилбіфеніл-4-іл)карбоніл]-3-піролідинон-Оапарат із фланцем місткістю 20л і охолоджували метилоксиму до 0-5°С. Додавали в апарат триетиламін Неочищений (3EZ,5S)-1-[1-[(2'-метилбіфеніл-4(0,91об.од.) з такою швидкістю, щоб температура іл)карбоніл]-5-(3-{2-[триетил-силіл)оксі]етил}-1,2,4залишалася в межах від 0°С до 10°С, підігрівали оксадіазол-5-іл)піролідин-3-он-О-метилоксим реакційну суміш до 15-25°С і витримували при (126,04г) об'єднували з матеріалом, одержаним із температурі в цьому діапазоні протягом 16-20год. другої операції синтезу з аналогічними кількостями Концентрували реакційну суміш у вакуумі при 40реагентів (загальна кількість: 257,8г, 482,11ммоль, 45°С, залишок розчиняли в етилацетаті 1,0екв.). Додавали ацетонітрил (1,29л, 5,0об.од.), і (10,0об.од.) і промивали водним розчином хлорисодержаний розчин обробляли 5% водним розчитоводневої кислоти (1М, 2x5,0об.од.). Водні проном трифтороцтової кислоти (1,065л). Аналіз мемивні розчини об'єднували і піддавали зворотній тодом РХ/МС посвідчив завершення реакції після екстракції етилацетатом (5,0об.од.), органічні експеремішування протягом ночі. Додавали до реактракти об'єднували і промивали насиченим розсоційної суміші бікарбонат натрію (48,5г, 1,2екв.) і лом (10,0об.од.), сушили над сульфатом магнію перемішували протягом 5хв. Продукт екстрагували (0,5мас.од.), фільтрували, і осад на фільтрі проетилацетатом (3x500мл), об'єднані екстракти промивали етилацетатом (5,0об.од.). Фільтрати конмивали напівнасиченим розсолом (3x300мл), суцентрували у вакуумі при 40-45°С, і одержували 4шили над сульфатом магнію, фільтрували і концеметоксііміно-1-[(2'-метил-1,1¢-біфеніл-4нтрували під зниженим тиском при 40-45°С, іл)карбоніл]-1-пролін у вигляді очікуваної суміші одержуючи залишок, який містив дві фази - масE:Z ізомерів. лоподібну та тверду. Цей залишок знов розчиняли Стадія 4а: Одержання (3EZ,5S)-1-[1-[(2'у ацетонітрилі (1,00л),промивали гептаном метилбіфеніл-4-іл)карбоніл]-5-(3-{2(3x200мл), відділяли і концентрували під зниженим [триетилсиліл)оксі]етил}-1,2,4-оксадіазол-5тиском при 40-45°С, одержуючи вказану в заголовіл)піролідин-3-он-О-метилоксиму (сполука (Іb) за ку сполуку у вигляді коричневого масла (183,9г, Схемою 7) 90,7% теоретичної кількості). Розчин 4-метоксііміно-1-[(2'-метил-1,1¢Очищення одержаного продукту (суміші E/Z біфеніл-4-іл)карбоніл]-L-проліну (80,0г, ізомерів) виконували на колонці (Novasep, діоксид 227,02ммоль, 1,00екв.) у тетрагідрофурані (1,00л) кремнію, 40-63мкм; EtOAc/циклогексан = 2:3, потім охолоджували до температури в масі 0-5°С. Дода 29 86226 30 чистий етилацетат), а потім додатковим хроматогТверду речовину промивали водою і сушили, одерафуванням (Novasep, діоксид кремнію, 15-25мкм; ржуючи (2S,4Z)-1-([1,1¢-біфеніл]-4-іл-карбоніл)-4EtOAc/циклогексан = 1:1). Ці дві стадії очищення (метоксііміно)-2-піролідинкарбоксамід (102,10г; забезпечили видалення більшої частини побічних 67,34%). У тригорлій колбі місткістю 3л перемішупродуктів з одержанням блідо-жовтого масла. Пісвали (2S,4Z)-1-([1,1¢-біфеніл]-4-іл-карбоніл)-4ля третього хроматографування в умовах, описа(метоксііміно)-2-піролідинкарбоксамід (102,10г; них для другого хроматографування, одержували 302,63ммоль; 1,00екв.) та толуол-4-сульфонілчистий Z-ізомер у вигляді безбарвного масла, яке хлорид (86,54г; 453,94ммоль; 1,50екв.) у піридині містило 5-10% відповідного кетону. Після розчи(1500,00мл) при 80°С протягом ночі до завершеннення у суміші тетрагідрофурану з дихлорметаном ня реакції. Леткі компоненти видаляли у вакуумі, а (1:4, загальна кількість 7об.од.), оброблення призалишок розчиняли у ДХМ (1л). Органічну фазу щепленим до полімеру трисаміном (1г на 4,5г Zпромивали 1-н. НСl (2x500мл), а потім насиченим ізомеру) протягом 24-48год, фільтрування та конрозчином NaHCO3 (1x500мл). Органічну фазу суцентрування під зниженим тиском при 40-45°С шили над MgSO4, фільтрували і концентрували, одержано (3Z,5S)-5-[3-(2-гідроксіетил)-1,2,4одержуючи чорний залишок (178г). Цей залишок оксадіазол-5-іл]-1-[(2'-метилбіфеніл-4-іл)карбоніл]змішували з ДХМ (350мл), і одержану суспензію 3-піролідинон-О-метилоксим у вигляді злегка зафільтрували, одержуючи порошок кремового кобарвленої твердої речовини (вихід у межах 30льору. Фільтрат вводили у хроматографічну коло35%). нку (Novasep) (дихлорметан) для очищення. ФракПриклад 3: (3EZ,5S)-1-([1,1'-біфеніл1-4ції, що становили інтерес, об'єднували і ілкарбоніл)-5-{5-[(диметиламіно)-метил]-1,2,4концентрували, одержуючи коричневий залишок, оксадіазол-3-іл1-3-піролідинон-О-метилоксим: який об'єднували з попередньо виділеною твер(3Z,5S)-1-(1,1¢-біфеніл]-4-ілкарбоніл)-5-{5дою речовиною (кремовим порошком). Об'єднані [(диметиламіно)-метил]-1,2,4-оксадіазол-3-іл}-3тверді продукти розводили метил-трет-бутиловим піролідинон-O-метилоксим: (3E,5S)-1-([1,1'простим ефіром (500мл), одержану суспензію фібіфеніл]-4-ілкарбоніл)-5-{5-[(диметиламіно)льтрували і промивали метил-трет-бутиловим метил]-1,2,4-оксадіазол-3-іл}-3-піролідинон-Опростим ефіром, і одержували (2S,4Z)-1-([1,1¢метилоксим біфеніл]-4-ілкарбоніл)-4-(метоксііміно)-2-піролідинУ цьому прикладі стадія 1, стадія 2 та стадія 3 карбонітрил (60,00г; 62,08%). ідентичні відповідним стадіям у Прикладі 2. Стадія 4b: Одержання (3EZ,5S)-1-([1,1'Стадія 4а: Одержання (2S,4Z)-1-([1,1'-біфеніл]біфеніл]-4-ілкарбоніл)-5-{5-[(диметиламіно)метил]4-ілкарбоніл)-4-(метоксііміно)-21,2,4-оксадіазол-3-іл}-3-піролідинон-Oпіролідинкарбонітрилу (сполука (Vlla) за Схемою 7) метилоксиму; (3Z,5S)-1-([1,1¢-біфеніл]-4У тригорлій колбі місткістю 6л охолоджували ілкарбоніл)-5-{5-[(диметил-аміно)метил]-1,2,4до -20°С в атмосфері азоту (2S)-1-(біфеніл-4оксадіазол-3-іл}-3-піролідинон-O-метилоксиму; ілкарбоніл)-4-(метоксііміно)-піролідин-2-карбонову (3E,5S)-1-([1,1¢-біфеніл]-4-ілкарбоніл)-5-{5кислоту (151,95г; 449,39ммоль; 1,00екв.) у безвод[(диметиламіно)метил]-1,2,4-оксадіазол-3-іл}-3ному THF (2500,00мл), після чого додавали триепіролідинон-О-метилоксиму тиламін (62,46мл; 449,39ммоль; 1,00екв.) (при У тригорлій колбі місткістю 2л до (2S,4Z)-1цьому температура підвищувалася до -15°С). Роз([1,1¢-біфеніл]-4-ілкарбоніл)-4-(метоксііміно)-2чин перемішували протягом 10хв, і знижували тепіролідинкарбонітрилу (59,10г; 185,06ммоль; мпературу до -35°С. Додавали до розчину протя1,00екв.) та гідрохлориду гідроксиламіну (15,43г; гом 10хв етилхлорформіат (42,78мл; 449,39ммоль; 222,07ммоль; 1,20екв.) в EtOH (1200,00мл) дода1,00екв.), підтримуючи температуру -35°С. Реаквали краплями при кімнатній температурі протягом ційну суміш перемішували протягом 2год, даючи 5хв триетиламін (30,87мл; 222,07ммоль; 1,20екв.). температурі підвищуватися до -20°С. Додавали Потім реакційну суміш перемішували при 80°С додатково 4мл етилхлорформіату краплями пропротягом ночі до завершення реакції. Давали сутягом 5хв, і реакційну суміш перемішували при міші охолодитися до кімнатної температури і ви20°С протягом 30хв. Одержували насичений роздаляли EtOH у вакуумі. До суміші додавали воду чин аміаку в THF шляхом пропускання аміаку че(1л), і суспензію фільтрували. Для видалення порез 500мл безводного THF протягом 20хв при бічних продуктів твердий матеріал двічі промивали 60°С в атмосфері азоту у тригорлій колбі місткістю ацетонітрилом (2x100мл), потім діетиловим ефі2л. За допомогою крапельної лійки додавали розром (1x100мл), і одержували продукт із чистотою чин аміаку до реакційної суміші, підтримуючи тем75%. Після сушіння у вакуумі при кімнатній темпепературу нижче -25°С. Давали розчину нагрітися ратурі одержували (2S,4Ζ)-1-(біфеніл-4-карбоніл)до кімнатної температури протягом 3год, і переміN'-гідрокси-4-(метоксііміно)-піролідин-2шували реакційну суміш протягом ночі. Охолоджукарбоксимідамід (55,06г; 84,43%). вали реакційну суміш до 10°С, і додавали крапляДо суспензії (2S,4Z)-1-(біфеніл-4-карбоніл)-N'ми додатково 250мл насиченого розчину аміаку в гідрокси-4-(метоксііміно)-піролідин-2THF при -60°С протягом 10хв. Потім реакційну карбоксимідаміду (11,5г; 32,63ммоль; 1,00екв.), 4суміш перемішували, даючи їй нагрітися до кімнадиметиламіно-піридину (4,78г; 39,16ммоль; тної температури. Після 3год перемішування у 1,20екв.), Ν,Ν-диметилгліцину (= R7-COOH; 4,04г; реакційну суміш пропускали аміак при температурі 39,16ммоль; 1,20екв.) у 1000мл суміші ДХМ/ДМФ 15°С протягом 10хв. Концентрували реакційну (1:1), додавали гідрохлорид N-(3суміш у вакуумі до об'єму 1л. Одержану суспензію диметиламінопропіл)-N¢-етилкарбодііміду (6,88г; фільтрували, і залишок промивали 0,1-н. NaOH. 35,90ммоль; 1,10екв.). Одержану суспензію беже 31 86226 32 вого кольору перемішували при кімнатній темпе40°С в атмосфері азоту у тригорлій колбі місткістю ратурі. Перемішування продовжували протягом 1л. За допомогою крапельної лійки додавали розночі. Розчинник видаляли під зниженим тиском, чин аміаку (400мл) до реакційної суміші, підтримукоричневий маслянистий залишок розчиняли в ючи температуру нижче -25°С. Давали розчину дихлорметані, двічі промивали 5% лимонною киснагрітися до -20°С протягом 1год, після чого було лотою (для розшарування емульсії необхідно довиявлено завершення реакції, і давали темперадати розсіл) і двічі насиченим розчином NаНСО3, турі підвищитися до кімнатної протягом ночі. Конорганічний шар сушили над MgSO4 і концентрувацентрували реакційну суміш у вакуумі до об'єму ли під зниженим тиском, одержуючи 12,45г корич200мл, залишок розводили 600мл метил-третнювато-жовтої твердої речовини. Цю речовину бутилового простого ефіру (МТВЕ). Одержану суділили на три однакові частини (приблизно по спензію фільтрували, і осад на фільтрі промивали 4,15г), кожну таку порцію розчиняли у 500мл піриМТВЕ (2x200мл), об'єднані фільтрати додатково дину, і одержані розчини нагрівали (ЕТ=120°С) розводили етилацетатом (400мл) і промивали вопротягом ночі до завершення реакції. Ці розчини дою (2x500мл). Водну фазу піддавали зворотній об'єднували, піридин видаляли у вакуумі, залишок екстракції етилацетатом (300мл), об'єднані органірозчиняли у ДХМ, промивали двічі 5% лимонною чні фази сушили над сульфатом магнію, фільтрукислотою (розділення шарів було можливе тільки вали і концентрували під зниженим тиском, одерпісля додання розсолу внаслідок утворення емужуючи (2S,4Z)-4-(метоксііміно)-1-[(2'-метилбіфенілльсії), сушили над MgSO4 і випарювали під зниже4-іл)карбоніл]-L-пролінамід (163,64г; 109,4% теоним тиском, одержуючи 12,9г чорного масла. Цей ретичної кількості). У подальшому продукт викоринеочищений продукт піддавали попередньому стовували без очищення. У тригорлій колбі місткісочищенню шляхом фільтрування через шар сортю 3л перемішували (2S,4EZ)-4-(метоксііміно)-1бенту (діоксид кремнію; дихлорметан/МеОН = [(2'-метилбіфеніл-4-іл)карбоніл]-L-пролінамід 95:5), і одержували 10,67г коричневого масла. (149,56г; 425,61ммоль; 1,00екв., розраховано на Очищення одержаного продукту (суміші E/Z основі 100% виходу на попередній стадії) та толуізомерів) виконували на колонці (із застосуванням ол-4-сульфонілхлорид (121,71г; 638,41ммоль; звичайного діоксиду кремнію; EtOAc/циклогексан = 1,50екв.) у піридині (1,5л) при 80°С до завершення 9:1). Перша стадія очищення забезпечила повне реакції (4,5год). Леткі компоненти видаляли у вавидалення усіх побічних продуктів та одержання куумі при 40-45°С, і залишок змішували з ДХМ продукту у вигляді злегка забарвленої твердої ре(1л). Органічну фазу промивали 1-н. НСl човини (6,73г). Після другої стадії очищення у тих (2x500мл), а потім насиченим розчином NaHCO3 (1x500мл). Органічну фазу сушили над сульфатом самих умовах одержано чистий Z-ізомер: (3Z,5S)магнію, фільтрували і концентрували, одержуючи 1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[(диметиламіно)чорний залишок. Цей залишок змішували з ДХМ метил]-1,2,4-оксадіазол-3-іл}-3-піролідинон-О(350мл) і вводили у хроматографічну колонку метилоксим (4,937г; 36%). (Novasep) (дихлорметан) для очищення. Фракції, Приклад 3а: (3EZ,5S)-5-{5що становили інтерес, об'єднували і концентрува[(диметиламіно)метил]-1,2,4-оксадіазол-3-іл}-1-[(2'ли, одержуючи коричневий залишок, який викорисметилбіфеніл-4-іл)карбоніл]-піролідин-Отовували без додаткового очищення. Вихід: метилоксим; (3Z,5S)-5-{5-[(диметиламіно)метил](2S,4EZ)-4-(метоксііміно)-1-[(2'-метилбіфеніл-41,2,4-оксадіазол-3-іл}-1-[(2'-метилбіфеніл-4іл)карбоніл]піролідин-2-карбонітрил (136,80г; іл)карбоніл1-піролідин-О-метилоксим: (3E,5S)-5-{565,83%). [(диметиламіно)метил]-1,2,4-оксадіазол-3-іл}-1-[(2'Стадія 4b: Одержання (3EZ,5S)-5-{5метилбіфеніл-4-іл)карбоніл]-піролідин-О[(диметиламіно)метил]-1,2,4-оксадіазол-3-іл}-1-[(2'метилоксим метилбіфеніл-4-іл)карбоніл]піролідин-3-он-ОУ цьому прикладі стадія 1, стадія 2 та стадія 3 метилоксиму; (3Z,5S)-5-{5-[(диметиламіно)метил]ідентичні відповідним стадіям у Прикладі 2а. 1,2,4-оксадіазол-3-іл}-1-[(2'-метилбіфеніл-4Стадія 4а: Одержання (2S,4EZ)-4іл)карбоніл]піролідин-3-он-О-метилоксиму; (метоксііміно)-1-[2'-метилбіфеніл-4(3E,5S)-5-{5-[(диметиламіно)метил]-1,2,4іл)карбоніл]піролідин-2-карбонітрилу (сполука оксадіазол-3-іл}-1-[(2' -метилбіфеніл-4(Vlla) за Схемою 7) іл)карбоніл]піролідин-3-он-О-метилоксиму У тригорлій колбі місткістю 6л охолоджували в У тригорлій колбі місткістю 2л до (2S,4EZ)-4атмосфері азоту 4-метоксііміно-1-[(2'-метил-1,1¢(метоксііміно)-1-[2'-метилбіфеніл-4біфеніл-4-іл)карбоніл]-L-пролін (150,00г; іл)карбоніл]піролідин-2-карбонітрилу (136,38г; 425,66ммоль; 1,00екв.) у безводному THF (2,5л) до 278,70ммоль; 1,00екв.) та гідрохлориду гідрокси-25°С, після чого додавали триетиламін (80,11мл; ламіну (27,11г; 390,18ммоль; 1,40екв.) в етанолі 576,30ммоль; 1,63екв.) (при цьому температура (1,5л) додавали краплями при кімнатній темперапідвищувалася до -23°С). Розчин перемішували турі протягом 5хв триетиламін (54,23мл; протягом 10хв, і знижували температуру до -40°С. 390,18ммоль; 1,40екв.). Потім реакційну суміш Додавали до розчину протягом 30хв етилхлорфоперемішували при 80°С протягом ночі до заверрміат (54,86мл; 576,30ммоль; 1,63екв.), підтримушення реакції. Давали суміші охолодитися до кімючи температуру нижче -35°С. Реакційну суміш натної температури, і видаляли етанол у вакуумі. перемішували протягом 2,5год, даючи температурі До суміші додавали воду (1л), і суспензію фільтрупідвищуватися до -19°С. Одержували суспензію вали. Одержану тверду речовину промивали двічі оранжевого кольору. Одержували насичений розацетонітрилом (2x150мл) і сушили у вакуумі при чин аміаку в THF шляхом пропускання аміаку чекімнатній температурі, одержуючи (2S,4EZ)-N'рез 500мл безводного THF протягом 20хв при 33 86226 34 гідрокси-4-(метоксііміно)-1-[(2'-метилбіфеніл-4витримували в цьому діапазоні температур до очііл)карбоніл]піролідин-2-карбоксимідамід (52,00г; куваного завершення реакції (очікувана тривалість 50,92%). 1-2год). Суміш концентрували у вакуумі при 40До суспензії (2S,4EZ)-N'-гідрокси-445°С. Додавали до залишку етилацетат (8об.од.) (метоксііміно)-1-[(2'-метилбіфеніл-4та воду (8об.од.), і розділяли шари. Органічну фаіл)карбоніл]піролідин-2-карбоксимідаміду (19,00г; зу промивали насиченим розсолом (8об.од.), а 51,85ммоль; 1,00екв.), 4-диметиламіно-піридину потім сушили над сульфатом натрію (2мас.од.). (7,60г; 62,22ммоль; 1,20екв.), Ν,Ν-диметилгліцину Суміш фільтрували, осад на фільтрі промивали (= R7-COOH; 6,42г; 62,22ммоль; 1,20екв.) у 1,8л етилацетатом (1об.од.), і фільтрати концентрували суміші ДХМ/ДМФ (1:1), додавали гідрохлорид N-(3у вакуумі при 40-45°С. Залишок розчиняли у дихдиметиламінопропіл)-N'-етилкарбодііміду (10,93г; лорметані (1об.од.), і одержаний розчин ділили на 57,04ммоль; 1,10екв.). Одержану суспензію передві рівні частини для хроматографування. Кожну мішували при кімнатній температурі протягом ночі, порцію розчину очищали методом безводної причому утворювався розчин. Розчинник видаляли флеш-хроматографії із застосуванням діоксиду під зниженим тиском, залишок розчиняли у дихлокремнію (1,8мас.од.) при елююванні 25% (об'ємрметані, двічі промивали 5% лимонною кислотою і них) етилацетату в гептані (12об.од.), а потім 50% двічі насиченим розчином NaHCO3, органічний (об'ємних) етилацетату в гептані (12об.од.) для шар сушили над сульфатом магнію і концентрувавидалення неосновних домішок. Фракції з обох ли під зниженим тиском, одержуючи 24,57г аморколонок, які містили продукт, об'єднували і конценфної твердої речовини коричнюватого кольору. трували у вакуумі при 40-45°С. Залишок розчиняЦю речовину ділили на п'ять однакових частин ли у THF (2,5об.од.) і знов концентрували у вакуумі (приблизно по 4,91г), кожну таку порцію розчиняли при 40-45°С, одержуючи бажаний продукт (80у 200мл піридину, і одержані розчини нагрівали 100%, 83-104% (мас.)). (ЕТ=120°С) протягом ночі до завершення реакції. Стадія 5: Одержання (3Z/Е,5S)-1-(біфеніл-4Ці розчини об'єднували, піридин видаляли у вакуілкарбоніл)-5-гідроксиметил)піролідин-3-он-Оумі, і одержаний залишок піддавали попередньому метилоксиму (відновлення у сполуку (Id) за Схеочищенню хроматографією (Novasep, 100% етимою 7) лацетат), і одержували коричневе масло (10,28г). (4Z/E,2S)-мeтил-1-(бiфeнiл-4-iлкapбoнiл)-4Після очищення флеш-хроматографією в тих самeтoкciiмінo)пipoлiдин-2-карбоксилат (1мас.од.), мих умовах одержано жовте масло (2,62г), яке THF (4,7об.од.) та метанол (4,7об.од.) завантажуповторно очищали в тих самих умовах, і одержували у колбу відповідної місткості. Одержаний ровали вказану в заголовку сполуку у формі чистого зчин охолоджували до температури в межах від Z-ізомеру: (3Z,5S)-5-{5-[(диметиламіно)метил]0°С до 10°С в атмосфері азоту і додавали части1,2,4-оксадіазол-3-іл}-1-[(2'-метилбіфеніл-4нами боргідрид літію (0,1мас.од.), підтримуючи іл)карбоніл]піролідин-3-он-О-метил-оксим (3,54г; температуру нижче 20°С. Реакційну суміш пере15%). мішували при 16-25°С до завершення реакції за Приклад 4: (3Z/Е,5S)-1-(біфеніл-4-ілкарбоніл)даними ТШХ (очікувана тривалість 2-3год). Гасили 5-гідроксиметил)-піролідин-3-он-О-метилоксим реакцію доданням води (0,8об.од.), і концентруваУ цьому прикладі стадія 1, стадія 2 та стадія 3 ли суміш у вакуумі при 40-45°С. Додавали до заідентичні відповідним стадіям у Прикладі 1. лишку етилацетат (10об.од.) та воду (5об.од.), і Стадія 4: (4Z/Е,2S)-метил-1-(біфеніл-4розділяли шари. Водний шар піддавали зворотній ілкарбоніл)-4-метоксііміно)-піролідин-2екстракції етилацетатом (2об.од.). Органічні фази карбоксилат (естерифікація за Схемою 7) об'єднували і промивали 1Μ НСl (5об.од.), насиче4-метоксііміно-1-[(2'-метил-1,1'-біфеніл-4-іл)ним розчином NаНСО3 (5об.од.) та насиченим рокарбоніл]-L-пролін (1мас. од.), ацетон (10об.од.) та зсолом (5об.од.). Органічний розчин сушили над карбонат калію (1мас.од.) завантажували у колбу сульфатом магнію (2мас.од.). Суміш фільтрували, відповідної місткості в атмосфері азоту. Суміш і фільтрат концентрували у вакуумі при 40-45°С, охолоджували до температури в межах від 0°С до одержуючи бажаний продукт (80-100%, 74-92% 10°С, і додавали диметилсульфат, підтримуючи (мас.)). Неочищений продукт потім піддавали очитемпературу нижче 10°С. Нагрівали реакційну сущенню. міш до температури в межах від 16°С до 25°С і Комп’ютерна верстка Л. Купенко Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for preparing pyrrolidine oximes
Автори англійськоюNadler William, Pupowicz Doris
Назва патенту російськоюСпособ получения пирролидиноксимов
Автори російськоюНадлер Уильям, Пупович Дорис
МПК / Мітки
МПК: C07D 207/22
Мітки: спосіб, одержання, піролідиноксимів
Код посилання
<a href="https://ua.patents.su/17-86226-sposib-oderzhannya-pirolidinoksimiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання піролідиноксимів</a>
Попередній патент: Спосіб спалювання горючих відходів
Наступний патент: Широкосмуговий балансний нвч змішувач
Випадковий патент: Спосіб діагностики передеклампсій вагітних