Рекомбінантні дріжджі (варіанти), рекомбінантна молекула днк, вектор, спосіб одержання рекомбінантних дріжджів, спосіб зброджування ксилози до етанолу, спосіб зброджування глюкози до етанолу
Формула / Реферат
1. Рекомбинантные дрожжи, содержащие введенные гены, кодирующие ксилозоредуктазу, ксилитдегидрогеназу и ксилулокиназу, и эффективные для сбраживания ксилозы до этанола.
2. Рекомбинантные дрожжи по п. 1, отличающиеся тем, что эти дрожжи эффективны также для сбраживания глюкозы до этанола.
3. Рекомбинантные дрожжи по п. 2, отличающиеся тем, что они относятся к роду Saccharomyces.
4. Рекомбинантные дрожжи по п. 3, отличающиеся тем, что указанные гены слиты с не ингибируемыми глюкозой промоторами и что эти дрожжи эффективны для одновременного сбраживания глюкозы и ксилозы до этанола.
5. Рекомбинантная молекула ДНК, содержащая гены, кодирующие ксилозоредуктазу, ксилитдегидрогеназу и ксилулокиназу.
6. Рекомбинантная молекула ДНК по п. 5, отличающаяся тем, что указанные гены слиты с не ингибируемыми глюкозой промоторами.
7. Вектор, эффективный для трансформации дрожжей и содержащий гены, кодирующие ксилозоредуктазу, ксилитдегидрогеназу и ксилулокиназу.
8. Вектор по п. 7, отличающийся тем, что указанные гены слиты с не ингибируемыми глюкозой промоторами.
9. Способ получения рекомбинантных дрожжей, эффективных для сбраживания ксилозы до этанола, предусматривающий введение ДНК в дрожжи таким образом, чтобы эти дрожжи имели введенные гены, кодирующие ксилозоредуктазу, ксилитдегидрогеназу и ксилулокиназу.
10. Способ по п. 9, отличающийся тем, что введенная ДНК содержит гены, кодирующие ксилозоредуктазу, ксилитдегидрогеназу и ксилулокиназу.
11. Способ по п. 9, отличающийся тем, что указанные дрожжи относятся к роду Saccharomyces.
12. Способ сбраживания ксилозы до этанола, предусматривающий сбраживание содержащей ксилозу среды рекомбинантными дрожжами, содержащими введенные гены, кодирующие ксилозоредуктазу, ксилитдегидрогеназу и ксилулокиназу, и эффективными для сбраживания ксилозы до этанола.
13. Способ по п. 10, отличающийся тем, что среда содержит также глюкозу и что эти дрожжи также эффективны для сбраживания глюкозы до этанола.
14. Способ по п. 13, отличающийся тем, что эти дрожжи относятся к роду Saccharomyces.
15. Способ по п. 14, отличающийся тем, что указанные гены слиты с не ингибируемыми глюкозой промоторами и указанные дрожжи эффективны для одновременного сбраживания глюкозы и ксилозы до этанола.
16. Способ сбраживания глюкозы до этанола, предусматривающий сбраживание содержащей глюкозу среды рекомбинантными дрожжами, содержащими введенные гены, кодирующие ксилозоредуктазу, ксилитдегидрогеназу и ксилулокиназу, и эффективными для сбраживания ксилозы и глюкозы до этанола.
17. Способ по п. 16, отличающийся тем, что указанная среда содержит также ксилозу.
18. Способ по п. 17, отличающийся тем, что указанные дрожжи относятся к роду Saccharomyces.
19. Рекомбинантные дрожжи, содержащие гены, кодирующие ксилозоредуктазу, ксилитдегидрогеназу и ксилулокиназу, причем эти гены слиты с не ингибируемыми глюкозой промоторами и указанные дрожжи эффективны для сбраживания ксилозы до этанола.
20. Рекомбинантные дрожжи по п. 19, отличающиеся тем, что указанные дрожжи эффективны также для сбраживания глюкозы до этанола.
Текст
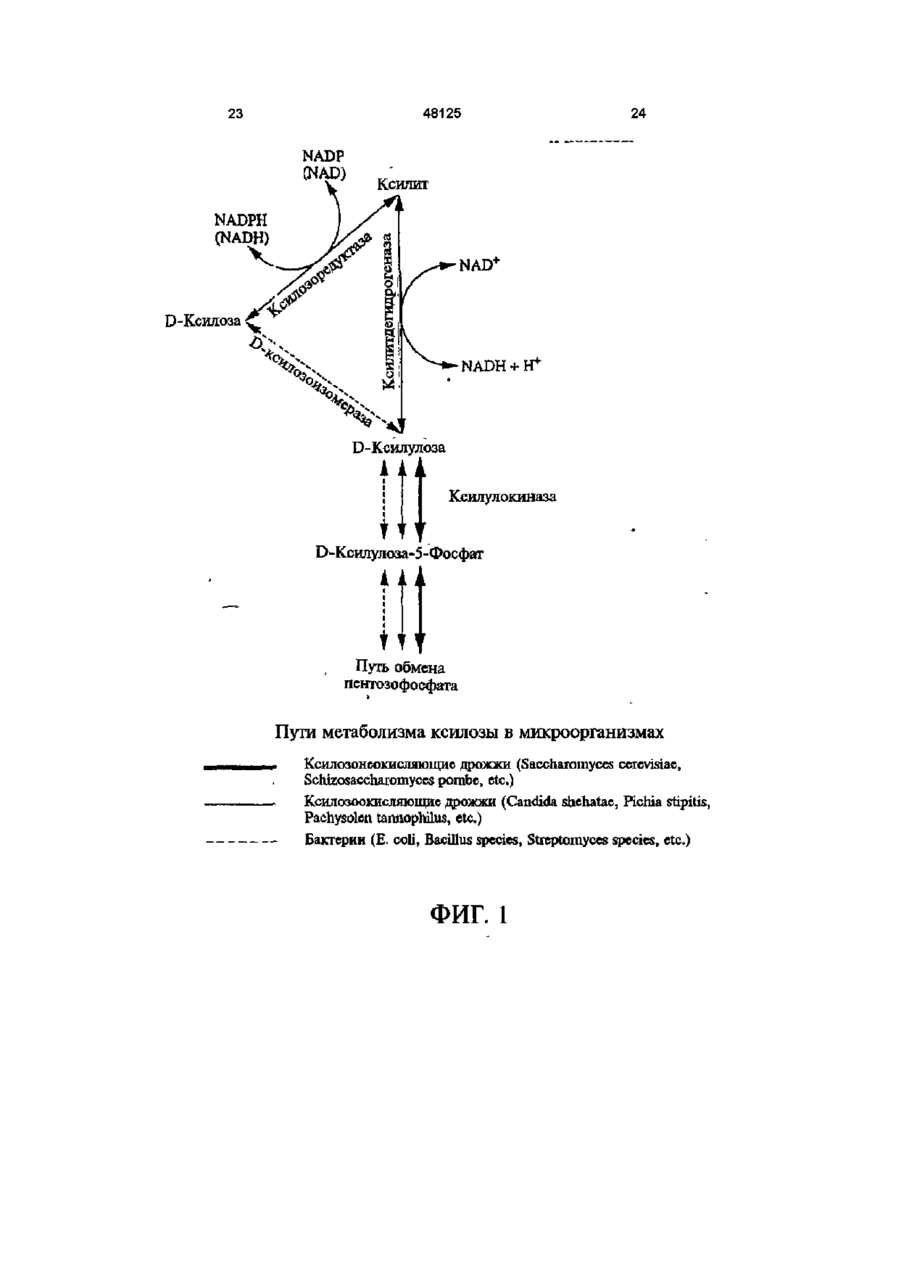
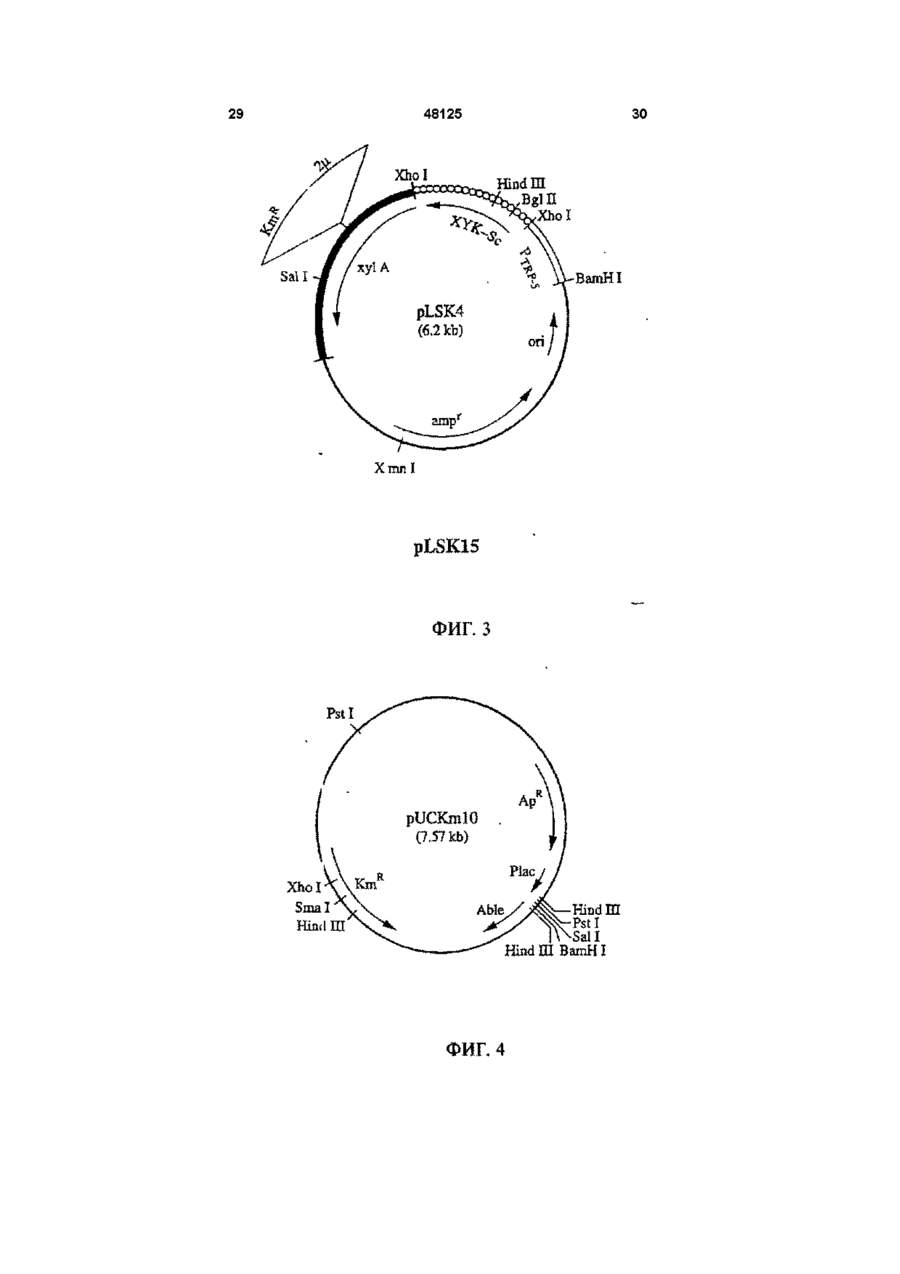
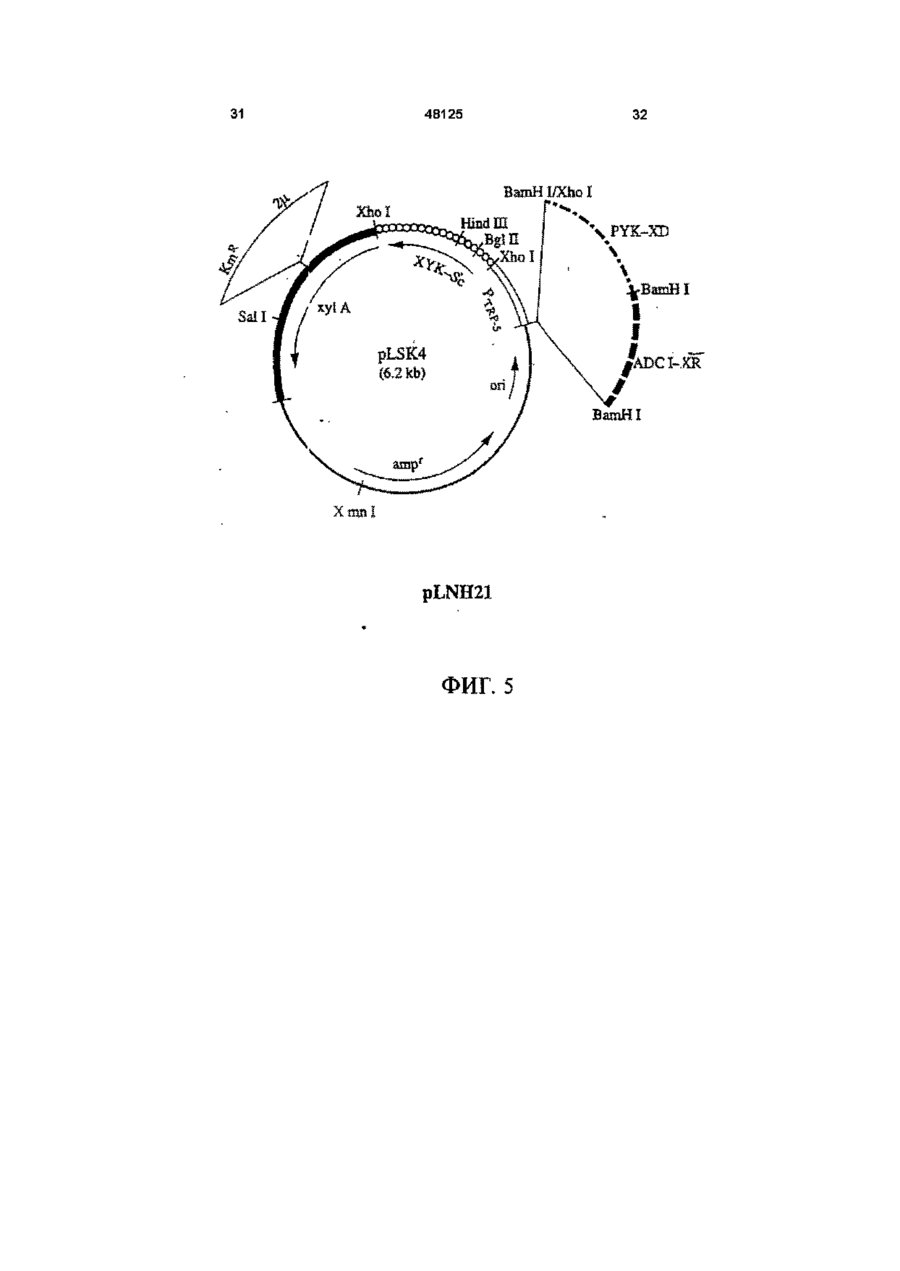
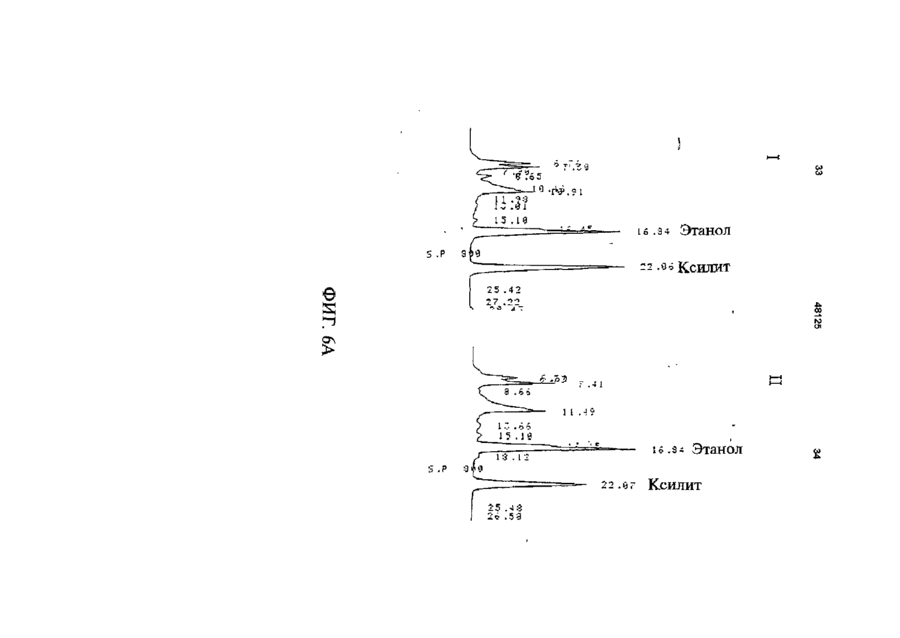
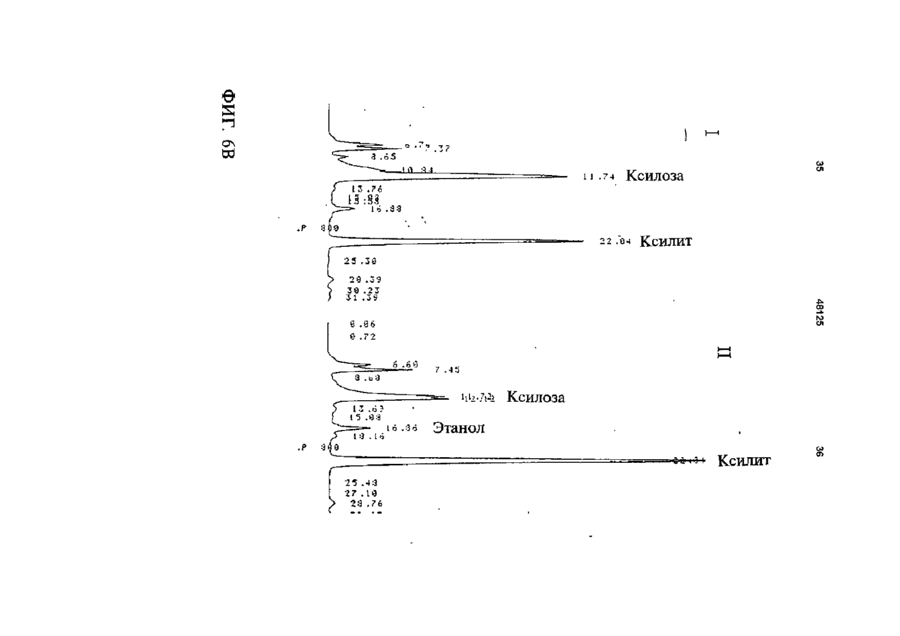
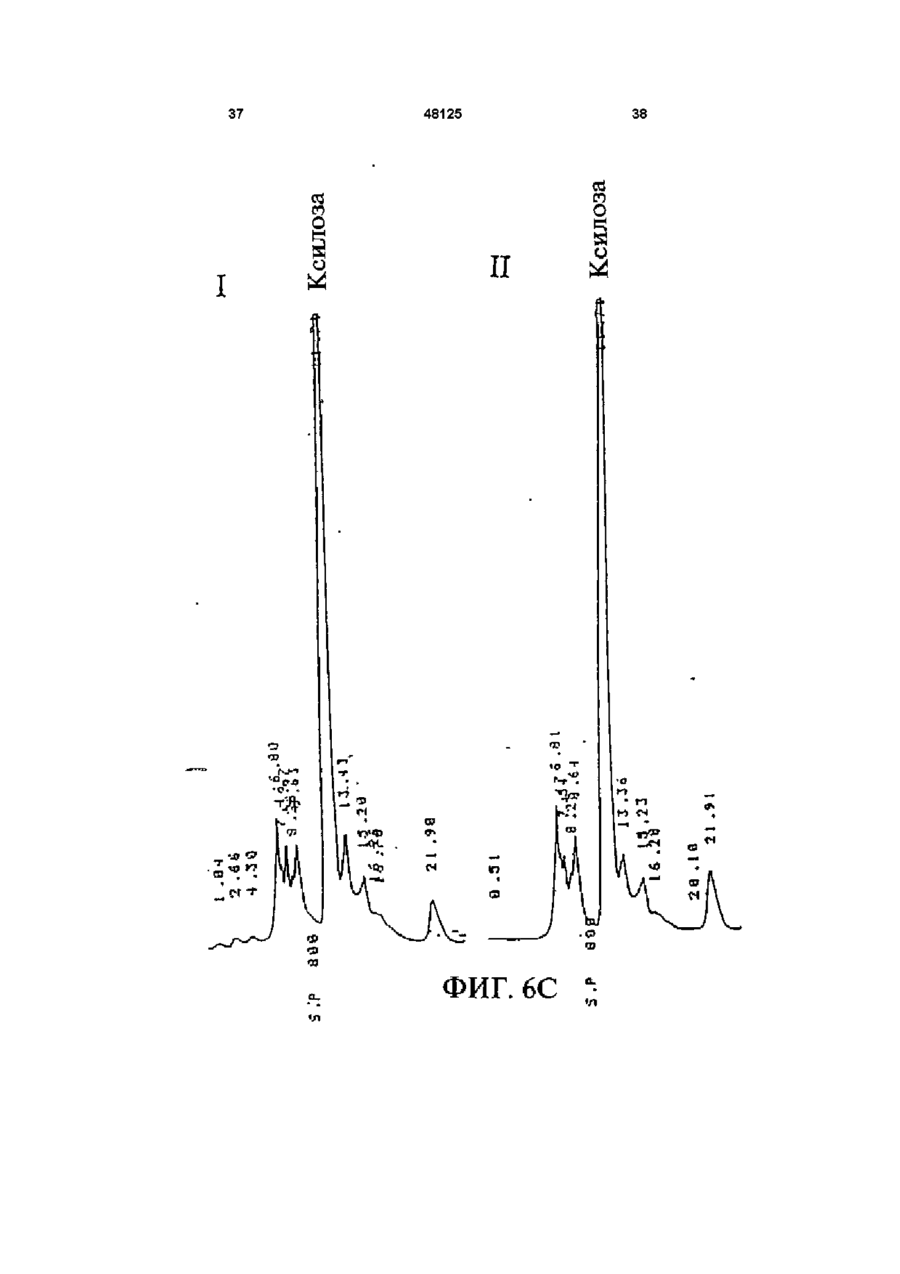
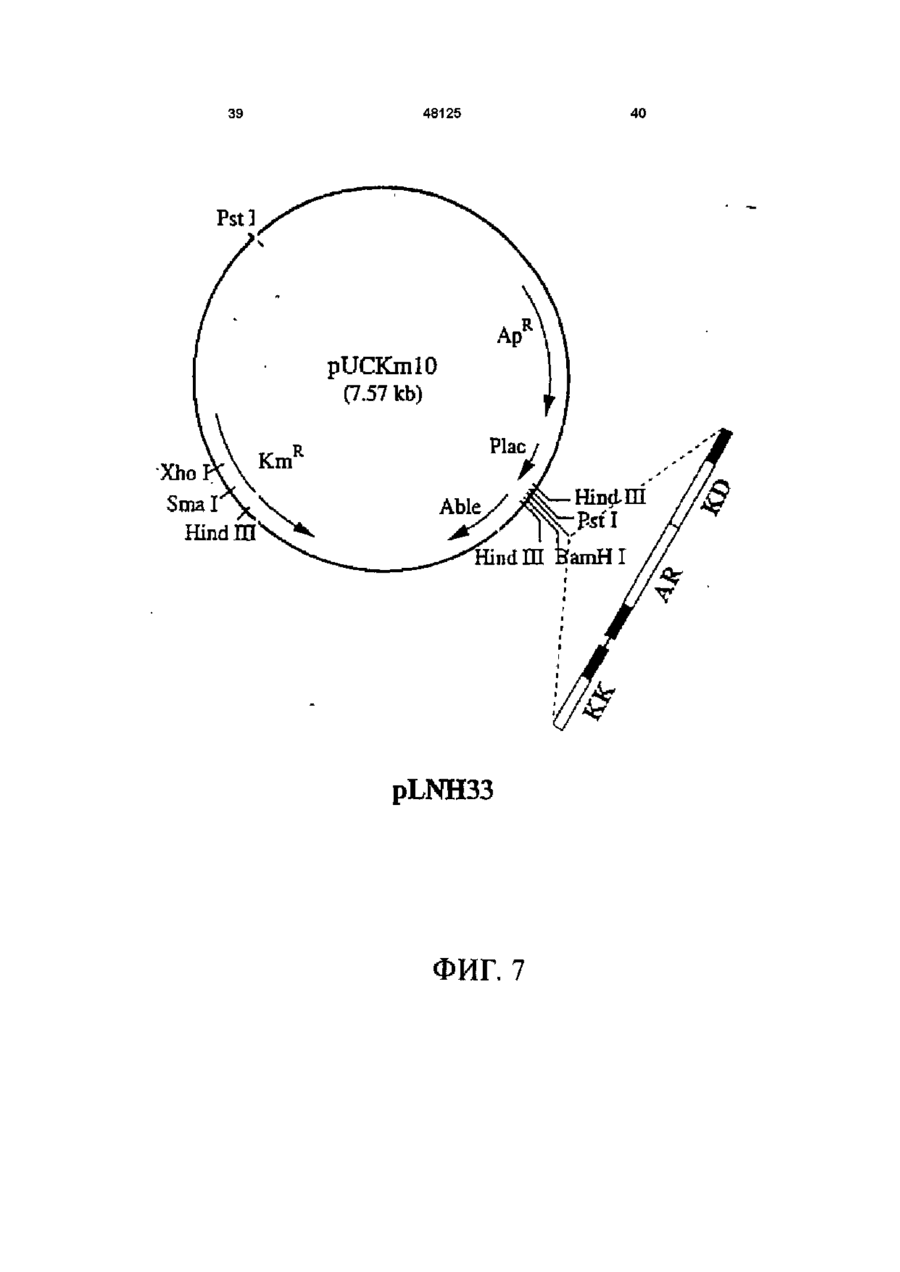
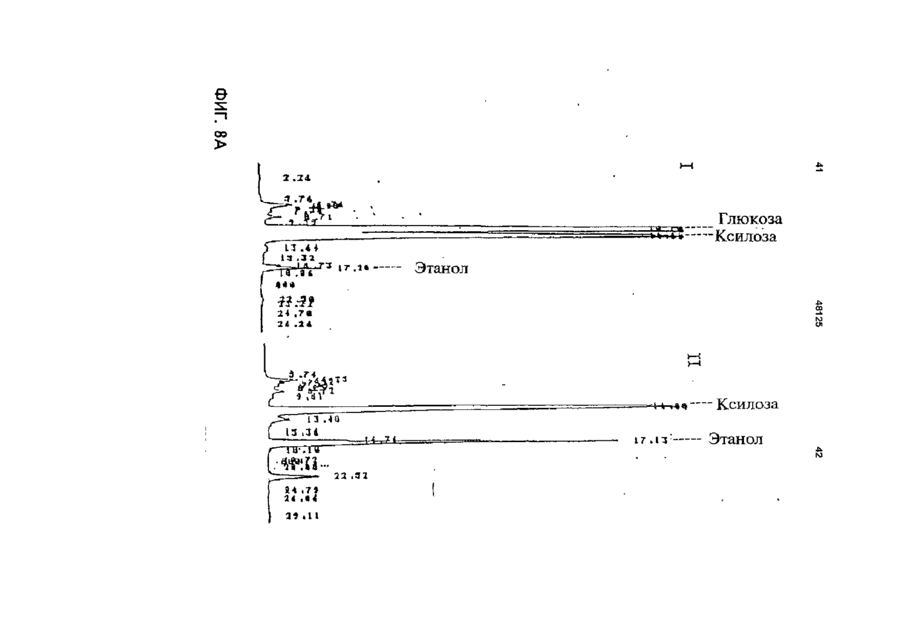
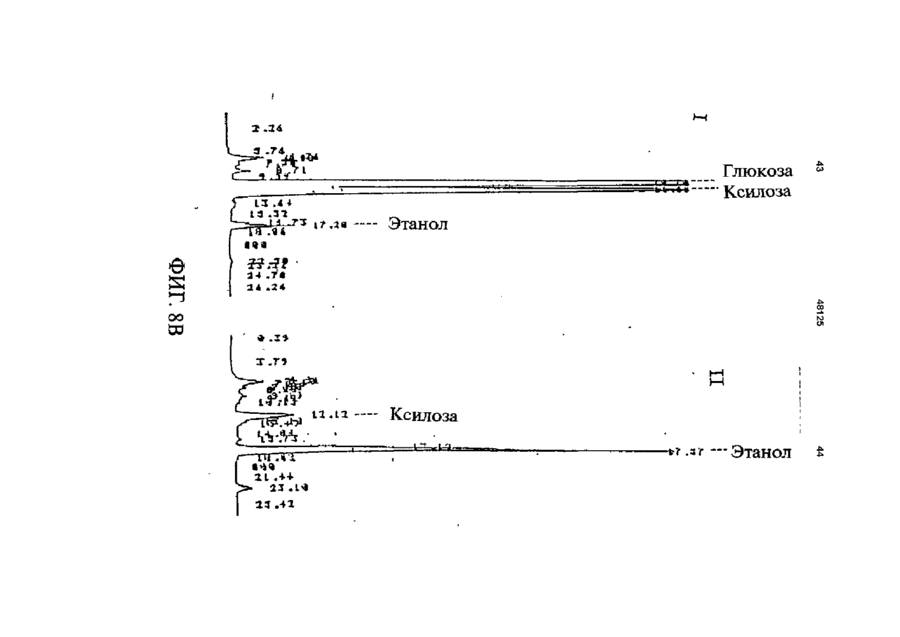
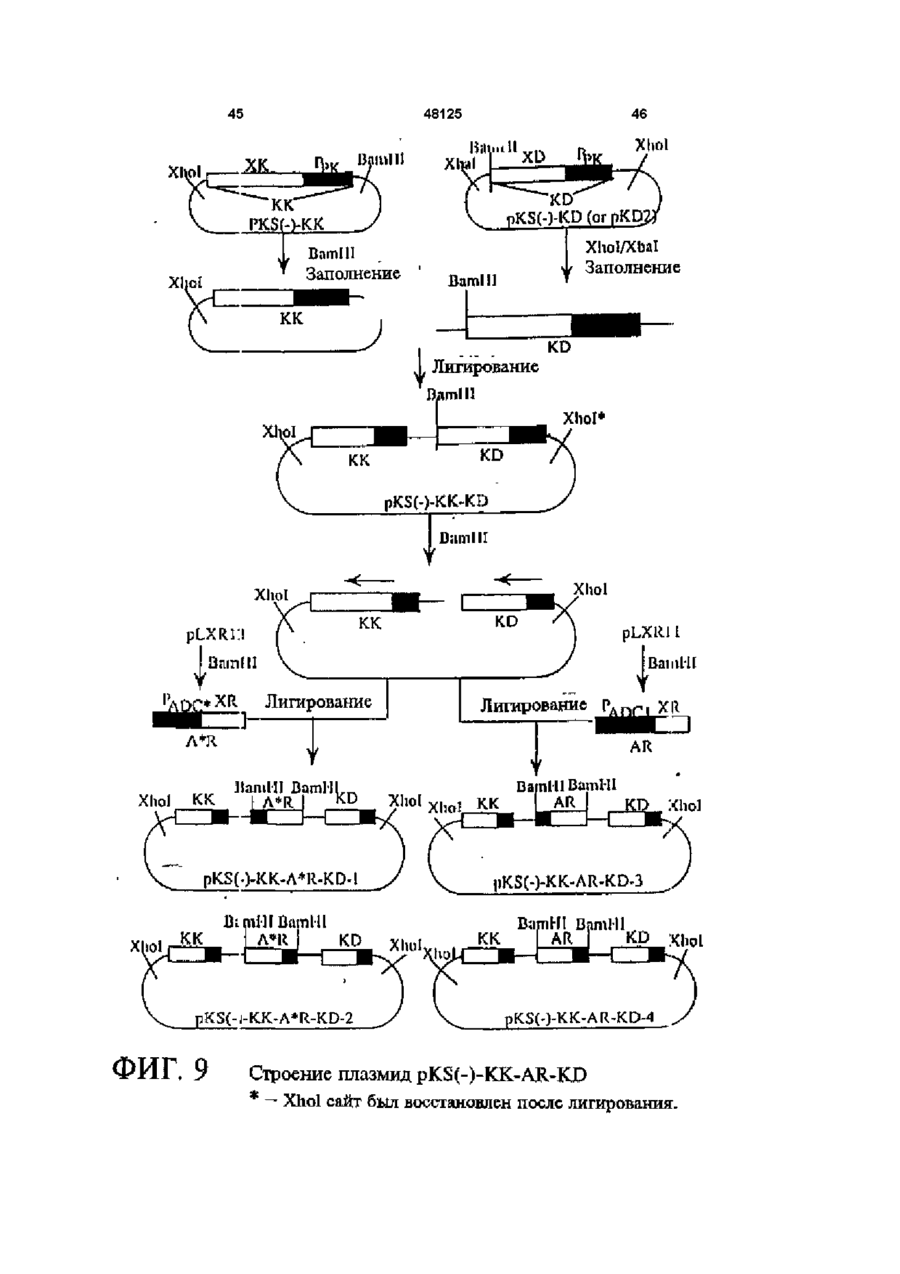
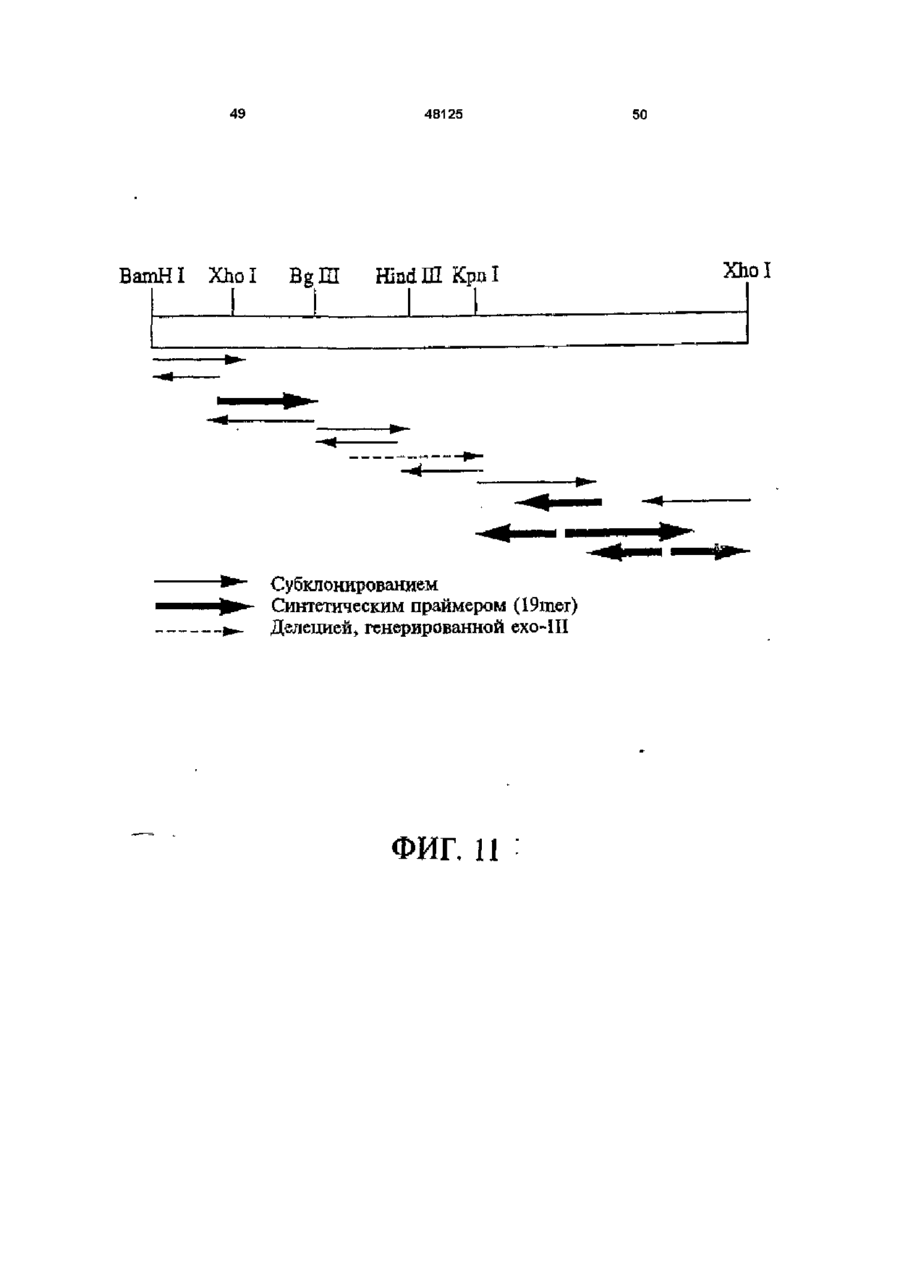
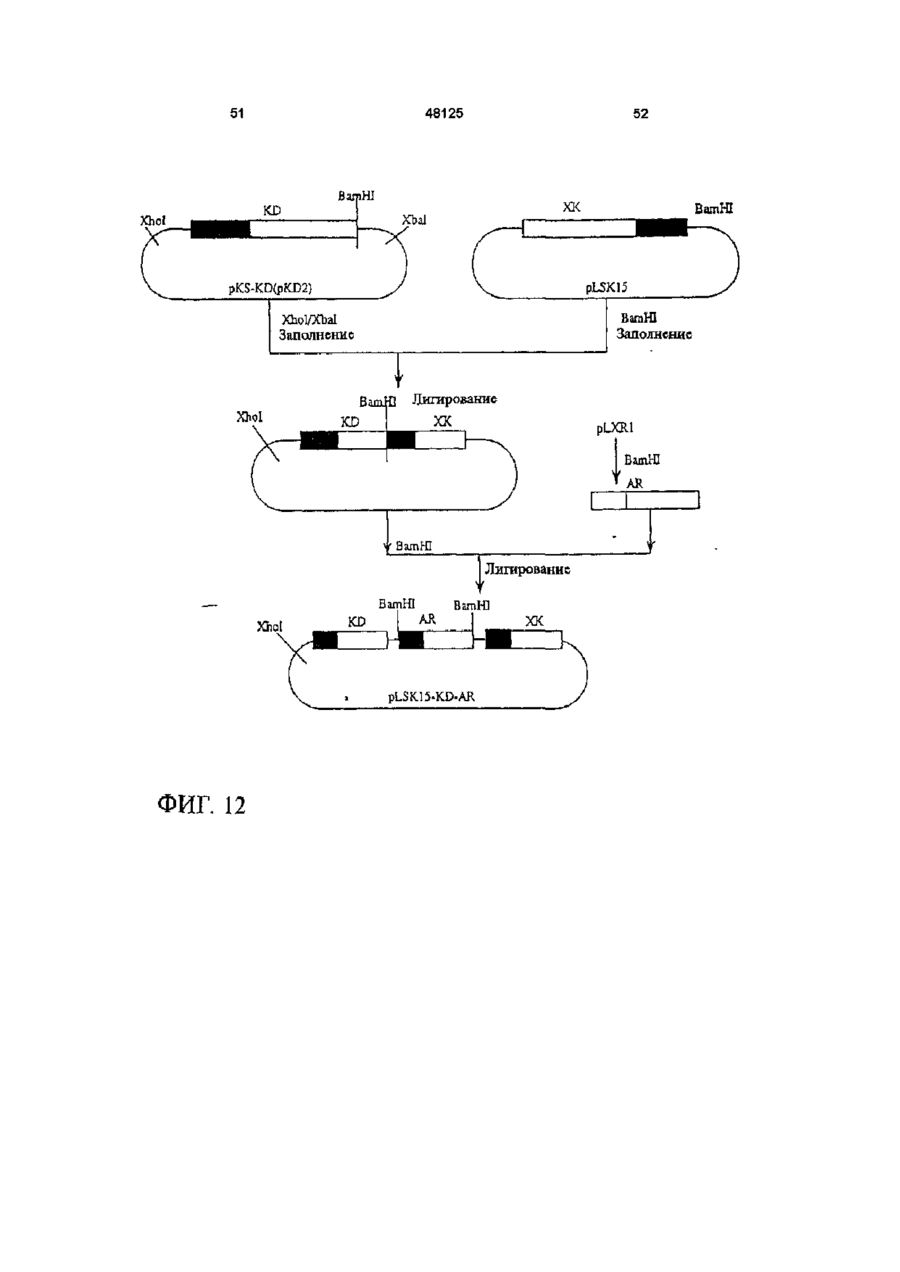
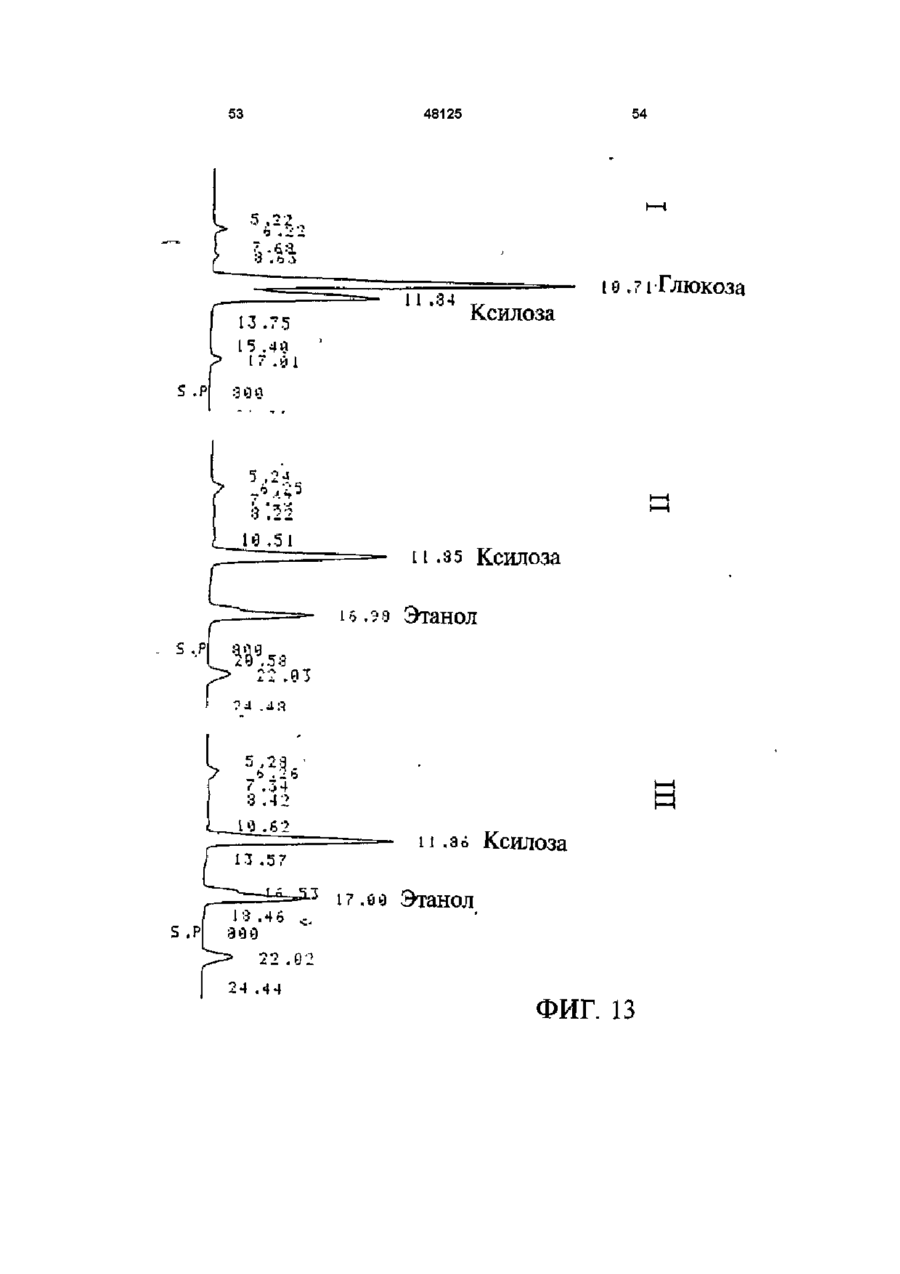
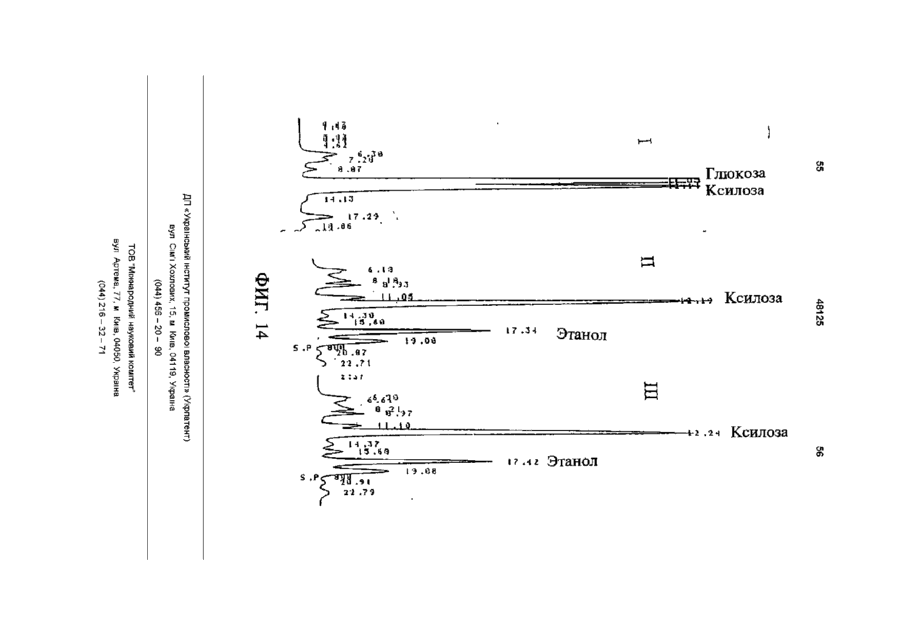
1 Рекомбинантные дрожжи, содержащие введенные гены, кодирующие ксилозоредуктазу, ксилитдегидрогеназу и ксилулокиназу, и эффективные для сбраживания ксилозы до этанола 2 Рекомбинантные дрожжи по п 1, отличающиеся тем, что эти дрожжи эффективны также для сбраживания глюкозы до этанола 3 Рекомбинантные дрожжи по п 2, отличающиеся тем, что они относятся к роду Saccharomyces 4 Рекомбинантные дрожжи по п 3, отличающиеся тем, что указанные гены слиты с не ингибируемыми глюкозой промоторами и что эти дрожжи эффективны для одновременного сбраживания глюкозы и ксилозы до этанола 5 Рекомбинантная молекула ДНК, содержащая гены, кодирующие ксилозоредуктазу, ксилитдегидрогеназу и ксилулокиназу 6 Рекомбинантная молекула ДНК по п 5, отличающаяся тем, что указанные гены слиты с не ингибируемыми глюкозой промоторами 7 Вектор, эффективный для трансформации дрожжей и содержащий гены, кодирующие ксилозоредуктазу, ксилитдегидрогеназу и ксилулокиназу 8 Вектор по п 7, отличающийся тем, что указанные гены слиты с не ингибируемыми глюкозой промоторами 9 Способ получения рекомбинантных дрожжей, эффективных для сбраживания ксилозы до этанола, предусматривающий введение ДНК в дрожжи таким образом, чтобы эти дрожжи имели введенные гены, кодирующие ксилозоредуктазу, ксилитдегидрогеназу и ксилулокиназу 10 Способ по п 9, отличающийся тем, что введенная ДНК содержит гены, кодирующие ксилозоредуктазу, ксилитдегидрогеназу и ксилулокиназу 11 Способ по п 9, отличающийся тем, что указанные дрожжи относятся к роду Saccharomyces 12 Способ сбраживания ксилозы до этанола, предусматривающий сбраживание содержащей ксилозу среды рекомбинантными дрожжами, содержащими введенные гены, кодирующие ксилозоредуктазу, ксилитдегидрогеназу и ксилулокиназу, и эффективными для сбраживания ксилозы до этанола 13 Способ по п 10, отличающийся тем, что среда содержит также глюкозу и что эти дрожжи также эффективны для сбраживания глюкозы до этанола 14 Способ по п 13, отличающийся тем, что эти дрожжи относятся к роду Saccharomyces 15 Способ по п 14, отличающийся тем, что указанные гены слиты с не ингибируемыми глюкозой промоторами и указанные дрожжи эффективны для одновременного сбраживания глюкозы и ксилозы до этанола 16 Способ сбраживания глюкозы до этанола, предусматривающий сбраживание содержащей глюкозу среды рекомбинантными дрожжами, содержащими введенные гены, кодирующие ксилозоредуктазу, ксилитдегидрогеназу и ксилулокиназу, и эффективными для сбраживания ксилозы и глюкозы до этанола 17 Способ по п 16, отличающийся тем, что указанная среда содержит также ксилозу q Ю 00 48125 18 Способ по п 17, отличающийся тем, что указанные дрожжи относятся к роду Saccharomyces 19 Рекомбинантные дрожжи, содержащие гены, кодирующие ксилозоредуктазу, ксилитдегидрогеназу и ксилулокиназу, причем эти гены слиты с не ингибируемыми глюкозой промоторами и указан ные дрожжи эффективны для сбраживания ксилозы до этанола 20 Рекомбинантные дрожжи по п 19, отличающиеся тем, что указанные дрожжи эффективны также для сбраживания глюкозы до этанола Настоящее изобретение относится, в общем, к создаваемым методами генной инженерии дрожжам, способным одновременно сбраживать два основных сахарных компонента целлюлозной биомассы, глюкозу и ксилозу, до этанола Более конкретно, настоящее изобретение касается таких дрожжей, которые могут быть созданы клонированием гена ксилозоредуктазы, гена ксилитдегидрогеназы и гена ксилулокиназы в дрожжах, способных сбраживать глюкозу этанола Недавние исследования показали, что этанол является идеальным жидким топливом для автомобилей Он может использоваться непосредственно как чистое топливо (100% этанол) или в виде смеси с бензином в различных концентрациях Применение этанола в качестве добавки или для замены бензина или заменителя бензина может снизить зависимость многих наций от импорта нефти, и также обеспечить возобновляемое топливо для транспорта Кроме того, доказано, что этанол представляет собой более чистое топливо, выделяющее гораздо меньшее количество загрязняющих веществ в окружающую среду, чем обычный бензин Например, было показано, что использование оксигенированых веществ в бензине может уменьшать выброс в воздух окиси углерода, вредного загрязняющего вещества Среди нескольких оксигенаторов, применяемых в настоящее время для повышения содержания кислорода в бензине, этанол имеет наивысшее содержание кислорода Агентство охраны окружающей среды (ЕРА) (США) показало, что в случае бензина, смешанного с 10% этанола, выброс окиси углерода снижается примерно на 25 - 30% ксилозе) Наиболее предпочтительные способы сбраживания целлюлозных материалов должны, конечно, полностью превращать и глюкозу, и ксилозу в этанол К сожалению, даже теперь не имеется ни одного известного природного микроорганизма, способного на эффективное сбраживание и глюкозы, и ксилозы Дрожжи, в частности Saccharomvces традиционно использовались для сбраживании сырья на основе глюкозы, и они по-прежнему остаются наилучшим микроорганизмом для превращения глюкозы в этанол Однако, как было установлено, эти сбраживающие глюкозу дрожжи оказались неспособными не только сбраживать ксилозу, но и использовать пентозу для роста Тем не менее, эти сбраживающие глюкозу дрожжи могут использовать ксилулозу для роста и сбраживания (фиг 1), хотя и с различной эффективностью Например, S cerevisiae сбраживает ксилулозу очень слабо, в то время как виды Schizosaccharomyces делают это вполне эффективно (Чанг и др , 1981, Ластик и др , 1989) Несмотря на то, что сбраживающие глюкозу дрожжи неспособны, использовать ксилозу ни для роста, ни для сбраживании, существует много природных дрожжей, которые могут использовать ксилозу для аэробного роста, но не в состоянии сбраживать ее до этанола Эти потребляющие, но не сбраживающие ксилозу дрожжи для превращения последней в ксилулозу используют два фермента ксилозоредуктазу и ксилитдегидрогеназу Эти дрожжи отличаются от большинства бактерий, которые для прямого превращения ксилозы в ксилулозу используют единственный фермент ксилозоиздмеразу (фиг 1) Для своего действия ксилозоредуктаза и ксилитдегидрогеназа дрожжей нуждаются в кофакторах, в качестве кофактора ксилозоредуктазы выступает никотинамидадениндинуклеотидфосфат (восстановленная форма) (NADPH), вто время как кофактором ксилитдегидрогеназы является никотинамидадениндинуклеотид (NAD) Наоборот, бактериальная ксилозоизомераза не требует никакого кофактора для прямого преобразования ксилозы в ксилулозу (фиг 1) До сих пор сырьем для получения промышленного этанола посредством сбраживания служили сахара из сахарного тростника или сахарной свеклы, крахмал из кукурузы или других продовольственных культур Однако эти сельскохозяйственные культуры слишком дороги, чтобы использовать их как сырье при широкомасштабном производстве топливного этанола Растительная биомасса является привлекательным исходным продуктом для производства этанола-горючего посредством сбраживания, потому что она является возобновляемой и доступной в больших количествах при малой стоимости Концепция использования спирта, продуцируемого микробным сбраживанием Сахаров из сельскохозяйственной биомассы, появилась, по крайней мере, два десятилетия назад Основными сбраживаемыми сахарами из целлюлозных материалов являются глюкоза и ксилоза, (с равным приблизительно 2 или 3 к 1 отношением глюкозы к Два десятилетия назад много усилий было затрачено на попытки выявления новых дрожжей, способных эффективно сбраживать как глюкозу, так и ксилозу до этанола Хотя такие идеальные дрожжи не были найдены, усилия исследователей имели некоторый успех Например, было обнаружено, что некоторые дрожжи способны не только использовать ксилозу для аэробного роста, но и сбраживать ее до этанола (Тойвола и др , 1984, Дуприз и ван дер Вальт, 1983), хотя ни одни из 48125 этих сбраживающих ксилозу дрожжей не обеспечивали ее полного сбраживания до этанола (Джеффрис, 1985) Кроме того, эти дрожжи не обеспечивают эффективного сбраживания глюкозы Из числа сбраживающих ксилозу дрожжей подробно были изучены три вида Pachysolen tannophilus (Тойвола и др, 1984), Candida shehatae (Дуприз и ван дер Вальт, 1983), и Pichia stipitis (Гроотьен и др, 1990) Р stipitis и С shehatae сбраживают ксилозу лучше, чем другие также сбраживающие ее дрожжи (Гроотьен и др , 1990) Тем не менее, даже лучшие сбраживающие ксилозу дрожжи не очень эффективны в этом отношении и крайне неэффективны в сбраживании глюкозы (Джеффрис, 1985) В течение последнего десятилетия были предприняты попытки генетической модификации традиционных сбраживающих глюкозу дрожжей, в частности S cerevisiae при помощи технологии рекомбинантных ДНК Первоначальные усилия были сконцентрированы на клонировании гена ксилозоизомеразы в дрожжах для придания им способности превращать ксилозу непосредственно в ксилулозу без кофакторов Однако эти попытки были безуспешными, т к гены, кодирующие различные бактериальные ксилозоизомеразы, не способны осуществлять контроль синтеза активного фермента в S cerevisiae (Розенфельд и др , 1984, Хо и др , 1983, Сарти и др , 1987, Вильгельм и Голленберг, 1984, Амор и др , 1989) В последние годы усилия в области генной инженерии, связанные с созданием дрожжей, в частности, S cerevisiae способных сбраживать ксилозу, сосредоточились на клонировании генов, кодирующих ксилозоредуктазу (Такайна и др, 1991, Холлборн и др, 1991, Штрассер, и др, 1990), ксилитдегидрогеназу (Кеттери др, 1990, Холлборн и др , 1990), и ксилулокиназу (Стевис и др , 1987, Чанг и Хо, 1988, Хо и Чанг, 1989, Денг и Хо, 1990) S cerevisiae и другие сбраживающие глюкозу дрожжи не отличаются сколько-либо заметной ксилозоредуктазной или ксилитдегидрогеназной активностью, но все проявляют ксилулокиназную активность Так, все сбраживающие глюкозу дрожжи могут сбраживать ксилозу, но делают это с разной эффективностью (Денг и Хо, 1990) Недавно Кеттер и др (1990), Штрассер и др (1990, и Холлборн и др (1990, 1991) клонировали ген ксилозоредуктазы и ген ксилитдегидрогеназу в S cerevisiae Однако, эти полученные с помощью методов генн л й инженерии дрожжи все еще не могут эффективно сбраживать ксилозу Hal оимер, эти дрожжи смогли обеспечить сбраживание не более 2% ксилозы Кроме того, они продуцируют большие количества ксилита из ксилозы (Холлборн и др , 1990, Кеттер и Кирьяси, 1993), что отнимает ценный субстрат - ксилозу из метаболизма сбраживания до этанола Обширные предшествующие исследования в этой области, описанные выше, показывают, что, вопреки объединенным и длительным усилиям многочисленных исследователей, дрожжи, способные эффективно сбраживать глюкозу и ксилозу до этанола, получены не были Таким образом, остается потребность в таких дрожжах и в способах их получения и применения Данное изобретение направлено на удовлетворение этих потребностей Краткое изложение сущности изобретения Особенность этого изобретения заключается в обнаружении того, что новые дрожжевые штаммы, способные эффективно сбраживать только ксилозу или ксилозу одновременно с глюкозой, могут быть созданы с помощью рекомбинантных ДНК и методов клонирования генов В частности, эти методы использовали для создания новых рекомбинантных дрожжей, содержащих клонированные гены ксилозоредуктазы (XR), ксилитдегидрогеназы (XD) и ксилулокиназы (ХК), которые были слиты с промоторами, не ингибируемыми присутствием глюкозы Таким образом, один из предпочтительных вариантов осуществления изобретения обеспечивает получение рекомбинантного дрожжевого штамма, содержащего введенные гены, кодирующие ксилозоредуктазу, ксилитдегидрогеназу и ксилулокиназу, и способного сбраживать ксилозу до этанола Этот рекомбинантный дрожжевой штамм, в предпочтительном варианте, способен также сбраживать глюкозу до этанола, но в более предпочтительном варианте получают такие дрожжевые штаммы, которые могут эффективно сбраживать эти два сахара одновременно до этанола, и у которых гены XR, XD и ХК слиты с промоторами, не ингибируемыми присутствием глюкозы и которые не требуют ксилозы для индукции Другой предпочтительный вариант изобретения обеспечивает получение рекомбинантного дрожжевого штамма, содержащего гены, кодирующие ксилитдегидрогеназу и ксилулокиназу, причем эти гены слиты с не ингибируемыми глюкозой промоторами и эти дрожжи способны сбраживать ксилозу до этанола Этот рекомбинантный дрожжевой штамм также способен, в предпочтительном варианте сбраживать глюкозу до этанола Другие предпочтительные варианты осуществления изобретения касаются реагентов, применимых для получения рекомбинантных дрожжей данного изобретения Так, данное изобретение обеспечивает также получение молекулы рекомбинантной ДНК, содержащей гены, кодирующие ксилозоредуктазу, ксилитдегидрогеназу и ксилулокиназу Изобретение, наряду с этим обеспечивает получение вектора, содержащего гены, кодирующие ксилозоредуктазу, ксилитдегидрогеназу и ксилулокиназу В этих реагентах гены, предпочтительно слиты с промоторами, которые не ингибируются глюкозой и также не требуют ксилозы для индукций, с целью рационального получения рекомбинантных дрожжей, способных одновременно сбраживать глюкозу и ксилозу до этанола Другой предпочтительный вариант осуществления данного изобретения обеспечивает способ получения рекомбинантных дрожжей, способных сбраживать ксилозу до этанола Этот способ предусматривает стадию введения ДНК в дрожжи для того, чтобы дрожжи имели введенные гены, кодирующие ксилозоредуктазу, ксилитдегидрогеназу и ксилулокиназу В предпочтительном варианте, эти 48125 гены сольются с не ингибируемыми глюкозой промоторами для обеспечения возможности одновременного сбраживания глюкозы и ксилозы до этанола Выгодно одновременное введение всех трех генов, например, с применением реагентов данного изобретения, обсужденных выше Другие предпочтительные варианты осуществления изобретения обеспечивают способы сбраживания глюкозы и ксилозы до этанола Эти способы предусматривают стадию сбраживания среды, содержащей ксилозу или глюкозу, рекомбинантным штаммом дрожжей, содержащим введенные гены, кодирующие ксилозоредуктазу, ксилитдегидрогеназу и ксилулокиназу Желательно, чтобы эти три гена слились с не ингибируемыми глюкозой промоторами и чтобы среда содержала как глюкозу, так и ксилозу, чтобы обеспечить одновременное сбраживание ксилозы и глюкозы до этанола Предпочтительные дополнительные варианты осуществления, отличительные особенности и преимущества этого изобретения будут очевидными из следующего далее описания Краткое описание рисунков Фиг 1 является схематическим изображением ферментов, связанных с ранними стадиями метаболизма ксилозы в бактериях и дрожжах, Фиг 2 показывает нуклеотидную последовательность и выведенную из нее аминокислотную последовательность гена ксилулокиназы дрожжей, в том числе 5'- и З'-фланкирующие последовательности Инициирующий и терминирующий кодоны подчеркнуты Возможные регуляторные последовательности в 5' и З'-некодирующих областях указаны стрелками, Фиг 3 показывает гены, клонированные на плазмиде pLSK15, и рестрикционную карту этой плазмиды, Фиг 4 представляет гены, клонированные на плазмиде pUCKmiO, и рестрикционную карту этой плазмиды, Фиг 5 показывает гены, клонированные на плазмиде pLNH21, и рестрикционную карту этой плазмиды, Фиг 6А показывает HPLC (ЖХВР)хроматограмму бродильного бульона, полученного сбраживанием ксилозы рекомбинантными дрожжами SC(pLNH21) (S cerevisiae содержащий введенные гены XR, и XD и ХК), в течение (I) 2 дней и (II) 4 дней, Фиг 6В показывает HPLC-хроматограмму бродильного бульона, полученного сбраживанием ксилозы с рекомбинантными дрожжами SC(pLNH13 - 32) (S cerevisiae, содержащий введенные гены XR и XD, но не содержащий гена ХК) в течение (I) 2 дней и II) 6 дней, Фиг 6С показывает HPLC-хроматограмму бродильного бульона, полученного сбраживанием ксилозы не модифицированными методами генной инженерии дрожжами S cerevisiae (не содержащими генов XR, XD или ХК) в течение (I) 2 дней и (II) 7 дней, как описано далее в примере 6, Фиг 7 показывает гены, клонированные на плазмиде pLNH33, и рестрикционную карту этой плазмиды, 8 Фиг 8А показывает HPLC-xpc 'атограмму бродильного бульона, полученного сбраживанием содержащей глюкозу и ксилозу среды (10% и 5%, соответственно) не модифицированным методами генной инженерии штаммом дрожжей 1400 (не содержащим введенных генов XR, XD или ХК) в течение (I) 0 дней, (II) 2 дней, как описано далее в примере 8, Фиг 8В показывает HPLC-хроматограмму родильного бульона, полученного сбраживанием содержащей глюкозу и ксилозу среды (10% и 5%, соответственно) рекомбинантными дрожжами 1400 (pLNH33) (штамм дрожжей 1400, содержащий введенные гены XR, XD и ХК), в течение (I) 0 дней и (II) 2 дней, как описано далее в примере 8, Фиг 9 является схематической диаграммой, представляющей в общих чертах конструирование pBluescnpt II KS(-) содержащей клонированные гены XR, XD и ХК были сконструированы четыре таких плазмиды pKS(-) - KK-A*R-KD-1, pKS(-)-KKA*R-KD-2, pKS(-)-KK-AR-KD-3, и pKS(-)-KK-AR-KD4, как описано далее в примере 4 Фиг 10 показывает прямую амплификацию интактного гена ксилитдегидрогеназы и не содержащего промотора гена XD из хромосомной ДНК Р Stipitis посредством полимеразной реакции цепи, расщепления BamHI-EcoRI X ДНК, дорожка 2 Ген (интактный) ксилитдегидрогеназы штамма Pichia, дорожка 3 Ген (не содержащий промотора) ксилитдегидрогеназы штамма Pichia, и дорожка 4 Молекулярные маркеры, расщепленная НаеШфХ ДНК, Фиг 11 дает диаграмму стратегий, использованных для секвенирования гена ксилулокиназы дрожжей, Фиг 12 является схематической диаграммой, представляющей в общих чертах конструирование плазмиды pLNH21, Фиг 13 показывает HPLC-хроматограмму бродильного бульона, полученного сбраживанием смеси глюкозы (10%) и ксилозы (5%) штаммом S cerevesiae SC (pLNH13 - 32) (содержащий только гены XR и XD) в течение (I) 0 дней, (II) 2 дней и (III) 5 дней, Фиг 14 показывает HPLC-хроматограмму бродильного бульона, полученного сбраживанием смеси глюкозы (10%) и ксилозы (5%) не модифицированными методами генной инженерии дрожжами Pichia stipitis, в течение (I) 0 дней, (II) 3 дней и (III) 5 дней Подробное описание изобретения С целью облегчения понимания принципов изобретения, далее, будут описаны, некоторые варианты его осуществления и для этого будет применен специальный язык Тем не менее, должно быть понятно, что это описание не предназначено для ограничения объема изобретения, и подобные изменения, дальнейшие модификации и приложения принципов изобретения, какие иллюстрируются здесь, должны быть очевидны специалистам в области, к которой относится настоящее изобретение Данное изобретение обеспечивает возможность получения рекомбинантных дрожжей, молекул ДНК и векторов, содержащих гены XR, XD и ХК Хорошо известно, что такие гены, встречаются в разнообразных микроорганизмах и, действительно, как обсуждалось выше, многочисленные гены XR, XD и ХК были идентифицированы и выделены Конкретный источник этих генов не является критическим для разнообразных аспектов применения этого изобретения, скорее, будут пригодны любые ДНК, кодирующие белки (ферменты), обладающие ксилозоредуктазной активностью (способностью превращать D-ксилозу в ксилитол с NADPH или (никотинамидодениндинуклеотидом восстановленным (NADH) в качестве ' кофактора), ксилитдегидрогеназной активностью (способностью превращать ксилитол в Dксилулозу с (никотинамидодениндинуклеотидом (окисленная форма NAD+)) в качестве кофактора) или ксилулозокиназной активностью (способностью превращать D-ксилулозу в О-ксилулозо-5фосфат) Эти гены могут быть получены в виде встречающихся в природе генов или модифицированы, например, путем присоединения, замены или деления оснований во встречающемся в природе гене до тех пор, пока кодируемый белок еще обладает XR, XD или ХК активностью Подобным же образом, эти гены или их части могут быть получены синтетически известными способами, опять-таки, пока полученная ДНК кодирует белок с необходимой XR, XD или ХК активностью Например, пригодными источниками генов XR или XD являются ксилозоокисляющие дрожжи, такие как Candida shehatae, Pichia stipitis Pachysolen tannophilus, пригодными источниками генов ХК являются указанные выше ксилозоокисляющие дрожжи, а также ксилозонеокисляющие дрожжи из рода Saccharomyces, например, S cerevisiae, из рода Schizosaccharomvces например, Schizosaccharomvces pombe и такие бактерии, как Eschenchia coh Bacillus spp Streptomvces spp и т д Представляющие интерес гены могут быть получены из этих источников при помощи общепринятых методик Например, с этой целью можно использовать гибридизацию, комплементацию или полимеразную реакцию цепи (РСК) Конкретный ген XR, использованный в исследованиях заявителей, клонировали из Р stipitis при помощи (PCR) (Чен и Хо, 1993) Олигонуклеотиды, необходимые для амплификации XR из хромосомной ДНК при помощи PCR, синтезировали согласно опубликованной последовательности гена XR Р stipitis (Такама и др , 1991) Амплифицированный ген XR сначала клонировали и хранили в плазмиде pUC19 Затем клонированный ген XR сливали с различными промоторами, втом числе промоторами гена TRP5 дрожжей (Залкин и Яновский, 1982) и гена алкогольдегидрогеназы I (ADC1) дрожжей (Айнмерер, 1983, Бенетцен и Холл, 1982) Ген XD, использованный в исследованиях заявителей, также клонировали из Р stipitis при помощи PCR Олигонуклеотиды, необходимые для амплификации XD из хромосомной ДНК Pichia, синтезировали в соответствии с опубликованной последовательностью гена XD Pichia (Кеттер и др , 1990) Амплифицированный ген X также сначала клонировали и хранили в pUC19 Затем этот ген последовательно сливали с гликолитическими промоторами гена пируваткиназы (PYK) 48125 10 дрожжей (Бурке и др , 1983) и геном глицеральдегид-3-фосфодегидрогеназы (GpD) дрожжей (Холланд иХолланд, 1979) Заявители клонировали три различных гена ХК из S cerevisiae (Хо и Чанг, 1989), Р tannophilus (Стевис и др , 1987) и Е coh и установили, что все три гена могут эффективно экспрессироваться в S cerevisiae после слияния с дрожжевым высокоэффективным промотором В иллюстративной работе, представленной здесь, использовали клонированный ген ксилулокиназы S cerevisiae Для правильного слияния гена ХК дрожжей с подходящим промотором, проанализировали полную нуклеотидную последовательность гена ХК S cerevisiae в том числе его 5'- и З'-некодирующую последовательность и она представлена на фиг 2 Большое разнообразие промоторов пригодно для применения в этом изобретении Вообще говоря, следует применять совместимые с дрожжами промоторы, способные регулировать транскрипцию генов XR, XD или ХК Такие промоторы доступны из многих известных источников, в том числе дрожжей, бактерий и других клеточных источников Предпочтительно, промоторы, применяемые в этом изобретении, должны быть эффективными, не ингибируемыми глюкозой, не требующими для индукции ксилозы В этом отношении, термин "эффективный" промотор, используемый в данном описании, относится к промотору, обеспечивающему высокий уровень транскрипции слитого гена Промоторы с такими характеристиками также широко доступны, и их применение в данном изобретении, согласно изложенным здесь объяснениям, будет находиться в компетенции специалиста с обычной квалификацией, так же как и слияние промоторов с генами XR, XD и ХК, клонирование продуктов слияния промотор/ген в подходящих векторах и применение этих векторов для трансформации дрожжей Все эти манипулирования могут быть выполнены при помощи общепринятых методов генной инженерии, хорошо известных в этой области и в литературе Более конкретно, в иллюстративной работе, описываемой здесь, ген ХК ксилулокиназы дрожжей сливали с промоторами из алкогольдегидрогеназы (ADCI) дрожжей, гена пируваткиназы (PYK) дрожжей, гена TRP5 дрожжей и т д ХК, слитый с промотором TRP5, применяли для конструирования pLNH21 (фиг 5), а ХК, слитый с промотором PYK, применяли для конструирования PLNH33 (фиг 7) Слияние генов XR, XD, и ХК с интактными промоторами из ADCI, PYK, GPD, и т д выполняли клонированием как фрагмента, содержащего специфический промотор, так и структурного гена XR, XD, и ХК на одной из плазмид Bluescript KS (Стратаген, Ла Джола, Калифорния), с последующим удалением нежелательных (лишних) нуклеотидов сайт-специфическим мутагенезом (Кункель и др , 1987) Таким образом, изобретение обеспечивает также получение нескольких производных pBluescnpt II KS(-) (именуемых далее pKS(-)), содержащих клонированный XD (слитый с ' промотором пируватгидрогеназы), XR (слитый с промо 12 11 48125 тором ADCI), и ХК (слитый с промотором пируватпромышленных дрожжей S cerevisiae и других киназы) Эти рекомбинантные плазмиды обознаштаммов чены как pKS(-) KD-AR (или A*R) -KK Четыре таТрансформацию дрожжей производными кие плазмиды были сконструированы, как pLSK15, либо pUCKmlO проводили электропорапредставлено в общих чертах на фиг 9 Эти цией по методу, описанному Беккером и Гуаренплазмиды имеют сходные, но не идентичные том (1991) Аутентичные дрожжевые трансфорструктуры XR, XD, и ХК (или KD-AR (или A*R) манты, содержащие производные pLSK15 или R КК), клонированные на этих плазмидах, могут pUCKmlO, выделяли, как описано далее Km , быть отделены от исходной плазмиды pKS(-) расприсутствующий в этих плазмидах, служил в качещеплением одной рестрикционной Xhol стве первичного селективного маркера, который наделяет любые клетки-хозяева, получающие Гены XR, XD, и ХК, слитые с подходящими одну из этих плазмид, устойчивостью к гораздо промоторами, клонировали затем на pLSK15 (фиг более высокой концентрации генетицина, присут3) или pUCKmlO (фиг 4) PLSK15, производное ствующего в среде Однако, некоторые дрожжеpl_X10 - 14 (Стевис и Хо, 1985), представляет совые клетки можно индуцировать для приобретебой низкокопийную плазмиду с числом копий приния устойчивости к такому же уровню генетицина, близительно, 10 в дрожжах (S cerevisiae) Она который переносят трансформанты, содержащие содержит репликон 2\х. дрожжей, который позволяэти плазмиды Поэтому не всякая устойчивая к ет этой плазмиде автономно реплицироваться в S генетицину колония является истинным трансcerevisiae и близкородственных видах PLSK15 формантом Сообщалось, что Ap R может быть содержит также ген устойчивости к генетицину экспрессирован в S Cerevisiae, но S cerevisiae (канамицину) (KmR) и ген устойчивости к ампицилустойчив к ампициллину без присутствия Ap R Талину (Ар и также атр г ), которые служат в качестким образом, Ар не может служить в качестве ве селективных маркеров в S cerevisiae и других селективного маркера для опосредуемой плазмидрожжах PLSK15 содержит также ген ХК, слитый дами трансформации дрожжей Тем не менее, с дрожжевым промотором TRP5 Таким образом, дрожжи, содержащие высокоэкспрессируемый гены XR и XD, слитые с подходящими 5'ApR, будут продуцировать достаточное количество некодирующими последовательностями, содерпенициллиназы и обеспечивать возможность жащими подходящие промоторы, встраивали в идентификации колоний, содержащих такие pLSKI5, для демонстрации воздействия получендрожжи, на специальных чашках с твердой средой ных плазмид на сбраживание ксилозы дрожжами при помощи теста на пенициллиназу (Шевалье и Для сравнения влияния присутствия различных Эйгле, 1979) Последний тест обеспечивал способ генов на сбраживание ксилозы дрожжами, плазидентификации истинных трансформантов S миду, содержащую только XR и XD, применяли cerevisiae и других дрожжей среди устойчивых к для трансформации S cerevisiae и полученные генетицину колоний дрожжи использовали для сравнительного сбраживания Результаты сбраживания ксилозы немоСбраживание ксилозы (или ксилозы и дифицированными генной инженерией дрожжами глюкозы) проводили с применением рекомбинантS cerevisiae дрожжами, содержащими клонироных дрожжей по данному изобретению прианаэванные XR, XD, и ХК (SC(pLNH21)) и дрожжами, робных условиях, как описано в примерах 6 - 9 содержащими клонированные XR, XD, но не ХК Потребление Сахаров (ксилозы и глюкозы) и обгены (SC(pLNH13 - 32)), показаны на фиг 6А, 6В, и разование этанола и других продуктов, таких как 6С ксилит, контролировали во время сбраживания посредством отбора проб и анализа их при помоPUCKmlO представляет собой мультикопийщи HPLC, как описано далее в примере 6 ную плазмиду (те плазмиду с числом копий, приНапример, pLNH21 (фиг 5) использовали, для близительно, 50 и более) с числом копий до 100 в трансформации S cerevisiae Полученный трансS cerevisiae PUCKmlO является производной от формант, содержащий pLNH21, обозначали pUC9, содержащей идентичный репликон 2ц, и SC(pLNH21) и он мог сбраживать 5%-ю ксилозу гены KmR, и ApR, присутствующие в pLSK15 Эти почти полностью до этанола в течение 2 - 4 дней, специфические фрагменты ДНК служат в качестве как показано на фиг 6А репликона и маркеров для отбора (селективных маркеров), которые позволяют плазмиде автоВ качестве дополнительного примера, pLNH33 номно реплицироваться в S cerevisiae (и в родст(фиг 7) использовали для трансформации дрожвенных дрожжах), а также позволяют отличить жевого штамма 1400, который близкородственен трансформанты дрожжей, содержащие эту плазS cerevisiae и обладает высокой устойчивостью к миду, от нетрансформированных клеток-хозяев спирту и температуре (Демур и др , 1989, Демур, 1990) Полученные генетическим конструированиЗаявители сконструировали рекомбинантные ем дрожжи, обозначенные индексом 1400 плазмиды на основе pUCKmlO, содержащие те же (PLNH33), могут сбраживать 10%-ю глюкозу и 5%самые гены XR, XD и ХК, слитые с подходящими ю ксилозу полностью до этанола в течение 2 - 4 5'-некодирующими последовательностями, содней, не требуя высокой плотности клеток, как держащими подходящие промоторы Эти векторы показано на фиг 8А и 8В предназначены для трансформации всех штаммов S cerevisiae и штаммов родственных видов PLNH33 в отношении сбраживания ксилозы Не требуются специальные мутанты в качестве является более эффективной плазмидой, чем реципиентных штаммов Таким образом, такие pLNH21, т к представляет собой мультикопийную плазмиды, как pLNH33 (фиг 7), а также pLNH21 плазмиду более высокого уровня Кроме того, ХК в (фиг 5), можно применять для трансформации pLNH33 слит с более эффективным промотором, 14 13 48125 чем ХК в pLNH21 S cerevisiae трансформировали среде в качестве источника углерода одновретакже плазмидой pl_NH33, обозначенной менно присутствуют как глюкоза, так и ксилоза SC(pLNH33) Хотя SC(pLNH33) гораздо более Следует понимать, что в случае дрожжей, обэффективна при сбраживании ксилозы или смесей ладающих низкими уровнями ксилулокиназной ксилозы и глюкозы, чем SC(pl_NH21), было обнаактивности, введение гена ХК служит двум целям ружено, что 1400 (pLNH33) при сбраживании смеОдна из них состоит в повышении уровня активносей глюкозы и ксилозы превосходит SC(PLNH33) сти фермента Высокие уровни активности ХК Таким образом, отдельные штаммы влияют на важны для преимущественного сбраживания до эффективность сбраживания Подобно S этанола ксилозы, в противоположность ксилиту cerevisiae не модифицированный методами генДругая цель состоит в том, чтобы поместить этот ной инженерии штамм 1400 не может использоген под контроль эффективного промотора, котовать или сбраживать ксилозу (одну или в смеси рый не должен ингибироваться присутствием глюглюкозы и ксилозы), как показано на фиг 8В козы Хорошо известно, что природные натуральные микроорганизмы, в том числе дрожжи, не В общем, результаты этих проб на сбраживамогут использовать другие сахара для роста и ние демонстрируют, что необходимо, чтобы сбраживания, если в культурной среде присутстдрожжи содержали три введенных гена, XR, XD и вует глюкоза Глюкоза будет ингибировать синтез ХК, должным образом слитых с подходящими ферментов, необходимых для метаболизации мопромоторами (предпочтительно, эффективными лекул других Сахаров (так называемый "глюкозгликолитическими или иными промоторами, котоный" эффект) Поэтому промоторы из генов для рые не ингибируются глюкозой и не требуют ксисинтеза ферментов, метаболизирующих молекулы лозы для индукции) и координировано экспрессиСахаров, за исключением глюкозы, не являются ровали эти гены, наделяя дрожжи способностью предпочтительными, поскольку они не будут обессбраживать ксилозу только до этанола, а не друпечивать одновременного сбраживания двух осгих побочных продуктов, таких, например, как ксиновных Сахаров Кроме того, работой заявителей лит было установлено, что рост клеток также является Далее, результаты демонстрируют важность необходимым условием для индукции Таким обклонирования гена ксилулокиназы (ХК) в дополнеразом, промоторы, требующие присутствия ксилоние к XR и XD, для того, чтобы заставить дрожжи зы для индукции, не пригодны для экспрессии XR, эффективно сбраживать ксилозу, в частности, XD или ХК одновременно сбраживать как глюкозу, так и ксилозу при их присутствии в одной и той же среде, Для облегчения дальнейшего понимания дантакой, например, как гидролизаты целлюлозной ного изобретения и его преимуществ даны слебиомассы Подобно XR и XD, клонированный ген дующие далее примеры Следует понимать, что ХК должен быть, предпочтительно, слит с подхоэти примеры, по своей природе, являются иллюдящим эффективным гликолитическим или иным стративными и не ограничивают объем изобретепромотором, который не ингибируется глюкозой и ния не требует ксилозы для индукции Пример 1 Заявители установили также, что дрожжи, соСинтез генов XR и XD при помощи PCR держащие лишь клонированные гены XR и XD, Синтез интактного или не содержащего промогут сбраживать до этанола только глюкозу, но мотора гена XR при помощи PCR был описан ране ксилозу при одновременном присутствии в нее (Чен и Хо, 1993) Для синтеза XD при помощи культурной среде обоих этих Сахаров (см фиг PCR синтезировали, в соответствии с нуклеотид13) Кроме того, результаты заявителей показыной последовательностью XD (Кеттер и др , 1990) вают, что любые дрожжи, в том числе и сбражитри олигонуклеотида, представленные ниже вающие ксилозу, например, Р stipitis и С shihatae Олигонуклеотид I должны содержать гены XR, XD и ХК, слитые с pTCTAGACCACCCTAAGTCG промоторами, которые не ингибируются присутстОлигонуклеотид II pCACACAATTAAAATGA вием глюкозы и не требуют применения ксилозы Олигонуклеотид III pGGATCCACTATAGдля индукции, чтобы обладать способностью TCGAAG сбраживать как глюкозу, так и ксилозу до этанола Олигонуклеотиды I и II применяли для синтеза в случае одновременного присутствия обоих этих интактного гена XD, а олигонуклеотиды II и III Сахаров в культурной среде фиг 13 показывает, применяли для синтеза, не содержащего промочто S cerevisiae и родственные виды, содержащие тора XD, как показано на фиг 10 Вначале интакттолько клонированные гены XR и XD, слитые с ный ген XD и не содержащий промотора ген XD соответствующими промоторами, могут сбражиклонировали в плазмиде pKS(-) Затем интактный вать до этанола только глюкозу, но не ксилозу, в XD субклонировали на pUCKmiO (фиг 4) и полуслучае присутствия обоих этих Сахаров в культурченную плазмиду pUCKm10-XD использовали для ной среде Подобным образом, фиг 14 показыватрансформации S cerevisiae электропорацией, как ет, что не модифицированные методами генной описано в примере 5 Трансформанты дрожжей инженерии дрожжи Р Stipitis содержащие свои использовали для определения ксилитдегидрогесобственные гены XR, XD, и ХК, могут сбраживать назной активности, чтобы показать, что клонироксилозу в том случае, когда этот сахар является ванный ген является интактным и может экспресединственным источником углерода в среде (ресироваться в S cerevisiae зультаты не показаны), но они не могут сбражиПример 2 вать ксилозу, в том случае, когда в одной и той же Слияние не содержащего промотора гена XD с промотором гена пируваткиназы дрожжей 16 15 48125 Слияние гена XD с Ррк было выбрано для илКонструирование pLNH21 представлено в облюстрации точного слияния метаболизирующих щем виде на фиг 12 pLNH21 применяли для ксилозу генов с интактными промоторами при потрансформации S cerevisiae и штамма - 1400 мощи сайт-направленного мутагенеза Этими электропорацией при следующих условиях 50мл промоторами являются либо гликолитические дрожжевых клеток, выращенных до ранней логапромоторы, либо промоторы, которые не ингибирифмической фазы роста (Klett Unit (KU) (единицы руются присутствием глюкозы в культурной среде Клетта, КЕ) 130)), центрифугировали для удалел и не требуют присутствия ксилозы для индукции ния среды, п ромы вал и щважды холодной водой, один раз холодным 1М сорбитом и суспендироваФрагмент промотора пируваткиназы дрожжей ли в 200мкл 1М сорбита бОмкл этих клеток переот -910 до +23 (Бурке и др , 1983) синтезировали носили в предварительно стерилизованную плапри помощи PCR, как описано в примере 1 для стиковую пробирку на 4мл (с крышкой), к которой синтеза гена XD Как фрагмент Ррк, так и не содобавляли 0,1 - 1мкг плазмидной ДНК 50мкл подержащий промотора ген XD субклонировали на лученных клеток и плазмидную смесь пипетироплазмиде pKS(-) и нежелательные нуклеотиды вали в предварительно охлажденную кювету генмежду Ррк и интактным структурным геном XD ного импульсного 'генератора с промежутком удаляли сайт-специфическим мутагенезом по мемежду электродами 0,2см и содержимое в кювете тоду Кункеля (Kunkel, 1987) Полученный слитый подвергали действию импульсов генного импульсген содержит фрагмент от -910 до -1 промотора из ного генератора с импульсным контроллером гена пируваткиназы и нуклеотид от +1 до +1963 из (BioRad) при 2,0кВ, 25мкФ, 200Ом гена XD Pichia Полученную плазмиду pKS(-), содержащую Ppk-XD (или KD) обозначили как pKS(-) В кювету сразу же добавили 0,5мл YEPD ( 1 % -KD или pKD2 дрожжевой экстракт, 2% пептон, 2% глюкоза) Содержимое кюветы переносили в новую стерилизоПример 3 ванную пластиковую пробирку на 4мл и инкубироАнализ нуклеотидной последовательности гевали при 30°С в течение 1 часа ЮОмкл клеток на ксилулокиназы дрожжей высевали в чашки с агаром, содержащие YEPD и О клонировании фрагмента дрожжевой ДНК 30мкг/мл G418 (генетицина) Быстро растущие (S cerevisiae) 7,0 т п н , содержащего ген ксилулоколонии отбирали и перепечатывали на другую киназы дрожжей, сообщалось ранее (Хо и Чанг, чашку, содержащую ту же самую среду Отобран1989) Посредством субклонирования ген ХК поные колонии подвергали пробе на ампициллин мещали, на фрагмент 2,4 т п н Последователь(Шевалье и Эйгле, 1979), пока не идентифицироность нуклеотидов фрагмента 2,4 т п н была подвали положительную колонию Описанный выше вергнута анализу 5'-некодирующий участок способ электропорации основан на способе, сосодержит 345 нуклеотидов, транслируемый учаобщенном Беккером и Гуарентом (1971) Наш спосток содержит 2118 нуклеотидов, кодируемая гесоб отбора устойчивых к G418 трансформантов ном ХК, имеет 591 аминокислоту, как показано на очень эффективен, и большая часть отобранных фиг 2 Стратегия, примененная для секвенироваколоний, перепечатанных на чашки, содержащие ния гена ХК, показана на фиг 11 YEPD с 50мкг/мл G418, дала положительный реПример 4 зультат при постановке пробы на пенициллиназу Конструирование интактного промотора ADCI Плазмида рМА5б (Аммерер, 1983) содержит Трансформацию штамма 1400 плазмидой промотор дрожжевой алкогольдегидрогеназы I pLNH21 или другими плазмидами проводили по (PADCI)- Заявители использовали в работе этот методу, сходному с вышеописанным, за исключепромотор для модификации некоторых генов нием того, что эти клетки выращивали не до 130, а PADCI был слит с XR и полученный ген был ободо 140 - 190 КЕ, и чашки с YEPD для первичного значен как PADCI-XK ИЛИ AR Тем не менее, этот отбора трансформантов после электропорации PADCI не является интактным и не содержит нуксодержали не 50, а 40мкг/мл генетицина (G418) леотиды от -1 до -14 интактного промотора ADCI Трансформация штамма 1400 по вышеописанно(Бенетцен и Холл, 1982) Участок гена от -1 до -14, му методу была не такой эффективной, как обычно очень важен для регуляции синтеза белка трансформация S cerevisiae Любой ген, слитый с таким промотором, должен Пример 6 полагаться на его первоначальный генетический Сбраживание ксилозы сконструированными сигнал для регуляции синтеза белкового продукта дрожжами SC(pLNH21), SC(pLNH13-32), и не модифицированными методами генной инженерии Для лучшей регуляции экспрессии этого гена, исходными дрожжами S cerevisiae слитого с промотором ADCI, заявители использовали сайт-специфический мутагенез для добавлеЭти три штамма дрожжей культивировали на ния отсутствующих нуклеотидов (от -1 до -14) к обогащенной среде YEPD аэробно при идентичпромотору ADCI, клонированному на рМА56 Ноных условиях (SC(pLNH 13-32) конструировали вый интактный промотор ADCI был обозначен, как трансформацией S cerevisiae плазмидой pLNH13P*ADCI- Этот промотор использовали для модифи32, содержащей только комбинации гены XR и XD кации XR и полученный ген был назван P*ADCI-XR промотор) Затем эти дрожжевые клетки испольили A*R зовали для сбраживания 5% ксилозы на среде YEP ( 1 % дрожжевой экстракт, 2% пептон) анаПример 5 эробно при идентичных условиях Потребление Конструирование плазмиды pLNH21 (также ксилозы и образование этанола и ксилита прообозначенной как pLSK15-KD-AR) и трансформаслеживали во время сбраживания путем отбора ция S Cerevisiae и штамма 1400 плазмидой проб через определенные промежутки времени и pLNH21 17 48125 анализа их при помощи HPLC при следующих условиях Пробы, содержащие бродильный бульон (0,6мл - 1,0мл), отбирали из культур и хранили в 1,5мл пробирках Эппендорфа Клетки и другие остатки сначала удаляли центрифугированием Затем супернатант фильтровали с применением стерильных аэродисковых (Gelman Sciences), 0,2 или 0,45мм, фильтр-насадок для шприцев Полученный фильтрат из каждой пробы анализировали на содержание этанола, глюкозы, ксилозы и ксилита при помощи жидкостной хроматографии высокого разрешения (HPLC, ЖХВР) с применением системы Hitachi в соответствии со следующими условиями °Колонка Ammex HPX-87C, 300 х 7 8мм °Подвижная фаза вода °Расход 0,8мл/мин °Детектирование детектор Hitachi L-3350 RI Температура 80°С °Объем нанесения 20мкл Результаты, представленные на фиг 6А, 6В, и 6С (пики этанола на этих и других рисунках на самом деле в 2,5 раза меньше, чем они должны быть, из-за чувствительности прибора), показывают, что только сконструированные дрожжи SC(PLNH21), содержащие клонированные гены XR, XD и ХК, могут сбраживать высокие концентрации ксилозы (5%) до этанола, чего не могут делать неизмененные методами генной инженерии исходные дрожжи S cerevisiae а также сконструированные SC(pLNH 13-32), которые содержат только клонированные XR и XD и не содержат ХК SC(pLNH13) сбраживает ксилозу, в основном, до ксилита Пример 8 Эффективное сбраживание высоких концентраций глюкозы и ксилозы дрожжами 1400 (pLNH33) до этанола Смесь глюкозы и ксилозы (приблизительно 10% глюкозы и 5% ксилозы) сбраживалась при помощи штаммов 1400 и 1400 (pLNH33) при идентичных условиях Эти дрожжи хранили на чашках с агаром, содержащим подходящие Среды, и инокулировали непосредственно из чашек с агаром в 50мл среду YEPD ( 1 % дрожжевой экстракт, 2% пептон, 2% глюкоза) в колбе Эрленмейера на 250мл, имеющей боковое плечо, позволяющее непосредственно наблюдать рост культур дрожжей при помощи колориметра Кпетта Культуры инкубировали на качалке при 30°С и 200об/мин при аэробных условиях Когда клетки достигали плотности клеток средней логарифмической фазы роста (400 единиц Кпетта), в каждую колбу добавляли 12, мл (40%) глюкозы и 6,25мл (40%) ксилозы После основательного смешивания 1мл культурной смеси отбирали из колбы, как пробу при времени 0 Затем колбу герметизировали при помощи обертки Saran для анаэробного сбраживания 1мл пробы бродильного бульона (с некоторым количеством клеток) отбирали через определенные промежутки времени (каждые 24 часа) для использования в качестве проб для измерения содержания сахара и этанола в бульоне во время брожения Содержание этанола, глюкозы и ксилита в пробах ана 18 лизировали при помощи HPLC, как описано в примере 6 Результаты, представленные на фиг 8А 8В, показывают, что созданные методами генной инженерии дрожжи 1400 (pLNH33) могут сбраживать 10% глюкозу и 5% ксилозу до этанола одновременно в течение 2 - 4 дней, не нуждаясь в высокой плотности клеток С другой стороны, исходный штамм 1400мог превращать в этанол только глюкозу, но не ксилозу Сбраживание проводили при нормальных условиях, без специальной среды, специального рН и без необходимости роста дрожжей до достижения высокой плотности клеток Таким образом, генетически сконструированные дрожжи 1400 (pLNH33), содержащие гены XR, XD, и ХК, слитые с гликолитическими промоторами и клонированные на мультикопийной плазмиде pUCKmiO, могут одновременно сбраживать высокие концентрации как глюкозы, так и ксилозы до этанола в течение 2 - 4 дней с образованием очень небольшого количества ксилита в качестве побочного продукта Пример 9 Пробное сбраживание ксилозы/глюкозы с помощью сконструированных дрожжей SC(pLNH 1332) Повторяли процедуру сбраживания примера 8, за исключением того, что в качестве сбраживающего организма использовали S cerevisiae SC(pLNH13-32), содержащий только гены XR и XD) Результаты, представленные на фиг 13, показывают, что такие полученные методами генной инженерии дрожжи, содержащие только гены XR и XD, могут сбраживать только глюкозу, но не ксилозу, в случае присутствия обоих Сахаров в сбраживаемой среде Пример 10 Пробное сбраживание ксилозы/глюкозы с помощью не модифицированных методами генной инженерии дрожжей Повторяли процедуру сбраживания примера 8, за исключением того, что в качестве сбраживающего организма использовали не модифицированный методами генной инженерии микроорганизм Pichia stipitis Пробы бродильного бульона анализировали посредством HPLC после сбраживания в течение (I) 0 дней, (II) 3 дней и (III) 5 дней Результаты, представленные на фиг 14, показывают, что Р stipitis могут сбраживать только глюкозу, но не ксилозу, в случае присутствия обоих Сахаров в одной и той же среде Хотя изобретение было проиллюстрировано рисунками и подробно описано в предшествующем описании, и то и другое следует рассматривать как иллюстративный, но не ограничивающий объема изобретения материал При этом следует понимать, что показаны и описаны только предпочтительные варианты осуществления, и что все изменения и модификации, входящие в объем изобретения, следует считать защищенными Ссылки Следующие ссылки, в пределах, в которых они обеспечивают методические или иные детали, дополнительные к изложенным здесь, специально включены здесь в виде ссылок Ammerer, С , "Expression of genes in yeast using the ADCI promoter", Methods in Enzymol 101, 192 201 (1983) 19 Amore, R, M Wilhelm, and С Р Hollenberg, "The fermentation of xylose An analysis of the expression of Bacillus and Actmoplanes xylose isomerase genes in yeast", Appl Microbiol Biotechnol , 30(4), 351 -357(1989) Becker, D, and L Guarente, "High efficiency transformation of yeast by eIectroporation", Methods in Enzymol 194,182-186(1991) Bennetzen, J L and В D Hall, "The primary structure of the Saccharomyces cerevisiae gene for alcohol dehydrogenase I," J Biol Chem , 257(6), 3018-3025(1982) Burke, R L ,P Tekamp-Olson, and R Najanan, "Tite isolation, and seguence of the pyruvate kmase gene jf Saccharomyces ctrtvisiae," J Biol Chem 250(4)2193-2201 (1983) Chang, S F and NWY Ho, "Cloning the yeast xylulokmase gene for the improvement of xylose fermentation " Appl Biochem Biotechnol 17, 313 - 318 (1988) Chen, Zhengdao, and NWY Ho, "Cloning and improving the expression of Pichia stipitis xylose reductase gene in Saccharomvces cerevisiae," Appl Biochem Biotechaol , 39 - 40, 135 -147 (1993) Chevalher, M R and M Aigle, "Qualitative detection of penicillmase produced by yeast strains carrying chimenc yeast-coh plasmids," FEBS Letters, 108(1) 179-184(1979) Chiang, L-C, H-Y Hsiao, P P Ueng, L-F Chem, and G T Tsao "Ethanol production from xylose by enzymic isomenzation and yeast fermentation," Biotechnol Bioeng , 11, 263-274(1981) D'Amore, С G , I Russell, and С С Stewart, "Selection and optimization of yeast suitable for ethanol production at 40°C," Enz Microbiol Technol , 1 1 , 411 (1989) D'Amore, T, С J Panchal, I Russell, and G G Stewart, "A study of ethanol tolerance in yeast, Critical Reviews," Biotechnol , 9, 287 (1990) Deng, X X and N W Y Ho, "Xylulokmase activity in various yeasts including Saccharomyces cerevisiae containing the cloned xylulokmase gene," Appl Diochem Biotechnol , 24 - 25, 193 (4990) DuPreez, J С and J P van der Walt, "Fermentation of D-xylose to ethanol by a strain by Candida shehatae," Biotechnol Lett, 5, 357 - 362 (1983) Grootjen, D R J , R С J M van der lans, and К Ch A M Luyben, "Effects of the aeration rate on the fermentation of glucose and xylose by Pichia stipitis CBS 5773, Enzyme Microb Technol, 12, 20 - 23 (1990) Hallborn, J , M Walfndsson, U Airaksmen, H Ojamo, В Hahn-Hagerdal, M Penttila, and S Ker'anen, "Xyhtol production by recombmant Saccharomyces cerevisiae, Bio/Technol , 9, 1090 (1991) Ho, N W Y , and S-F Chang, "Cloning of yeast xylulokmase gene by complementation of E coh and yeast mutations," Enzyme Microb Technol , 11, 417 (1989) Ho, M W Y , P Stevis, S Hosenfeld, J J Huang, and G T Tsao, "Expression of E coh xylose isomerase gene by a yeast promoter," Biotechnology and Bioenginenng Symposium, No 13, 245 - 250 (1983) Holland, J P and M J Holland, "The primary structure of a glyceraldehyde-3-phosphate dehydro 48125 20 genase gene from Saccharomyces cerevisiae," J Biol Chem 253(19)9839-9845(1979) Jeffries, T W , "Emerging technology for fermenting D-xylose Trends in biotechnology 3(8), 208 - 212 (1985) Jeffries, T W , "Utilization of xylose by bacteria, yeasts, and fungi," Adv in Biochem Engr Biotechnol 27, 1 -32(1983) Koetter, P , R Amore, С P Hollenberg, and M Cinacy, "Isolation and characterization of the Pichia stipitis xyhtol dehydrogenase gene, XYL2, and construction of a xylose-utilizing Sacchnromyces cerevisiae transform ant," Curr Genet, 18, 493 - 500 (1990) Koetter, P and M Cinacy, "Xylose fermentation by Saccharomyces cerevisiae," Appl Microbiol Biotechnol, 38, 776-783(1993) Kunkel, T A , J P Roberts, and efficient sitespecific mutagenesis without phenotypic selection," Methods Enzymol, 154, 367 - 382 (1987) Lastick, S , M Y Tucker, J R Beyett, G R Noll, and К Grohmann "Simultaneous fermentation and isomenzation of xylose to ethanol,"Appl Microbiol Biotechnol , 30, 574 - 579 (1989) Rosenfeid, S , P Stevis, and NWY Ho, "Cloning and characterization of the xyl genes from E coh," Мої Gen Genetics, 194, 410-415(1984)/ Sarthy, A V , et al , "Expression of the E coh xylose isomerase gene in S, cerevisiae, Appl Environ Microb , 53, 1996 - 2000 (1987) Stevis, P A , J J Huang, NWY Ho, "Cloning of the pachysolen tannophilus xylulokmase gene by complementation in Eschenchia coh " Appl Environ Micro (53) 1, 2975 - 2977 (1987) Stevis, P A and NWY Ho, "Overproduction of D-xylose isomerase in E coh by Cloning the D-xylose Isotnerase gene", Enzyme Microb _Technol, Vol 7, pp 592-596(1985) Strasser, A W M , С P Hollenberg, M Сіпасу, Р Koetter, R Amore, M Piontek, and J Hagedorn, "Cloning of yeast xylose reductase and xyhtol dehydrogenase genes and their use," German patent application (1990) Takuma, S , N Nnkashima, M Tantirungkij, S Kmoshita, H Okada, T Seki, and T Yoshida, "Isolation of xylose reductase gene of Pichia stipitis and its expression in Saccharomyces cerevisiae, "Appl Biochem Biotechnol ,27-28, 327(1991) Toivola, A , D Yarrow, E van den Bosch, J P van Dijken, and W A Scheffers "Alcoholic fermentation of D-xylose by yeasts," Appl Environ Microbiol , 47(6), 5 1221 -1223(1984) Wilhelm, M , and С Р Holtenherg, "Selective cloning of Bacillus subtihs xylose isomerase anu xylulokmase in E coh genes by IS5-mediated expression," the EMBO Journal, 3, 2555-2560 (1984) Zalkm, H and С Yanofsky, J Biol Chem 257, 1491 -1500(1982) (1) Информация общего хараісгера (і) Заявитель Ненси Хо и Джорж Т Цао (м) Название изобретения Рекомбинантные дрожжи для эффективного сбраживания глюкозы и ксилозы (ш) Числовая последовательность (iv) Адрес для переписки (А) Адресат Томас К Генри 48125 22 21 (B) Улица Bank One Tower, Suite 3700, 111 (A) Ф И О Томас К Генри Monument Circle (B) Регистрационный № 28,309 (C) Город Индианаполис (C) №дела PUR17/18 (D) Штат Индиана (їх) Сведения о телекоммуникационном сообщении (E) Страна США (F) Почтовый индекс 46204 (A) Телефон (317)634-3456 (v) Машиночитаемый носитель дискета 3,5 (B) Телефакс (317)637-7561 дюйма, 1,4 мегабайта (2) Информация для SEQ ID №1 (B) Компьютер COMPAQ (і) Характеристики последовательности (А) Длина 2467п н (C) Операционная система MS-DOS (D) Кодировка ASCII (B) Тип нуклеотид, аминокислота (vi) Сведения о заявке (C) Количество цепей две (A) № заявки 08/148,581 (D) Топология линейная (B) Дата подачи заявки 8 ноября 1993 (м) Тип молекулы Геномная ДНК (xi) Описание последовательности SEQ ID (C) Классификация №1 (VII) Данные о предшествующей заявке нет (VIM) Сведения о поверенном GGATCCAAGA ССАТТАТТСС ATCAGAATGG AAAAAAGTTT AAAAGATCAC 50 GGAGATTTTG TTCTTCTGAG CTTCTGCTGT CCTTGAAAAC АААТТАТТСС 100 GCTGGCCGCC ССАААСАААА ACAACCCCGA ТТТААТААСА TTGTCACAGT 150 ATTAGAAATT ТТСТТТТТАС АААТТАССАТ TTCCAGATTA СТАСТТССТА 200 ТААТССТСАА TCTTCAGCAA GCGACGCAGG GAATAGCCGC TGAGGTGCAT 250 AACTGTCACT TTTCAATTCG GCCAATGCAA TCTCAGGCGG ACGAATAAGG 300 GGGCCCTCTC GAGAAAAACA AAAGGAGGAT GAGATTAGTA CTTTA ATG TTG Met Leu 351 23 24 48125 NADP (NAD) Ксилит NADPH (NADH) NAD* D-Ксилоза NADH + H+ D-Ксилулоза і •• j Ксилуяокиназа В-Ксилулоза-5-Фосфат і і І . Путь обмена пснтозофосфата Пути метаболизма ксилозы в микроорганизмах Ксилозонсокисляющие дрожжи (Saccharomyces ccrevisiae, Schizosaccharomyces pombe, etc.) Ксилозоокисляюище дрожжи (Candida shehatac, Pichia stipitis, Pachysolcn tannophilus, etc.) Бактерии (E. coli, Bacillus species, Streptomyces species, etc.) ФИГ. 1 25 48125 26 1 GGATCCAA>yi.CCATTATTCCATCAGAATGGAAAAAAGTTTAAJtAGATCACGGAGATTTrG 61 TTCTTCTGAGCTTCTGCTGTCCTTGAAAACAAATTATTCCGCTGGCCGCCCCAAACAAAA 121 ACAACCCCiiATTTAATAACATTGTCACACTATTAGAAATTTTCTTTTTACAAATTACC?l.T iai 241 TTCCAGCT':ACTACTTCCTATAATCCTCAATCTTCAGCAAGCGACGCAGGGAATAGCO.^=— TGAGGTGCi^TAACTGTCACTTTTCAATTCGGCCAATGCAATCTCAGGCGGACGAATAACHS 301 GGGCCCTC"CGAGAAAAACAftAAGGAGGATGAGATTAGTACTTTAAIGTTGTGTTCAG'rA M L С S V 3 61 ATTCAGAG.iCAGACAAGAGAGGTTTCCAACACAATGTCTTTAGACTCATACTATCTTG(X I Q R Q T R B V S N T M S L D S Y X L U 421 TTTGATCT"TCGACCCAACAACTGAAATGTCTCGCCATTAACCAGGACCTAAAAATTGTC F D L S T Q Q L K C L A I N Q D L K I Y 4 31 CATTCAGAJ ACAGTGGAATTTGAAAAGGATCTTCCGCATTATCACACAAAGAAGGGTG*!1^ H S E T V E F E K D L P H Y H T K K G 1 / 541 TATATACACGGCGACACTATCGAATGTCCCGTAGCCATGTGGTTAGGGGCTCTAGATCC'G Y I H G D T I E C P V A M H L G A L D j . 601 GTTCTCTC(iAAATATCGCGAGGCTAAATTTCCATTGAACAAAGTTATGGCCGTCTCAG(:;G V L S K Y R E A K F P - L N K V M A V S c;: 661 TCCTGCCACCAGCACGGGTCTGTCTACTGGTCCTCCCAAGCCGAATCTCTGTTAGAGC^A S C Q Q H G 5 V X W S S Q A E S L L E 0 721 TTGAATAA 23 .76 Ксилоза • Этанол з Ксилит со О) 37 48125 38 п о о О II I ш п • о ш ФИГ. 6С а. 'л 40 48125 39 Pst] pUCKmlO (7.57 kb) Plac НіпсІШ BamHI pLNH33 ФИГ 7 oo > 2.24 Э .74 13 ' .44 .31 .1* Глюкоза Ксилоза Этанол 444 2 і .7» 24 . 3 4 го СП JT3 Ксилоза ІЗ ІЗ Этанол .52 34 . И 1 *• lazxa є s .44 — Глюкоза ' Ксилоза Этанол 34 „Г* оо го ел ta л 2 — Ксилоза г.зг — Э т а н о л 45 48125 Bamlll хк K K PS -K K HK Xhol н Y , За Заполнение Xhol/Xbal Заполнение Bnmll] кк J, Лигирование Bamlll ХІ10Г* Xhol Xhol Xhol pLXltl I pLXRi:i I Bamlll Y BanU-U Лигирование Лигирование Р А П Г | XII AR Xhol KK JJaniHI Xliol x | m J KK BamlllBaml-U b^LJ KD Xhol pKS(-)-KK-AR-KDO KK ШтШВатШ I A*R І KD pKS(-j-KK-A*R-KD-2 ФИГ, 9 Bnmlll AR 1 Ku ^ xhol pKS(-)-KK-AR-KP-4 Строение плазмид pKS(-)-KK-AR-KD — Xhol сайт был восстановлен после лигирования. 47 48125 48 Прямая амплификация интактного гена ксилитдегидрогеназы (XD) и не содержащего промотора гена из хромосомной ДНК Pichia stipitis посредством полимеразной реакции цепи. 1. Молекулярные маркеры, расщепленная BamHI-EcoRl X ДНК. 2. Ген (интактный) ксилитдегидрогеназы штамма Pichia. 3. Ген (не содержащий промотора) ксилитдегидрогеназы штамма Pichia. 4. Молекулярные маркеры, расщепленная НаеШфХ ДНК. ФИГ. ю 49 BamHI Xhol 48125 BgUI Hind III Kpnl Субклонированием Синтетическим праймером (19гаег) Делецией, генерированной ехо~1П ФИГ. и 50 Xhol 48125 51 KD Xhol 52 BaniHJ хк Xbal LSK15 pKS-KD(pKD2) P ВатШ Заполнение Xhol/Xbal Заполнение ВашДІ Лигирование Xhol XK Лигирование ВатШ Xhol ФИГ 12 ВатШ f ВатЮ 53 54 48125 іе ,7i Глюкоза Ксилоза S .P п .35 Ксилоза э Этанол и .зі Ксилоза 3 13 .46 го О (D Q ) 0) •4 • a о Із о СП СП X X о о го > < —*• з Ксилоза S о го о ±1 7 ^ ГО О о го о го СП s .р Ксилоза 17 .-12 Э т а н о л СП О)
ДивитисяДодаткова інформація
Назва патенту англійськоюRecombinant yeasts (versions), recombinant dna molecule, vector, method of the recombinant yeasts production, method for xylose fermenting to ethanol, method for glucose fermenting to ethanol
Назва патенту російськоюРекомбинантные дрожжи (варианты), рекомбинантная молекула днк, вектор, способ получения рекомбинантных дрожжей, способ сбраживания ксилози в етанол, способ сбраживания глюкозы в етанол
МПК / Мітки
МПК: C12N 9/12, C12N 9/04, C12P 7/06, C12N 9/02, C12N 1/19, C12N 15/09
Мітки: днк, рекомбінантні, дріжджів, варіанти, молекула, зброджування, вектор, етанолу, одержання, рекомбінантна, рекомбінантних, глюкози, дріжджі, ксилози, спосіб
Код посилання
<a href="https://ua.patents.su/28-48125-rekombinantni-drizhdzhi-varianti-rekombinantna-molekula-dnk-vektor-sposib-oderzhannya-rekombinantnikh-drizhdzhiv-sposib-zbrodzhuvannya-ksilozi-do-etanolu-sposib-zbrodzhuvannya-glyu.html" target="_blank" rel="follow" title="База патентів України">Рекомбінантні дріжджі (варіанти), рекомбінантна молекула днк, вектор, спосіб одержання рекомбінантних дріжджів, спосіб зброджування ксилози до етанолу, спосіб зброджування глюкози до етанолу</a>